
- •1. Предмет орг.Химии. Этапы развития. Сырьевые источники. Функциональная группа. Классификация и номенклатура.
- •3. Теория строения Бутлерова. Формулы органических соединений. Формулы Льюиса. Электронная теория строения. Атомная и молекулярная орбитали. Способы образования ковалентной связи.
- •Формулы органических веществ по классам
- •4. Взаимное влияние атомов в молекулах органических соединений. Эффекты электронных смещений. Индуктивный и мезомерный эффекты. Эффект гиперконьюгации. Стерический эффект.
- •Классификация по направлению реакции
- •Нуклеофильные реагенты
- •Электрофильные реагенты
- •6. Кислоты и основания в орг.Химии. Сопряженная кислота и сопряженное основание. Кислотно-основные равновесия, примеры. Влияние заместителей в молекуле на кислотность и основность.
- •7. Типы изомерии в органической химии. Структурная, пространственная и оптическая изомерии. Хиральность. Комформация и конфигурация. R,s, z,e – номенкулатуры.
- •8. Строение алканов. Sp3- состояние углерода. Характеристика связей с-с и с-н. Принцип свободного вращения. Конформация. Способы изображения и номенклатуры. Физические свойства алканов.
- •10. Предельные углеводороды (алканы). Химические и физические свойства: реакции радикального замещения. Галогенирования, нитрирование, сульфохлорирование, сульфоокисление. Понятие о цепных реакциях.
- •Реакции радикального замещения
- •12. Алкены. Гомологический ряд. Номенклатура. Строение. Sp2 – гибридизация. Изомерия. Физические свойства. Способы получения из алканов. Механизм элиминирования. Правило Зайцева.
- •Дегидрирование алканов
- •Гидрирование алкинов
- •Реакции электрофильного присоединения
- •Применение
- •Физические свойства
- •Гидрогенизированный атом углерода – тот атом, к которому присоединен водород. Наиболее гидрогенизированный – там где больше всего н
- •Реакции олигомеризации
- •Строение бензола
- •Изомерия
- •Номенклатура
- •Изомерия
- •Номенклатура
- •1. Нитрование:
- •2. Галогенирование:
Применение
Для производства оксида пропилена, получения ацетона, акриловой кислоты, пластмасс, каучуков, моющих средств, компонентов моторных топлив, растворителей.
Бутиле́н (буте́н) C4H8 — непредельный углеводород. Бутилен — бесцветный газ с характерным запахом, температура кипения −6.6 °C, смеси бутилена с воздухом взрывоопасны.
В промышленности бутилен получают дегидратацией бутанола при 300—350 °C; дегидрированием бутана, крекингом нефти.
Бутилен широко используют для синтеза бутадиена, бензина, бутанола, изооктана и полиизобутилена.
17. Типы алкадиенов. Диеновые углеводороды с сопряженными двойными связями. Дивинил. Изопрен. Способы получения: из гликолей, спирта (метод Лебедева), из ацетона и ацетилена (метод Фаворвского), изобутилена и формальдегида, дегидрогенизацией.
Это непредельные углеводороды, в молекулах которых присутствуют две двойные связи. Общая формула алкадиенов - СnH2n-2, где n ≥ 4.
Диены могут быть:
a) кумулированными – обе двойные связи принадлежат одному атому углерода
СH2=C=CH2 - пропадиен CH2=C=CH-CH3 - бутадиен-1,2
б) сопряженными (конъюгированными) - разделены одной простой связью
СH2=CH-CH=CH2 - бутадиен-1,3; CH3-CH=CH-CH=CH2 - пентадиен-1,3
в) изолированными - разделены двумя и более простыми связями
CH2=CH-CH2-CH=CH2 - пентадиен-1,4
Наибольшее практическое значение имеют диены с сопряженными связями.
Бутадие́н-1,3 (дивинил) СН2=СН—СН=СН2 — ненасыщенный углеводород, простейший представитель сопряжённых алкадиенов.
Физические свойства
Бутадиен — газ с характерным запахом, температура кипения -4,5 °C. Плохо растворим в воде, хорошо растворим в спирте, керосине с воздухом.
Применение: Полимеризацией бутадиена получают синтетические каучуки.
Изопрен (2-метилбутадиен-1,3) — ненасыщенный углеводород, принадлежащий алкадиенам, представляющий собой бесцветную летучую жидкость с характерным запахом. Является мономером натурального каучука
Изопрен растворим во многих органических растворителях. Плохо растворим в воде. Основное применение в промышленности — синтез изопреновых каучуков, некоторых медицинских препаратов, душистых веществ.
Получение алкадиенов из этилового спиртов по методу С.В.Лебедева при 580оС и с участием катализаторов - Al2O3, ZnO.
2C2H5OH => СH2=CH-CH=CH2 + H2 + 2H2O
Дегидратация гликолей
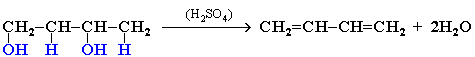
Хлоропрен получают из винилацетилена:
CH2=CH-C≡СH + HCl = >СH2=CCl-CH=CH2
 18.
1,3 – алкадиены. Особенности молекулярной
структуры. Химические свойства. Реакции
электрофильного присоединения (механизм)
: 1,2- и 1,4-присоединение. Цикло присоединение
по Дильсу-Альдеру. Полимеризация и
сополимеризация диенов. Натуральный и
синтетический каучук.
18.
1,3 – алкадиены. Особенности молекулярной
структуры. Химические свойства. Реакции
электрофильного присоединения (механизм)
: 1,2- и 1,4-присоединение. Цикло присоединение
по Дильсу-Альдеру. Полимеризация и
сополимеризация диенов. Натуральный и
синтетический каучук.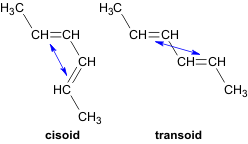
Если между двумя двойными связями находится одна одинарная связь, то такие алкадиены называются алкадиенами-1,3 или сопряженными диенами, например,
СН2=СН–СН=СН2 бутадиен-1,3.
Структурные исследования молекулы бутадиена–1,3 показали, что все ее атомы лежат в одной плоскости. Наиболее вероятным является расположение двойных связей в транс-конформации по отношению к одинарной связи.
Особенностью сопряженных диенов является то, что двойные связи в их молекулах функционируют как единое целое и присоединение идет преимущественно по крайним положениям сопряженной системы (1,4-присоединение) с образованием новой двойной связи в центре системы. Параллельно, однако, идет второстепенная реакция присоединение по одной из 2 двойных связей (1,2-присоединение).
1.Гидрирование.
При гидрировании бутадиена-1,3 получается бутен-2, т.е происходит 1,4-присоединение. При этом двойные связи разрываются, к крайним атомам С1 и С4 присоединяются атомы водорода, а свободные валентности образуют двойную связь между С2 и С3
CH2=CH-CH=CH2 + H2 =CH3-CH=CH-CH3 (бутен-2)
2. Галогенирование. Присоединение галогенов, галогеноводородов происходит по электрофильному механизму. Галогенирование сопряженных диенов происходит постепенно. ПИСАТЬ В ОТВЕТ ТРИ РЕАКЦИИ!
1,4-присоединение. CH2=CH-CH=CH2 + Br2=> СH2Br-CH=CH-CH2Br -1,4-дибромбутен-2
1,2- присоединение CH2=CH-CH=CH2 + Br2 => СH2Br-CHBr-CH=CH2 1,2-дибромбутен-1 СH2Br-CH=CH-CH2Br Br2 => СH2Br-CHBr-CHBr-CH2Br (1,2,.3,4-тетрабромбутан).
3.
Диеновый синтез ( реакция Дильса –
Альдера) – присоединение к сопряженным
диенам соединений, содержащих кратные
связи ( диенофилы). Реакция идет как
1,4-присоединение и приводит к образованию
циклических продуктов. И ДА, РИСУЙ ЭТИ
ФИГОВИНЫ!
Реакции полимеризации также проходят с перемещением двойной связи и
приводят к образованию каучуков.
nСH2=CH-CH=CH2 => (-CH2-CH=CH-CH2-)n полибутадиен (дивиниловый каучук)
nCH2=C(CH3)-CH=CH2 => (-CH2-C(CH3)=CH-CH2-)n полиизопреновый каучук
nCH2=CCl-CH=CH2 => (-CH2-CCl=CH-CH2-)n хлоропреновый каучук.
Натуральный каучук получают из млечного сока (латекса) дерева гевеи. Натуральный каучук обладает уникальным комплексом свойств: высокой текучестью, устойчивостью к износу, клейкостью, водо- и газонепроницаемостью. Для придания каучуку необходимых физико-механических свойств: прочности, эластичности, стойкости к действию растворителей и агрессивных химических сред – каучук подвергают вулканизации нагреванием до 130-140°С с серой.
В 1932 году С.В.Лебедев разработал способ синтеза синтетического каучука на основе бутадиена, получаемого из спирта. В настоящее время в промышленности выпускают каучук,в котором содержание звеньев изопрена, соединенных в положении 1,4, достигает 99%, тогда как в натуральном каучуке они составляют 98%.
19. Ацетиленовые углеводороды. Гомологический ряд. Изомерия. Номенклатура. Строение тройное связи, sp-гибридизация. Способы получения алкинов: из алканов, оксидов углерода, галогенпроизводных, карбида кальция, алкилированием ацетиленидов.
Алкины (ацетиленовые углеводороды) - углеводороды, имеющие в своей молекуле тройную связь. Общая формула алкинов - CnH2n-2 (n ≥ 2). Простейший алкин ацетилен.
Гомологический ряд алкинов:
Этин (ацетилен): C2H2
Пропин: C3H4
Бутин: C4H6
Пентин: C5H8
Гексин: C6H10
Гептин: C7H12
Октин: C8H14
Нонин: C9H16
Децин: C10H18
Для них характерны 2 вида изомерии - изомерия положения тройной связи и изомерия углеродного скелета.
При названии алкинов нумерацию цепи начинают с того конца, ближе к которому находится тройная связь. Алкины, содержащие до 4 атомов углерода - газы, начиная с углеводородов с 5 атомами углерода - жидкости, начиная с С16Н30 - твердые тела.
Атомы углерода при тройной связи находятся в состоянии sp-гибридизации и имеют два гибризованных электрона, которые образуют две σ-связи. Одна σ-связь соединяет атомы углерода (sp-sp-связь), вторая - атомы углерода и водорода (sp-s-связь). Эти связи располагаются на одной линии под углом 180о. Две π-связи между атомами углерода образуются негибридизованными р-электронами. Таким образом, тройная связь является комбинацией одной σ- и двух π-связей.
Получение
1.Термическим крекингом метана(алкана) или его ближайших гомологов этана и пропана при высокой температуре (1200 -1500о). Основной способ получения ацетилена.
2CH4 => CH≡СН + 3H2 ; 2C2H6 => CH≡СН + 2H2
2. Дегидрогалогенированием дигалогенпроизводных алканов, содержащих галогены у одного или у соседних атомов углерода, путем нагревания со спиртовым раствором щелочи. Этим путем получают не только ацетилен, но и его гомологи. ДЛЯ ПРИМЕРА ХВАТИТ 1 РЕАКЦИИ.
CH3-CHCl2 + 2KOH => CH≡CH + 2KCl + 2H2O
CH2Cl-CH2Cl + 2KOH => CH≡CH + 2KCl + 2H2O
CH2Cl-CHCl-CH3 + 2KOH => CH≡C-CH3 + 2KCl + 2H2O
3. Разложением карбида кальция водой. Это один из основных способов получения ацетилена. В промышленности карбид кальция получают совместным прокаливанием оксида кальция или кальция с углем.
СаС2 + Н2О => C2H2 + Ca(OH)2
4. Разложением ацетиленидов кислотами.
Cu-C≡С-Cu + 2HCl => СH≡СН + 2СuCl; СаС2 + 2HCl => C2H2 + CaCl2
20. Ацетиленовые углеводороды. Химические свойства: гидрирование, реакции электрофильного присоединения галогенов, галогеноводородов. Реакция Кучерова. Механизм реакций.
Алкины (ацетиленовые углеводороды) - углеводороды, имеющие в своей молекуле тройную связь. Общая формула алкинов - CnH2n-2 (n ≥ 2). Простейший алкин ацетилен.
Особенностью ацетилена и других алкинов, имеющих концевую тройную связь, является их способность отщеплять протон (кислотные свойства) под действием оснований, вследствие сильной поляризации связи ≡С-Н.
Реакция присоединения к алкинам идет ступенчато. На первой стадии идет присоединение к тройной связи с образованием двойной связи, на второй - присоединение к двойной связи с образованием насыщенного соединения.
Гидрогенирование (на никелевом или палладиевом катализаторе).
СН≡СН + H2 => СH2=CH2 + H2 => СH3-CH3
Галогенирование (например реакция обесцвечивание бромной воды). Реакция присоединения галогеноводорода протекает по электрофильному механизму

 СН≡СН
+ Br2
=> СHBr=CHBr + Br2
=>
СHBr2-CHBr2
СН≡СН
+ Br2
=> СHBr=CHBr + Br2
=>
СHBr2-CHBr2
1,2-дибромэтен 1,1,2,2-тетрабромэтан
Гидрогалогенирование При полном гидрогалогенировании алкинов соблюдается правило Марковникова. Марковникова правило: при присоединении протонных кислот или воды к несимметричным алкенам или алкинаматом водорода присоединяется к наиболее гидрогенизированному атому углерода
