
- •1. Предмет орг.Химии. Этапы развития. Сырьевые источники. Функциональная группа. Классификация и номенклатура.
- •3. Теория строения Бутлерова. Формулы органических соединений. Формулы Льюиса. Электронная теория строения. Атомная и молекулярная орбитали. Способы образования ковалентной связи.
- •Формулы органических веществ по классам
- •4. Взаимное влияние атомов в молекулах органических соединений. Эффекты электронных смещений. Индуктивный и мезомерный эффекты. Эффект гиперконьюгации. Стерический эффект.
- •Классификация по направлению реакции
- •Нуклеофильные реагенты
- •Электрофильные реагенты
- •6. Кислоты и основания в орг.Химии. Сопряженная кислота и сопряженное основание. Кислотно-основные равновесия, примеры. Влияние заместителей в молекуле на кислотность и основность.
- •7. Типы изомерии в органической химии. Структурная, пространственная и оптическая изомерии. Хиральность. Комформация и конфигурация. R,s, z,e – номенкулатуры.
- •8. Строение алканов. Sp3- состояние углерода. Характеристика связей с-с и с-н. Принцип свободного вращения. Конформация. Способы изображения и номенклатуры. Физические свойства алканов.
- •10. Предельные углеводороды (алканы). Химические и физические свойства: реакции радикального замещения. Галогенирования, нитрирование, сульфохлорирование, сульфоокисление. Понятие о цепных реакциях.
- •Реакции радикального замещения
- •12. Алкены. Гомологический ряд. Номенклатура. Строение. Sp2 – гибридизация. Изомерия. Физические свойства. Способы получения из алканов. Механизм элиминирования. Правило Зайцева.
- •Дегидрирование алканов
- •Гидрирование алкинов
- •Реакции электрофильного присоединения
- •Применение
- •Физические свойства
- •Гидрогенизированный атом углерода – тот атом, к которому присоединен водород. Наиболее гидрогенизированный – там где больше всего н
- •Реакции олигомеризации
- •Строение бензола
- •Изомерия
- •Номенклатура
- •Изомерия
- •Номенклатура
- •1. Нитрование:
- •2. Галогенирование:
Гидрогенизированный атом углерода – тот атом, к которому присоединен водород. Наиболее гидрогенизированный – там где больше всего н
СН≡СН + HСl => СH2=CHCl + HCl => СH3-CHCl2
(хлорвинил) (1,1-дихлорэтан)
Гидратация ацетилена (реакция Кучерова) идет при пропускании ацетилена в воду, в которой содержится соль двухвалентной ртути и серная кислота. Сначала образуется нестойкое соединение - виниловый спирт, который тут же изомеризуется до уксусного альдегида. Гомологи ацетилена также способны присоединять воду.
СН≡СН + H2O => СH2=CH-OH (изомеризация) => СH3-COH
21. Алкины. Реакции нуклеофильного присоединения спиртов, синильной и уксусной кислоты. Понятия о нуклеофильном механизме присоединения по тройной связи. Карбонилирование алкинов. Окислительные превращения алкинов. Олигомеризация и полимеризация. Применение в промышленности.
Алкины (ацетиленовые углеводороды) - углеводороды, имеющие в своей молекуле тройную связь. Общая формула алкинов - CnH2n-2 (n ≥ 2). Простейший алкин ацетилен.
Присоединение уксусной кислоты в присутствии фосфорной кислоты.
Образующийся винилацетат служит сырьем для производства поливинилацетата-основного компонента известного клея ПВА.
СН≡СН + CH3COOH => СH2=CH-O-CO-CH3
Характерным примером реакции нуклеофильного присоединения является Реакция Фаворского — присоединение спиртов в присутствии щелочей с образованием алкенильных эфиров:
![]()
Присоединение синильной кислоты
![]()
Реакции полимеризации
1. Димеризация идет в присутствии хлорида меди (I). Образующийся винилацетилен
служит сырьем для получения хлоропрена. Винилацетилен способен к дальнейшей
полимеризации и присоединяя молекулу ацетилена образует дивинилацетилен.
СН≡СН + СН≡СН => СH2=CH-С≡СН;
2. Тримеризация - объединение 3-х молекул ацетилена с образованием бензола
3СН≡СН => С6H6
Реакции олигомеризации
В присутствии солей меди(I) и хлорида аммония в водной среде ацетилен вступает в реакцию олигомеризации с образованием винилацетилена:
![]()
Реакция может идти дальше с образованием дивинилацетилена:
![]()
Реакции окисления
1. Ацетиленовые углеводороды легко окисляются при действии обычных окислителей, а при энергичном окислении разрываются по месту тройной связи. Так, ацетилен окисляется раствором перманганата калия до щавелевой кислоты (оксалата калия).
3СН≡СН + 8KMnO4 =>3KOOC-COOK + 8MnO2 + 2KOH + 2H2O
2. Горение - огромное количество тепла, выделяющееся при сгорании ацетилена в кислороде, позволяет проводить резание и сваривание металлов.
2СН≡СН + 5О2 => 4СО2 + 2H2O ∆H = -3200 кДж
Применение
Из всех ацетиленовых углеводородов серьёзное промышленное значение имеет только ацетилен, который является важнейшим химическим сырьём. Его применение:
1. В качестве топлива при резке и сваривании металлов
2. Производство ацетальдегида, а из него уксусную кислоту и этанол.
3. Производство хлорвинила сырья для получения медицинского полимера -
полихлорвинила.
4. Производство винилацетилена - сырья для получения хлоропренового каучука,
поливинилацетата.
22. Ацетиленовые углеводороды: С-Н-кислотные свойства алкинов с концевой тройной связью. Константа кислотности. Реакции замещения. Образование ацетиленидов, их свойства и синтетическое применение. Реакции альдегидов и кетонов с алкинами.
Кислотные свойства алкинов с концевой тройной связью
1. Ацетилениды. Ацетилен взаимодействует с металлическим натрием в среде жидкого аммиака:
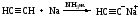
2. Реакция с альдегидами и кетонами:

Реакции замещения
1. В отличие от этана и этилена, ацетилен имеет кислотные свойства. Атом водорода при углероде с тройной связью способен замещаться на атом металла. Так при пропускании ацетилена через аммиачный раствор нитрата серебра выпадает белый осадок ацетиленида серебра, аммиачный раствор хлористой меди дает красный осадок ацетиленида меди. Ацетилениды легко взрываются при ударе или нагревании. К ацетиленидам относится и карбид кальция СаС2.
СH≡СН + 2[Ag(NH3)2]Cl => Ag-C≡С-Ag + 2NH4Cl
Ацетилениды разрушаются кислотами
Ag-C≡С-Ag + 2HCl => СH≡СН + 2AgCl
Ацетилениды щелочных и щелочно-земельных металлов используются для получения гомологов ацетилена.
23. Циклопарафины. Изомерия. Номенклатура. Методы получения: из дигалогенпроизводных, из солей дикарбоновых кислот, гидрогенизацией ароматических углеводородов, дегидроциклизацией парафинов, реакциями циклоприсоединения.
Циклоалканы(циклопарафины) - это насыщенные циклические углеводороды с общей формулой СnH2n. Циклоалканы могут иметь циклы, включающие три, четыре, пять, шесть и семь атомов углерода.
Осн. природный источник циклоалканов - нефть
Для циклоалканов характерны следующие виды изомерии:
Изомерия углеродного скелета
Пространственная
Межклассовая изомерия с алкенами
Все атомы углерода в молекулах циклоалканов имеют sp³-гибридизацию. Однако величины углов между гибридными орбиталями в циклобутане и особенно вциклопропане не 109°28', а меньше из-за геометрии.
Методы получения:
Дегалогенирование дигалогенпроизводных алканов
H2C-CH2-Br + Mg => Н2С-СН2 + MgBr2
Гидрирование бензола и его гомологов (образуются циклогексан или его производные):
С6Н6 +3Н2 = С6Н12
24. Циклопарафины. Пространственное строение. Напряжение цикла, его виды. Инверсия цикла. Особенности химических свойств циклоалканов, реакции замещения, раскрытия, сужения и расширения кольца. Нахождение в природе и применение моно-, би- и полициклоалканов.
Все атомы углерода в циклоалканах находится в состоянии sp3-гибридизации и образуют 4 σ-связи. Однако углы между связями зависят от размера цикла. В циклопропане и циклобутане они составляют, соответственно, 60 и 90, (нормальный валентный угол 109,280), что создает в этих молекулах напряжение, поскольку перекрывание орбиталей идет вне прямой, соединяющей ядра атомов углерода. Эти сигма-связи изогнуты подобно банану и называются «банановыми». Поэтому циклы в напряженных циклоалканах неустойчивы и легко разрываются.
Для циклоалканов характерны следующие виды напряжений: 1 ) торсионное (Пи-гцеровское) напряжение — связано со взаимодействием химических связей в заслоненной или частично заслоненной конформациях; 2) напряжение Ван-дер-Ваальса — обусловлено взаимным отталкиванием заместителей при сближении на расстояние, близкое сумме их вандерваальсовых радиусов; 3) угловое (Байеровское) напряжение — присуще отдельным циклоалканам и связано с отклонением валентных углов между углерод-углеродными связями в цикле от нормального (тетраэдрического) значения.
В обычных условиях преобладающая часть молекул циклогексана (99,9 %) существует в конформации «кресла». В результате вращения вокруг углерод-углеродных связей одна конформация «кресла» переходит в другую, энергетически равноценную, форму кресла. Такой процесс называют инверсией цикла. ве конформации «кресла» могут взаимно превращаться как с промежуточным образованием конформации «ванны», конформации, так и без прохождения через конформацию «ванны».
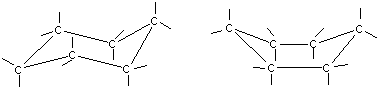
1. конформация кресла
2.ванны
Циклопропан и циклобутан склонны к реакциям присоединения, а для циклопентана и циклогексана более характерны реакции замещения.
Циклопропан и циклобутан способны присоединять бром:
С3H6 + Br2 → BrCH2—CH2—CH2Br
2. Циклопропан, циклобутан и циклопентан могут присоединять водород, давая соответствующие нормальные алканы. Присоединение происходит при нагревании в присутствии никелевого катализатора:
С4H8 + H2 → CH3—CH2—CH2—CH3
Применение:
Применение циклоалканов. Из циклопарафинов практическое значение имеют циклопентан, циклогексан, метил циклогексан, их производные и другие. В процессе ароматизации нефти эти соединения превращаются в ароматические углеводороды - в бензол, толуол и другие вещества, которые широко используются для синтеза красителей, медикаментов и т.д. Циклопропан применяют для наркоза. Циклопентан используется как добавка к моторному топливу для повышения качества последнего и в разных синтезах.
25.Ароматические углеводороды. Пространственное и электронное строение молекулы бензола. Ароматичность. Правило Хюккеля. Критерии ароматичности. Номенклатура и изомерия аренов. Физические свойства ароматических углеводородов.
Арены - это циклические соединения, в молекулах которых содержатся одно или несколько ядер бензола. Эмпирическая формула бензола С6Н6
