

Я.Х. Вант-Гофф (1852-1911)
Впервые идею об эффективных столкновениях
высказал в 1889 году шведский ученый С.А. Аррениус
(1859 – 1927), который продолжил работы Вант-Гоффа по изучению зависимости скорости реакций от температуры. Итогом явилось знаменитое уравнение Аррениуса, которой до сих пор используется в кинетических расчетах:
k = А е – Е*/RT
г
 де
А – предэкспоненциальный множитель,
который еще называют частотным фактором
(связывает частоту столкновений частиц
с вероятностью того, что столкновения
будут благоприятны для реакции), е –
де
А – предэкспоненциальный множитель,
который еще называют частотным фактором
(связывает частоту столкновений частиц
с вероятностью того, что столкновения
будут благоприятны для реакции), е –
основание натурального логарифма, Е* - энергия активации в Дж\моль, R – газовая постоянная, T – температура, при которой идет реакция, в градусах Кельвина.
Энергия активации – это минимальная энергия, которая необходима молекулам, чтобы вступить в химическое взаимодействие. Другими словами, если для осуществления реакции требуется сначала ввести в систему энергию, то эта реакция имеет активационный (=энергетический) барьер. Например, для выпечки хлеба необходимо затратить тепловую энергию; для зажигания спички ее предварительно нагревают посредством трения.
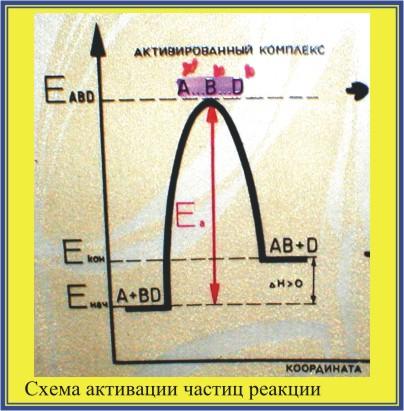
Рассмотрим энергетическую схему для реакции А + BD = AB + D.
(Это график изменения энергии веществ по мере протекания реакции.)
Соударение любых частиц (молекул) A и BD не может привести к образованию AB и D. Это возможно для частиц, накопивших (получивших) дополнительный запас энергии: это энергия активации Ea или Е*. Тогда A и BD, столкнувшись друг с другом перейдут в активированное состояние, что обозначается как A* и BD*. Только столкновение активированных частиц может привести к образованию новых веществ. Сначала образуется активированный комплекс (некое промежуточное соединение с большим запасом энергии, чем исходные вещества). Именно для образования активированного комплекса и необходима энергия активации. В зависимости от того, как распадётся эта весьма неустойчивая конструкция, получим или новые соединения или вернёмся к прежним. Повышение температуры системы как раз и приводит к увеличению числа молекул, обладающих достаточной энергией для преодоления энергетического барьера и образования активированного комплекса. Поэтому то и увеличивается доля эффективных столкновений, т.е. константа скорости.
Величины А и Еа вообще зависят от температуры, но в некотором небольшом интервале температур они могут изменяться незначительно, что позволяет считать их постоянными величинами и рассчитывать аналитическим путем, если известны значения константы скорости при разных температурах.
Из уравнения Аррениуса следует, что возрастание скорости большинства реакций с возрастанием температуры происходит не линейно. Тем не менее, существует эмпирическое правило, называемое правилом Вант-Гоффа, которое гласит, что при повышении температуры на каждые 10 градусов скорость реакции (υ) возрастает в 2 ÷ 4 раза (применимо в областях низких температур [5]):
υ2 = υ 1• γΔt/10, где γ = 2 ÷ 4.
Катализ и катализаторы
К атализатор
(по определению
В. Оствальда 1905г.)
– вещество,
которое изменяет скорость химической
реакции, не изменяя ее суммарного
энергетического баланса, при этом само
не подвергается окончательному
химическому превращению в данном
процессе. Катализ – это процесс.
атализатор
(по определению
В. Оствальда 1905г.)
– вещество,
которое изменяет скорость химической
реакции, не изменяя ее суммарного
энергетического баланса, при этом само
не подвергается окончательному
химическому превращению в данном
процессе. Катализ – это процесс.
Каталитические процессы: глубокая переработка нефти путем крекинга, гидроочистки и риформинга; синтез и окисление аммиака; производство серной кислоты и метанола; гидролиз сложных эфиров; гидрирование олефинов; синтез белков и обмен веществ в биологических системах; гидролиз сложных углеводов.
Изменение скорости происходит за счет изменения энергии активации. В присутствии катализатора реакция проходит через другие промежуточные стадии, чем без него, причем, эти стадии энергетически более доступны. Иначе говоря, в присутствии катализатора возникают другие активированные комплексы, причем для их образования требуется меньше энергии, чем для образования активированных комплексов без катализатора. На рисунке представлены энергетические профили реакции без катализатора (сплошная линия)
и с катализатором (активатором), ускоряющим процесс за счет снижения энергии активации. При этом катализатор не изменяет ни энергии реагентов, ни энергии продуктов реакции.
ПРИМЕР: разложение йодоводорода HI в присутствии платины сопровождается уменьшением Еа на 120 кДж\моль! Расчетом доказано, что при комнатной температуре снижение Еа примерно на 60 кДж\моль увеличивает скорость реакции в 1011 раз!
По фазности катализ бывает гомофазный (ещё называют гомогенный) – реагенты и катализатор находятся в одном агрегатном состоянии, гетерофазный (гетерогенный) – реагенты и катализатор находятся в разных агрегантых состояниях. Разложение перекиси водорода с помощью бромной воды – пример гомофазного катализа (нет границы раздела – система однородна). А окисление SO2 до SO3 на V2O5 – пример гетерогенного катализа: SO2(газ) + О2(газ) → (V2O5(твердое) ) → SO3 (жидк). Гетерогенным катализом также является разложение перекиси водорода на твердом оксиде марганца MnO:
2H2O2 kat→2H2O + O2.
В случае отрицательного катализа, т.е. ингибирования, энергия активации с катализатором будет ещё больше, чем без. Например, ингибирование коррозии фосфатированием днища автомобиля с целью получения нерастворимых фосфатов на поверхности, которые предотвратят доступ влаги к металлу.
