
- •Лекции по курсу биохимия и молекулярная биология для студентов направления биология
- •Оглавление
- •Введение
- •Модуль 1. Статическая биохимия
- •Лекция 1
- •Строение, свойства, биологическая роль
- •Моно – и олигосахаридов
- •Классификация углеводов
- •Моносахариды
- •Стереоизомерия моносахаридов
- •Представители моносахаридов
- •Олигосахариды
- •Отдельные представители дисахаридов
- •Лекция 2 строение, свойства, биологическая роль
- •Отдельные представители полисахаридов
- •Лекция 3 строение, свойства, биологическая роль простых липидов
- •Классификация
- •Стероиды
- •Желчные кислоты
- •Лекция 4 строение, свойства, биологическая роль сложных липидов
- •Лекция 5 аминокислотный состав белков Белки и их функции
- •Функции белков
- •Элементарный состав белков
- •Методы выделения и очистки белков
- •Аминокислотный состав белков
- •Химические свойства аминокислот
- •Классификация аминокислот, заменимые и незаменимые аминокислоты
- •Лекция 6 уровни структурной организации белков Структурная организация белков
- •Первичная структура белка: методы исследования. Структурные особенности пептидной связи
- •Номенклатура пептидов и полипептидов. Природные пептиды: глутатион, карнозин, ансерин, грамицидин s, окситоцин, энкефалины
- •Отдельные представители пептидов
- •Вторичная структура белков: -спираль, ее основные характеристики, -структура, -изгиб. Роль водородных связей в формировании вторичной структуры. Сверхвторичные (надвторичные) структуры белка
- •Третичная структура белков. Типы нековалентных связей, стабилизирующих третичную структуру. Роль s-s-мостиков в формировании третичной структуры некоторых белков
- •Заимодействия между субъединицами, стабилизирующие четвертичную структуру. Функциональное значение четвертичной структуры белков
- •Лекция 7
- •Физико-химические свойства белков
- •Ионизация, гидратация, растворимость,
- •Осмотические и онкотические свойства, оптические свойства
- •Молекулярная масса и размеры белков. Методы определения молекулярной массы белков. Необходимость применения комплекса методов для точной оценки молекулярной массы белков
- •Денатурация белков
- •Лекция 8 классификация белков. Простые и сложные белки Принципы классификации белков
- •Фибриллярные белки
- •Глобулярные белки
- •Сложные белки
- •Липопротеины
- •Гликопротеины
- •Протеогликаны
- •Фосфопротеины
- •Металлопротеины
- •Нуклеопротеины
- •Хромопротеины
- •Гемоглобин
- •Миоглобин
- •Цитохромы электронтранспортной цепи
- •Хлорофиллы
- •Флавопротеины
- •Лекция 9 сложные белки Гликопротеины
- •Фосфопротеины
- •Липопротеины
- •Металлопротеины
- •Лекция 10 строение, свойства, биологическая роль нуклеотидов
- •Циклические нуклеотиды
- •Лекция 11 строение, свойства, биологическая роль нуклеиновых кислот
- •Рибосомальные рнк
- •Лекция 12 витамины – биологическая роль, классификация. Водорастворимые витамины
- •Витамин в1 (тиамин)
- •Витамин в2 (рибофлавин)
- •Витамин в3 (рр, никотиновая кислота, никотинамид)
- •Витамин в5 (пантотеновая кислота)
- •Витамин в6 (пиридоксин, пиридоксаль, пиридоксамин)
- •Витамин в9 (фолиевая кислота)
- •Витамин в12 (кобалами)
- •Витамин н (биотин)
- •Витамин с (аскорбиновая кислота)
- •Витамин р (рутин)
- •Лекция 13 жирорастворимые витамины Витамин а (ретинол)
- •Витамин d (кальциферол)
- •Витамин е (токоферол)
- •Витамин к (нафтохинон)
- •Лекция 14
- •Ферменты – строение: свойства, механизм действия
- •Понятие о ферментах.
- •Сущность явлений ферментативного катализа
- •Структурная организация ферментов
- •3. Роль металлов в регуляции aктивности ферментов
- •Изоферменты: биологическая роль
- •Механизм действия ферментов
- •Специфичность действия ферментов
- •Стационарная кинетика ферментативных реакций
- •Концентрация субстрата
- •Концентрация фермента
- •Температура
- •Уравнение Михаэлиса-Ментен
- •Единицы ферментов
- •Лекция 15
- •Ингибиторы ферментов
- •Регуляция каталитичекой активности ферментов
- •Изостерическая регуляция
- •Аллостерический контроль активности ферментов
- •Регуляция ферментов ковалентной модификацией
- •Регуляция ферментов ограниченным протеолизом (активация зимогенов)
- •Регуляция активности мультиэнзимных комплексов
- •Классификация и номенклатура ферментов
- •Характеристика отдельных классов ферментов
- •Ферменты в клинической диагностике. Энзимопатии
- •Модуль II. Динамическая биохимия
- •Катаболические, анаболические, амфиболические пути
- •Метаболизм углеводов
- •Расщепление углеводов в пищеварительном тракте
- •Переваривание углеводов в ротовой полости
- •Переваривание углеводов в кишечнике
- •Амилолитические ферменты: характеристика Панкреатическая -амилаза
- •Сахаразо-изомальтазный комплекс
- •Гликоамилазный комплекс
- •Трегалаза
- •Всасывание моносахаридов в тонком кишечнике и их дальнейший транспорт. Глюкозные транспортеры
- •Всасывание моносахаридов в кишечнике
- •Транспорт глюкозы из крови в клетки
- •Лекция 17
- •Анаэробный катаболизм углеводов
- •Анаэробное окисление глюкозы. Гликолиз. Внутриклеточная
- •Локализация процесса
- •Отдельные реакции гликолиза, их термодинамические характеристики. Образование 2,3-дифосфоглицерата в шунте Рапопорта-Люберинга
- •Расщепление гликогена (гликогенолиз). Строение, механизм действия и регуляция гликогенфосфорилазы
- •Спиртовое и молочнокислое брожение
- •Лекция 18
- •Аэробный катаболизм углеводов (часть 1)
- •Аэробный метаболизм пирувата. Митохондрии: структура
- •И энергетические функции
- •Окислительное декарбоксилирование пирувата. Строение
- •Цикл лимонной кислоты. Отдельные реакции цикла, их термодинамическая характеристики. Суммарное уравнение окисления ацетил-CоА в цикле Кребса
- •Лекция 19
- •Аэробный катаболизм углеводов (часть 2)
- •Регуляция цикла Кребса на уровне цитратсинтазы,
- •Изоцитратдегидрогеназы и -кетоглутаратдегидрогеназного комплекса
- •Амфиболическое значение цикла Кребса. Необходимость анаплеротических путей, пополняющих запас компонентов, участвующих в цикле
- •Зависимое от атp и биотина карбоксилирование пирувата: анаплеротический путь синтеза оксалоацетата
- •Пентозофосфатный путь (гексозомонофосфатный шунт)
- •Отдельные реакции пфп, их термодинамические характеристики.
- •Суммарное уравнение пентозофосфатного пути.
- •Регуляция пентозофосфатного пути на уровне
- •Глюкозо-6-фосфатдегидрогеназы
- •Участки перекреста пфп с гликолизом
- •Циклический характер пфп
- •Лекция 20 биосинтез углеводов
- •Глюконеогенез
- •В последующей реакции, катализируемой ферментом фосфоенолпируваткарбоксикиназой, из оксалоацетата образуется фосфоенолпируват. Реакция Mg2-зависимая и донором фосфата служит gtp.
- •Лекция 21 расщепление пищевых и тканевых липидов
- •Катаболизм липидов
- •Всасывание продуктов расщепления липидов
- •Транспорт липидов
- •Метаболизм глицерола
- •Лекция 22 катаболизм жирных кислот
- •Активация жирной кислоты
- •Транспорт ацил-СоА в митохондрии
- •Катаболизм ненасыщенных жирных кислот
- •Катаболизм жирных кислот с нечетным числом атомов углерода
- •Образование кетоновых тел (кетогенез)
- •Кетоновые тела как источники энергии
- •Глиоксилатный цикл
- •Лекция 23 биосинтез жирных кислот и триацилглицеролов
- •Строение синтазы жирных кислот
- •Механизм синтеза жирных кислот
- •Транспорт ацетил-СоА из митохондрий в цитозоль
- •Образование малонил-СоА
- •Наращивание (элонгация) углеродной цепи жирной кислоты
- •Синтез других предельных и непредельных жк
- •Биосинтез триацилглицеролов
- •Лекция 24 биосинтез холестерола и желчных кислот
- •Биосинтез холестерола
- •Регуляция биосинтеза хс
- •Биосинтез желчных кислот
- •Лекция 25
- •Биологическое окисление. Ферменты, участвующие в биологическом окислении
- •Свободное окисление и его биологическая роль. Цитохром р-450
- •Микросомальная система окисления
- •Механизм гидроксилирования
- •Лекция 26
- •Цепь переноса электронов и протонов внутренней мембраны
- •Митохондрий (дыхательная цепь, редокс-цепь). Компоненты
- •Дыхательной цепи: флавопротеины, железосерные белки, коэнзим q, цитохромы в, с1, с, аа3. Топография дыхательных переносчиков
- •В редокс-цепи
- •Убихинон окисленный CoQ
- •Энергетическое значение ступенчатого транспорта электронов от окисляемых субстратов к молекулярному кислороду. Окислительное фосфорилирование в дыхательной цепи
- •Организация компонентов дыхательной цепи в виде четырех
- •Локализация пунктов сопряжения окисления и фосфорилирования в дыхательной цепи на основании редокс-потенциалов, действия специфических ингибиторов (ротенон, амитал, антимицин а, цианид, со, NaN3)
- •Полные и редуцированные дыхательные цепи
- •Лекция 27
- •Строение атp-синтазного комплекса. Механизм образования атp. Обратимость реакции, катализируемой атp-синтазой. Разобщение транспорта электронов и синтеза атp; действие 2,4-динитрофенола
- •Механизм образования атp
- •Окисление цитоплазматического nadh в дыхательной цепи. Глицеролфосфатный и малат-аспартатный челночные механизм
- •Лекция 28 интеграция клеточного метаболизма
- •Основные аспекты регуляции метаболизма
- •Регуляция на уровне транскрипции
- •Аллостерическая регуляция активности ферментов
- •Ковалентная модификация ферментов
- •Гормональная регуляция
- •Посттранскрипционная и посттрансляционная модификация макромолекул
- •Изменение концентрации метаболитов
- •Мембранная регуляция
- •Модуль III. Молекулярная биология лекция 29 репликация днк
- •Точность репликации
- •Репликация днк у эукариот
- •Репаративный синтез днк
- •Лекция 30 транскрипция (биосинтез рнк)
- •Транскрипция у прокариот
- •Инициация транскрипции
- •Элонгация транскрипции
- •Терминация транскрипции
- •Транскрипция у эукариот
- •Механизм индукции на примере Lac-оперона
- •Катаболитная репрессия
- •Лекция 31 тРансляция (биосинтез белка)
- •Роль тРнк в трансляции
- •Аминоацил-тРнк-синтетазы
- •Белоксинтезирующая система клетки
- •Эффективность трансляции
- •Точность белкового синтеза
- •Энергетические затраты на трансляцию
- •Посттрансляционные модификации полипептидной цепи
- •Библиографический список Основная литература
- •Дополнительная литература
Лекция 27
МЕХАНИЗМЫ ОБРАЗОВАНИЯ И ИСПОЛЬЗОВАНИЯ
АТР В ЖИВЫХ СИСТЕМАХ
Представления о механизмах сопряжения окисления и
фосфорилирования в дыхательной цепи. Хемиосмотическая теория
Митчелла. Электрохимический протонный градиент как форма
запасания энергии
Долгое время вопрос о механизме преобразования энергии, освобождающейся при переносе высокоэнергетических электронов по цепи окислительных ферментов, оставался неясным. Согласно хемиосмотической теории П. Митчелла (рис. 27.1), сопряжение тканевого дыхания с окислительным фосфорилированием обеспечивается внутренней митохондриальной мембраной, целостность которой обуславливает возникновение движущей силы синтеза АТР-протонного потенциала. В результате происходит перекачивание протонов из матрикса на цитоплазматическую поверхность и создается градиент рН. Движение протонов в обратном направлении (по каналу фактора Fo) ведет к активации АТР-синтазы (фактор F1) и синтезу АТР из АDP и фосфата. Транспорт АТР из матрикса в цитоплазму осуществляется переносчиком – транслоказой. Этот фермент катализирует перенос одной молекулы АТР из матрикса в обмен на одну молекулу АDP, переносимую в матрикс. Нарушение транспорта АDP или фосфата приводит к торможению синтеза АТP.

Рис.27.1. Английский биохимик Питер Деннис Митчелл (родился в Митчеме, в семье служащего Кристофера Гиббса Митчелла и Беатрис Дороти Митчелл, окончил Королевский колледж в Тонтоне и колледж Иисуса Кембриджского университета, в 1978 г. за разработку хемиосмотической теории удостоен Нобелевской премии)
Гипотеза П.Митчелла требует соблюдения ряда условий:
1) внутренняя митохондриальная мембрана должна быть интактна и непроницаема для протонов, направляющихся снаружи внутрь;
2) в результате активности дыхательной цепи ионы водорода поступают в нее изнутри, из матрикса, а освобождаются на наружной стороне мембраны;
3) движение ионов водорода, направленное изнутри наружу должно приводить к их накоплению, вследствие чего между двумя сторонами митохондриальной мембраны возникает градиент рН;
4) необходимы затраты энергии, которая поставляется при переносе электронов по электронтранспортной цепи;
5) синтез АТР поддерживать наличием электрохимического градиента.
Строение атp-синтазного комплекса. Механизм образования атp. Обратимость реакции, катализируемой атp-синтазой. Разобщение транспорта электронов и синтеза атp; действие 2,4-динитрофенола
В настоящее время протонные АТР-синтазы выделены практически из всех типов сопрягающих мембран: митохондрий, хлоропластов, хроматофоров. АТР-синтазный комплекс (Н+-АТРаза) – обратимый фермент, обладающий как АТР-синтазной, так и АТРазной активностью. Синтез АТР осуществляется за счет протонного градиента ΔμН+, а гидролиз АТР приводит к тому, что протонная АТРаза сопряженно генерирует трансмембранную разность электрохимического потенциала Н+. В Н+-АТРазе происходят процессы по общей схеме:
АТР-синтаза
ΔμН+ ↔ АТР
АТРаза
АТР-синтазный комплекс (F0F1-АТРаза) состоит из растворимой АТР-синтазы (фактор F1) и мембранных компонентов (комплекс F0) (Рис.27.2).
Сопрягающий фактор АТР-синтазы (F1 для митохондрий и CF1 для хлоропластов) представляет собой полифункциональный белок, имеющий сложную четвертичную структуру. Он построен из трех типов крупных субъединиц – α, β, γ с молекулярной массой 30000-60000 Да и двух типов минорных субъединиц δ, ε с молекулярной массой 11000-20000 Да. Стехиометрия комплекса – 3α3βγδε. Разложение его на субъединицы ведет к потере ферментативной активности. «Шляпка» высотой 80Å и шириной 100Å грибовидного выроста АТР-синтазы соответствует фактору F1, частично погруженному в мембрану, в основании которого находится гидрофобный белок комплекса F0, который включает 3 типа полипептидов (a,b,c) с молекулярными массами от 6500 до 30000 кДа и обеспечивает связывание фактора F1 с мембраной и перенос протонов при работе фермента.

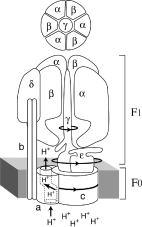
Рис.27.2. Общая топография АТР-синтазного комплекса
F1 – сопрягающий фактор, Fo – протонный канал (пояснения в тексте)
Комплекс F1 может поворачиваться вокруг оси, совпадающей по направлению с субъединицей γ. При повороте на 120º каждая из α и β-субъединиц перемещается на место другой такой же, а при повороте на 60º субъединицы меняются местами. В силу некоторой асимметричности вращение F1-комплекса переводит его β-субъединицы при каждом повороте в новое положение, где они попадают в другое микроокружение. Это и приводит к изменению состояния и конформационной перестройке активных центров при вращении F1. Каждый из трех активных центров в результате вращения F1-комплекса может поочередно находиться в одном из трех конформационных состояний, которые различаются по степени сродства молекул АТР, АDP и Pi к каталитическому центру. В состоянии 1 центр β-субъединицы открыт и в нем связываются молекулы АDP и Pн, которые сравнительно слабо удерживаются центром.
Вращение и конформационные перестройки комплекса F1 переводят этот центр в состояние 2, где непосредственно происходит синтез АТP. Здесь АDP и Pн прочно фиксируются в каталитическом центре, находясь в активной конфигурации, необходимой для образования ковалентной связи между фосфатными группами АDP и Pн. Поэтому на этой стадии не требуется притока энергии извне. В состоянии 2 в каталитическом центре самопроизвольно идет образование и разрыв ковалентной связи АDP-P, поскольку константа равновесия АТP↔АDP+Pi близка к единице.
На следующем этапе центр переходит в состояние 3, где за счет энергозависимой структурной перестройки происходит ослабление прочной связи молекулы АТP с центром и выход ее наружу. На освободившееся место из раствора приходят новые молекулы АDP и Pн. Перестройки носят кооперативный характер и затрагивают состояние всех трех каталитических центров β-субъединиц. Поскольку весь цикл включает 3 этапа, а в Н+-АТР-синтазе имеется 3 субъединицы, то после каждого структурного перехода в растворе появляется новая молекула АТР.
F0 формирует канал, по которому протоны поступают к активному центру АТРазы. Проводимость протонов носит специфический характер и подавляется антибиотиком олигомицином и ДЦКД (N,N′-дициклогексилкарбодиимид), ингибиторами Н+-АТР-синтазы. Особым образом организованный канал обеспечивает прохождение протона через всю мембрану из водной фазы в гидрофобную область мембраны, а затем из нее в воду по другую сторону от липопротеинового барьера. Основную роль в переносе играет ДЦКД-связывающий протеолипид. Предполагают, что он располагается поперек мембраны, так что полярная часть оказывается на внешней поверхности мембраны и служит входом в канал. Наиболее вероятным механизмом переноса протона представляется эстафетная передача по протон-донорным и протон-акцепторным группам аминокислот, включая остатки аргинина, тирозина, глутамина.
Комплекс F0 ‒ вращающийся ансамбль субъединиц с 9-12 остановками, позволяющими прерывать поток протонов. Временное связывание протонов может осуществляться остатком аспарагиновой кислоты на каждой субъединице. Каждый поворот γ-субъединицы внутри комплекса происходит в соответствии с тем, заполнено ли гидролитическое место АТР или АDP и Pн. Эти конформационные изменения (механические изменения структуры) обеспечивает перенос протонов водорода на каждый третий этап цикла. Связывание, гидролиз и освобождение АТP и ADP в F0-F1-АТP-синтазе зависит от величин и геометрии расположения заряда в активном состоянии. Пока еще не ясна природа и расположение заряженных групп, ответственных за непосредственное вращение молекулярного мотора Н-АТP-синтазы.
