
- •I. Основные понятия и принципы статистической физики. Основные понятия.
- •Основные знания.
- •Основные умения.
- •1.1. Микросостояние и макросостояние системы.
- •1.2. Понятие статистического ансамбля.
- •1.3. Свойства функции распределения.
- •1.4. Уравнение Лиувилля, теорема Лиувилля.
- •1.7. Пример.
- •1.8. Учёт квантовых свойств.
- •1.9. Распределения Гиббса.
- •1.10. Примеры решения задач.
- •1.11. Вопросы для самопроверки.
- •1.12. Задачи.
- •II. Статистическая термодинамика.
- •2.1. Постулаты феноменологической термодинамики.
- •2.2. Внутренняя энергия макроскопической системы.
- •2.3. Статистическое обоснование первого начала термодинамики.
- •2.4. Второе начало термодинамики и «стрела времени».
- •2.5. Третий закон термодинамики.
- •2.6. Термодинамические потенциалы.
- •2.7. Принцип экстремума в равновесной термодинамике.
- •2.8. Определение термодинамических величин статистическим методом.
- •2.9. Вопросы для самопроверки.
- •2.10. Задачи.
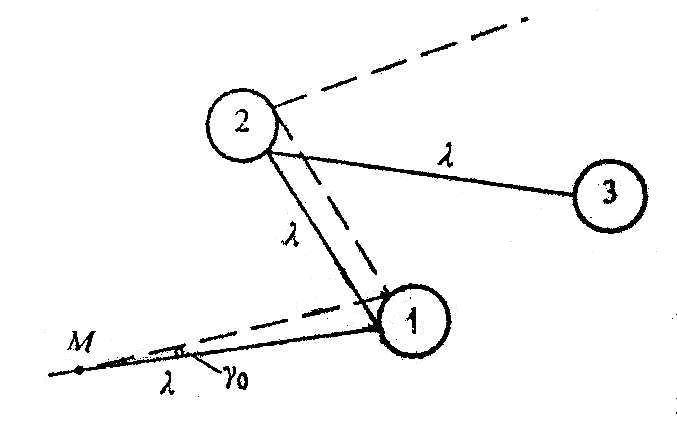
1.7. Пример.
Рассмотрим природу
возникновения молекулярного хаоса.
Пусть молекула А
сталкивается с другими молекулами газа.
На рис.2 диски соответствуют поперечному
сечению соударений этой молекулы с
молекулами 1,2,3. Радиус каждого диска
приближённо равен r,
средняя длина свободного пробега –
![]() .
В какой-то момент времени, который будем
считать начальным, скорость молекулыА
немного изменяется. На рис.2 сплошной
линией изображена невозмущённая
траектория молекулы, пунктирной –
возмущённая. Она отклонена от невозмущённой
на малый угол
.
В какой-то момент времени, который будем
считать начальным, скорость молекулыА
немного изменяется. На рис.2 сплошной
линией изображена невозмущённая
траектория молекулы, пунктирной –
возмущённая. Она отклонена от невозмущённой
на малый угол
![]() .
Легко показать, что после одного
соударения, которое считается упругим,
угол
.
Легко показать, что после одного
соударения, которое считается упругим,
угол![]() возрастает в
возрастает в![]() раз. Следовательно послеn
соударений будем иметь
раз. Следовательно послеn
соударений будем иметь
![]() . (1.7.1)
. (1.7.1)
Д
![]() .
.
С
Рис.2![]() ,
гдеv
– средняя её скорость и t
– время движения. Тогда
,
гдеv
– средняя её скорость и t
– время движения. Тогда
![]() , (1.7.2)
, (1.7.2)
где
![]() .
(
.
(![]() ,
,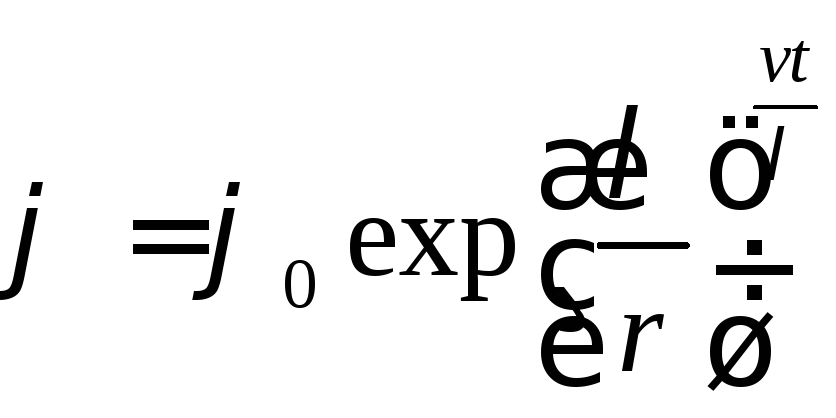 ,
,![]() ,
,![]() ).
Из соотношения (1.7.2) видно, что первоначально
как угодно близкие траектории
экспоненциально разбегаются, величинаk
характеризует
среднюю скорость их разбегания.
).
Из соотношения (1.7.2) видно, что первоначально
как угодно близкие траектории
экспоненциально разбегаются, величинаk
характеризует
среднюю скорость их разбегания.
Таким образом, траектории молекул газа, которые очень чувствительны к начальным условиям, являются неустойчивыми. Они также чувствительны к возмущениям, вносимым внешним окружением. Можно говорить лишь о вероятности нахождения молекулы в том или ином месте занятого газом объёма. Равновесное макросостояние представляет собой совокупность микросостояний, каждое из которых неустойчиво и через короткое время заменяется другими микросостояниями.
1.8. Учёт квантовых свойств.
Квантовые свойства частиц сначала будем учитывать в квазиклассическом приближении. Это означает:
а) эволюцию микросостояний систем будем описывать фазовыми траекториями. Однако в квазиклассическом приближении считаются возможными только те траектории, которые соответствуют дискретным (квантованным) состояниям.
б) микросостоянию
системы соответствует не фазовая точка,
а, учитывая соотношение неопределённостей
![]() ,
ячейка размером
,
ячейка размером![]() ,
гдеf
– число
степеней свободы, N
– число
частиц.
,
гдеf
– число
степеней свободы, N
– число
частиц.
Число квантовых
состояний системы в интервале энергий
от Е
до
![]() (кратность вырождения):
(кратность вырождения):
![]() . (1.8.1)
. (1.8.1)
Здесь Г – фазовый объём, соответствующий состояниям с энергией меньшей или равной Е.
1.9. Распределения Гиббса.
Конкретный вид функции распределения микросостояний системы зависит от условий, в которых она (система) находится.
а) Микроканоническое распределение Гиббса.
Система изолирована,
её энергия Е0
фиксирована. Соответствующий ансамбль
называется микроканоническим. Поэтому
для системы возможны только такие
фазовые траектории, на которых её энергия
равна Е0.
Вероятность состояний с другими
значениями энергий равна нулю. Поскольку
в соответствии с теоремой Лиувилля,
вдоль фазовых траекторий
![]() постоянна, то вероятность всех состояний,
при которых энергия системы равнаЕ0,
одинакова:
постоянна, то вероятность всех состояний,
при которых энергия системы равнаЕ0,
одинакова:
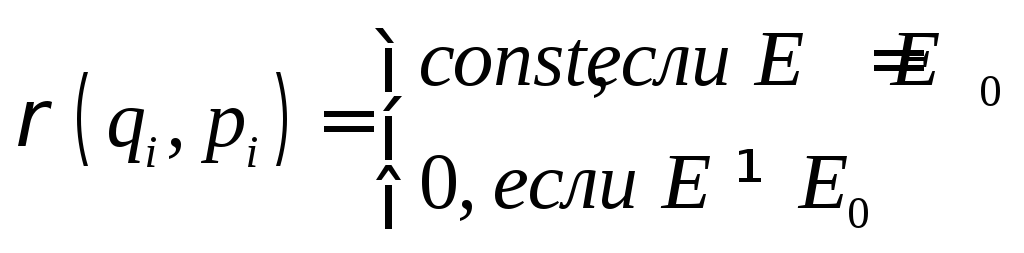 . (1.9.1)
. (1.9.1)
Функция распределения
должна удовлетворять условию нормировки.
Поэтому
![]() ,
где
,
где![]() – дельта-функция Дирака (О
– дельта-функция Дирака (О![]() -функции
см. пособие «Операторы квантовой
механики»).
-функции
см. пособие «Операторы квантовой
механики»).
Система со строго
фиксированной энергией – слишком
абстрактная модель. В природе не
существует совершенно изолированных
систем. Взаимодействие с внешней средой,
хотя и очень слабое, всегда есть. В
квантовой механике энергия точно
определена (![]() ),
если время жизни данного состояния
системы бесконечно (
),
если время жизни данного состояния
системы бесконечно (![]() ).
Поэтому обычно значение энергии системы
указывают в узком интервале (
).
Поэтому обычно значение энергии системы
указывают в узком интервале (![]() ).
).
Макросостоянию системы соответствует большое число микросостояний (допустимых квантовых состояний). Поскольку все микросостояния для изолированной системы равновероятны, вероятность того, что изолированная система находится в определённом макросостоянии, пропорциональна числу совместимых с ним микросостояний (по формуле сложения вероятностей). Поэтому микроканоническое распределение Гиббса можно записать так:
![]() . (1.9.2)
. (1.9.2)
б) Каноническое распределение Гиббса.
Подсистема находится в термодинамическом равновесии с термостатом. Термостатом называется система, температура которой при взаимодействии с подсистемой остаётся постоянной. Соответствующий ансамбль называется каноническим. Каноническое распределение Гиббса можно получить, если рассматривать подсистему с термостатом как одну изолированную систему и применить к ней микроканоническое распределение. При этом должны выполнятся условия:
1)
![]() (Е
– энергия
изолированной системы);
(Е
– энергия
изолированной системы);
2)
![]() (
(![]() – энергия взаимодействия подсистемы
и термостата);
– энергия взаимодействия подсистемы
и термостата);
3) обмен частицами между подсистемой и термостатом отсутствует, число частиц в подсистеме постоянно.
Каноническое распределение Гиббса в квазиклассическом приближении можно записать в виде:
![]() (1.9.3).
(1.9.3).
Здесь
![]() – вероятность того, что подсистема,
составляющая малую часть изолированной
системы, находится в одном из состояний
– вероятность того, что подсистема,
составляющая малую часть изолированной
системы, находится в одном из состояний![]() с энергией
с энергией![]() ;
параметр
;
параметр
![]() (1.9.4)
(1.9.4)
называют модулем канонического распределения. Величина
![]() (1.9.5)
(1.9.5)
есть энтропия.
Здесь энтропия определена для равновесного
состояния. Связь статистической энтропии
![]() и термодинамическойS:
и термодинамическойS:
![]() . (1.9.6)
. (1.9.6)
Постоянная k
называется постоянной Больцмана
(![]() Дж/К).
Если число микросостояний
Дж/К).
Если число микросостояний![]() интерпретировать как меру неточности
знаний о системе или как меру хаотичности,
то энтропию также можно считать мерой
хаотичности.
интерпретировать как меру неточности
знаний о системе или как меру хаотичности,
то энтропию также можно считать мерой
хаотичности.
Свойства модуля канонического распределения:
1)
![]() является положительной величиной;
является положительной величиной;
2) эта величина может относиться только к макросистемам;
3) равенство модулей подсистем является условием их теплового равновесия.
Поэтому величину
![]() называют статистической температурой:
называют статистической температурой:
![]() . (1.9.7)
. (1.9.7)
Из условия нормировки
![]() следует:
следует:
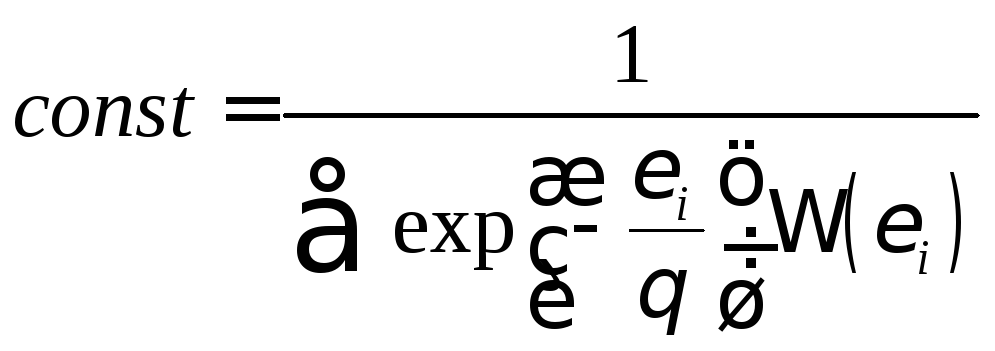 . (1.9.8)
. (1.9.8)
Выражение
![]() (1.9.9)
(1.9.9)
называется статистической суммой или суммой по состояниям. Подставляя значение постоянной в выражение (1.9.3) получаем
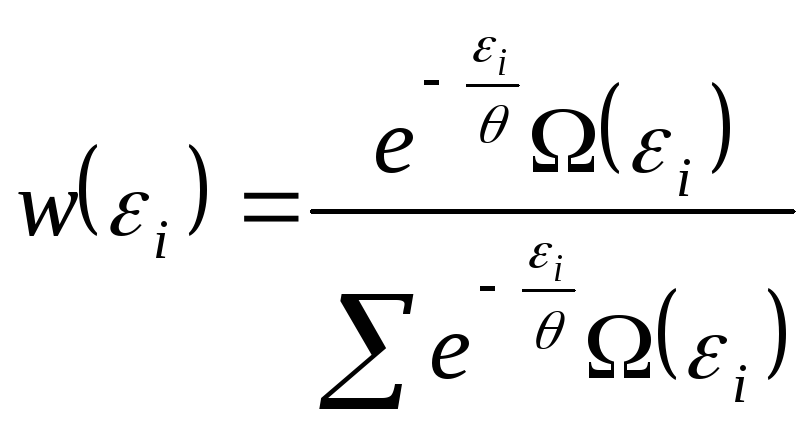 . (1.9.10)
. (1.9.10)
Из формул (1.9.3) и
(1.9.10) следует, что в каноническом ансамбле
энергия подсистемы, состоящей из большого
числа частиц, определяется достаточно
точно: распределение имеет резкий
максимум при некотором значении энергии
![]() (наиболее вероятном значении энергии).
В распределении есть экспоненциально
убывающий множитель
(наиболее вероятном значении энергии).
В распределении есть экспоненциально
убывающий множитель![]() ,
однако число состояний
,
однако число состояний
![]() для систем с большим числом частиц
быстро растёт с энергией подсистемы.
Например, если подсистемой является
газ, состоящий изN
одинаковых молекул, заключённых в
сосуде, то
для систем с большим числом частиц
быстро растёт с энергией подсистемы.
Например, если подсистемой является
газ, состоящий изN
одинаковых молекул, заключённых в
сосуде, то
![]() .
Произведение двух функций, зависящих
от энергий: быстро убывающей и быстро
возрастающей, приводит к возникновению
у распределения Гиббса резкого максимума
(рис.3).
.
Произведение двух функций, зависящих
от энергий: быстро убывающей и быстро
возрастающей, приводит к возникновению
у распределения Гиббса резкого максимума
(рис.3).
Подавляющую часть
времени подсистема будет проводить в
состояниях с энергией близкой к
![]() .
.
Для макроскопической подсистемы
![]() . (1.9.11)
. (1.9.11)
Наиболее вероятное
состояние вносит основную долю в среднее
значение величин, характеризующих
подсистему. Например, для энергии имеем:
![]() .
(Принимаем
.
(Принимаем![]() .
Соотношение (1.9.6) теперь можно переписать
точнее:
.
Соотношение (1.9.6) теперь можно переписать
точнее:
![]() . (1.9.12)
. (1.9.12)
То есть энтропия макроскопической системы равна логарифму числа состояний системы, находящейся в состоянии равновесия.
Выразим также статистическую сумму через среднюю энергию подсистемы:
![]() . (1.9.13)
. (1.9.13)
Каноническое распределение Гиббса в классическом приближении:
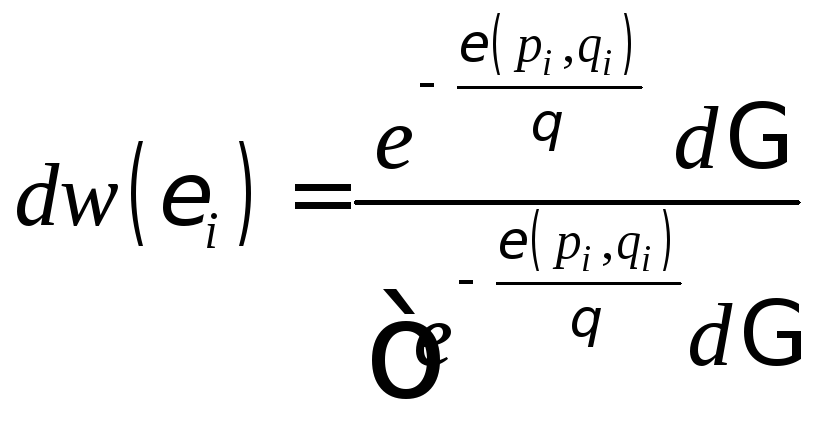 , (1.9.14)
, (1.9.14)
где
![]() – вероятность того, что микросостояние
системы изображается одной из точек,
находящихся в элементе фазового объёма
– вероятность того, что микросостояние
системы изображается одной из точек,
находящихся в элементе фазового объёма![]() ,
соответствующего интервалу энергий
подсистемы от
,
соответствующего интервалу энергий
подсистемы от![]() до
до![]() .
Соответствующая функция распределения:
.
Соответствующая функция распределения:
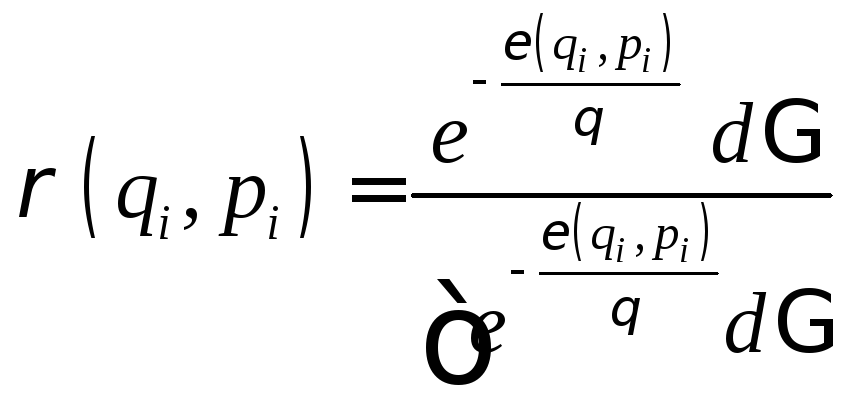 , (1.9.15)
, (1.9.15)
где
![]() – статистический интеграл.
– статистический интеграл.
в) Большое каноническое распределение Гиббса.
Подсистема
обменивается с окружением (термостатом)
не только энергией, но и частицами.
Энергия подсистемы –
![]() ,
число частиц подсистемы –
,
число частиц подсистемы –![]() .Е
и N
– энергия и число частиц изолированной
системы, состоящей из подсистемы и
термостата. Распределение вероятностей
называют большим каноническим
распределением:
.Е
и N
– энергия и число частиц изолированной
системы, состоящей из подсистемы и
термостата. Распределение вероятностей
называют большим каноническим
распределением:
![]() (1.9.16).
(1.9.16).
Из условия нормировки следует
 . (1.9.17)
. (1.9.17)
Физический смысл
величины
![]() :
она определяет вероятность того, что
подсистема находится в одном из состояний
:
она определяет вероятность того, что
подсистема находится в одном из состояний![]() с энергией
с энергией![]() и числом частицn.
Буквой
и числом частицn.
Буквой
![]() по-прежнему
обозначена статистическая температура.
Величина
по-прежнему
обозначена статистическая температура.
Величина
![]() (1.9.18)
(1.9.18)
(производная берётся при постоянном значении энергии) называется химическим потенциалом. Как и температура, химический потенциал может относится только к макроскопическим системам. Равенство химических потенциалов является условием равновесия макросистем, которые могут обмениваться между собой частицами. Физический смысл химического потенциала: он определяет изменение энергии системы при изменении числа частиц на единицу (при фиксированных энтропии и объёме).
