
- •I. Основные понятия и принципы статистической физики. Основные понятия.
- •Основные знания.
- •Основные умения.
- •1.1. Микросостояние и макросостояние системы.
- •1.2. Понятие статистического ансамбля.
- •1.3. Свойства функции распределения.
- •1.4. Уравнение Лиувилля, теорема Лиувилля.
- •1.7. Пример.
- •1.8. Учёт квантовых свойств.
- •1.9. Распределения Гиббса.
- •1.10. Примеры решения задач.
- •1.11. Вопросы для самопроверки.
- •1.12. Задачи.
- •II. Статистическая термодинамика.
- •2.1. Постулаты феноменологической термодинамики.
- •2.2. Внутренняя энергия макроскопической системы.
- •2.3. Статистическое обоснование первого начала термодинамики.
- •2.4. Второе начало термодинамики и «стрела времени».
- •2.5. Третий закон термодинамики.
- •2.6. Термодинамические потенциалы.
- •2.7. Принцип экстремума в равновесной термодинамике.
- •2.8. Определение термодинамических величин статистическим методом.
- •2.9. Вопросы для самопроверки.
- •2.10. Задачи.
2.2. Внутренняя энергия макроскопической системы.
Основой статистической
термодинамики является следующее
утверждение: внутренняя энергия
макроскопического тела тождественна
её средней энергии
![]() ,
вычисленной по законам статистической
физики:
,
вычисленной по законам статистической
физики:
![]() (2.2.1)
(2.2.1)
Подставляя каноническое распределение Гиббса, получаем:
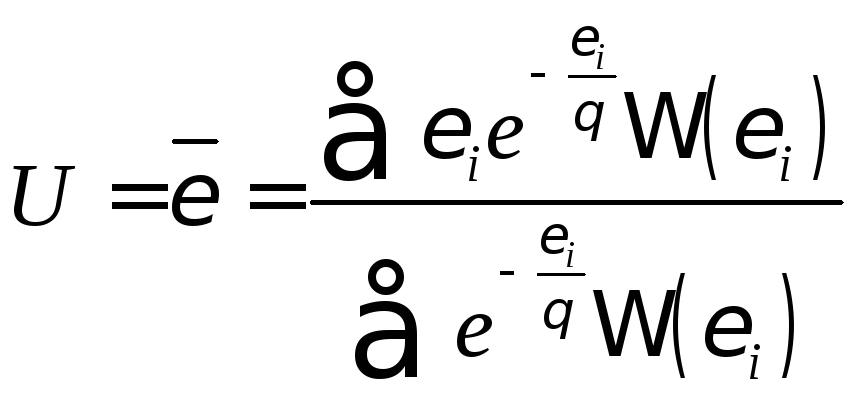 (2.2.2)
(2.2.2)
Числитель правой
части равенства (2.2.2) представляет собой
производную от Z
по
![]() :
:
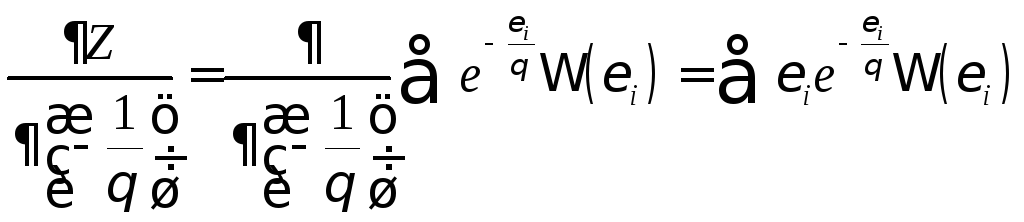 .
.
Поэтому выражение (2.2.2) можно переписать в более компактном виде:
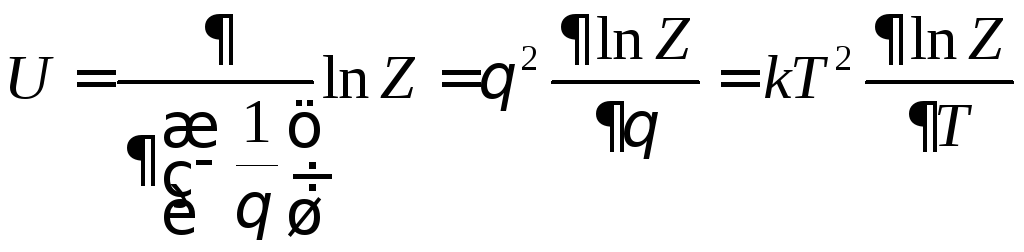 (2.2.3)
(2.2.3)
Таким образом, для нахождения внутренней энергии системы достаточно знать её статистическую сумму Z.
2.3. Статистическое обоснование первого начала термодинамики.
До сих пор мы говорили о состоянии системы (на микро- или макроуровнях) в какой-то определённый момент времени. Перейдём к рассмотрению процессов.
Термодинамические параметры, можно разделить на внешние и внутренние. Внешние параметры характеризуют внешние условия, в которых находится система. Изменение этих параметров будем считать настолько медленными, что в каждый момент времени состояние системы можно рассматривать как равновесное. Такие процессы называются квазистатическими. Они обратимы. Если внешние параметры или температура термостата проходят через те же значения в обратном порядке, то и система проходит через те же равновесные состояния в обратном порядке.
Из выражения (2.2.1) следует, что изменение внутренней энергии макроскопической системы можно представить в виде:
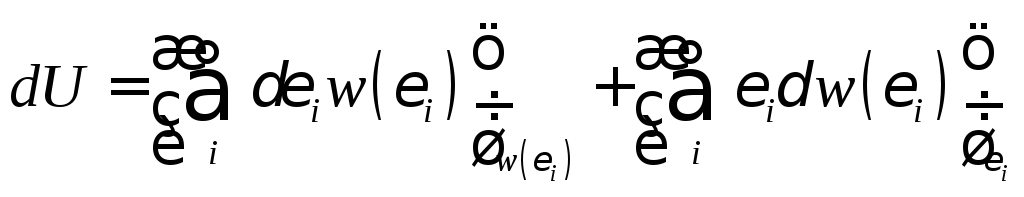 (2.3.1)
(2.3.1)
Здесь
![]() – изменение энергетических уровней
системы при очень малом изменении её
внешних параметров
– изменение энергетических уровней
системы при очень малом изменении её
внешних параметров![]() :
:
 .
.
При этом распределение
вероятностей микросостояний остаётся
неизменным. Величина
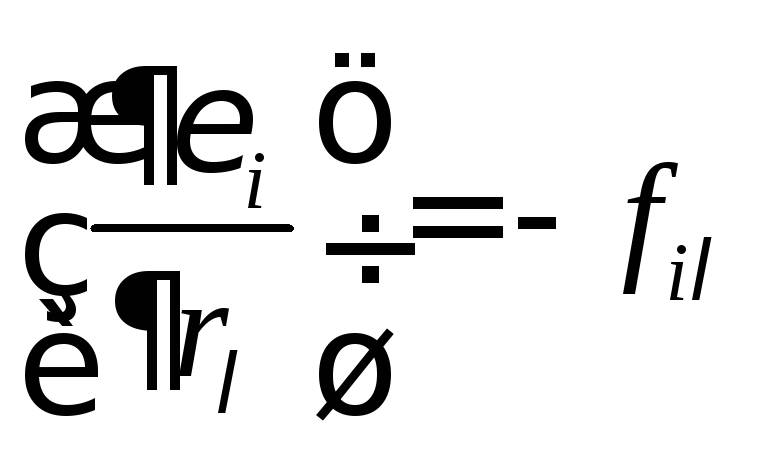 – сила, действующая на систему при
измененииi-ого
энергетического уровня вследствие
изменения параметра
– сила, действующая на систему при
измененииi-ого
энергетического уровня вследствие
изменения параметра
![]() .
Подставляя
.
Подставляя![]() в первое слагаемое правой части
соотношения (2.2.4), получаем:
в первое слагаемое правой части
соотношения (2.2.4), получаем:
![]() .
.
Здесь
![]() – средняя обобщенная сила, действующая
на подсистему при изменении параметра
– средняя обобщенная сила, действующая
на подсистему при изменении параметра![]() .
Таким образом,
.
Таким образом,
![]() (2.3.2)
(2.3.2)
есть работа,
производимая над подсистемой при
изменении внешних параметров
![]() на величину
на величину![]() .
Например, если
.
Например, если![]() – высота поршняh
в цилиндре с газом, то
– высота поршняh
в цилиндре с газом, то
![]() ,
гдер
– давление газа, S
– площадь поршня. Тогда
,
гдер
– давление газа, S
– площадь поршня. Тогда
![]() ,
гдеdV
– изменение объёма подсистемы (газа в
цилиндре).
,
гдеdV
– изменение объёма подсистемы (газа в
цилиндре).
![]() не является полным дифференциалом
какого-либо выражения. Обобщённая сила
не является полным дифференциалом
какого-либо выражения. Обобщённая сила![]() зависит от внешних параметров
зависит от внешних параметров![]() и температуры
и температуры![]() .
Работа, произведённая над системой при
изменении параметра
.
Работа, произведённая над системой при
изменении параметра![]() :
:
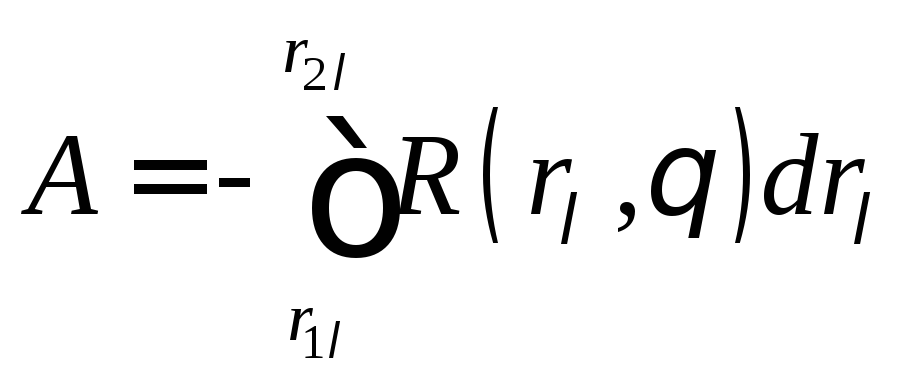
зависит от пути интегрирования. Нельзя определить работу, зная только начальное и конечное состояние системы, она не является функцией состояния.
Второе слагаемое в соотношении (2.2.4) преобразуем следующим образом:
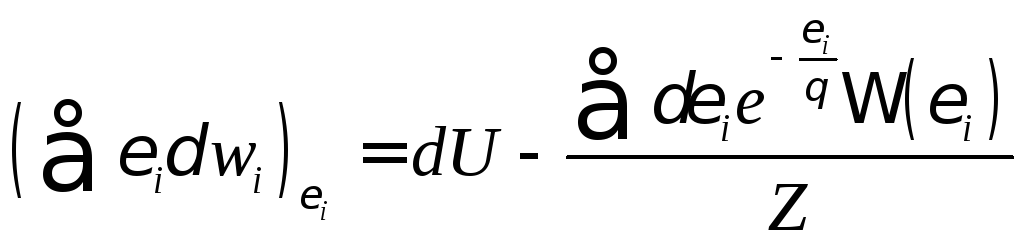 (2.3.3)
(2.3.3)
Поскольку
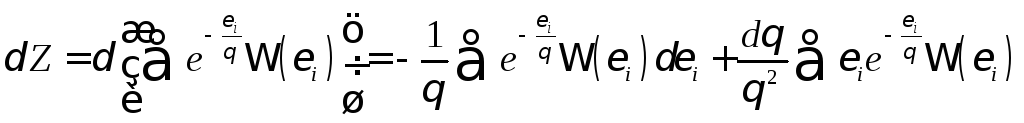 ,
то получаем
,
то получаем .
Так как
.
Так как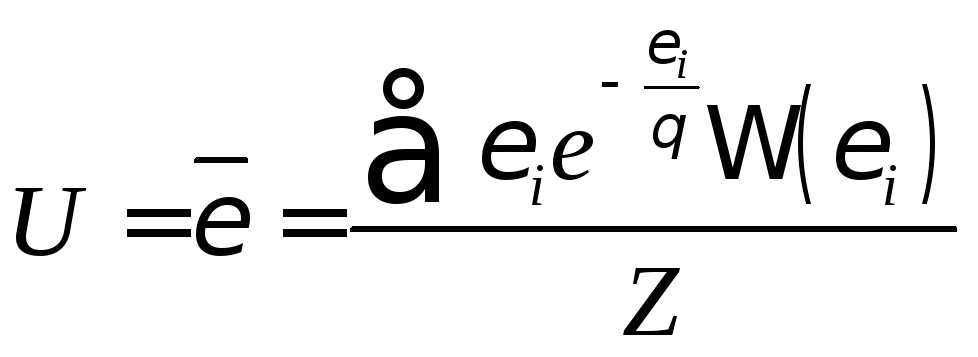 ,
то
,
то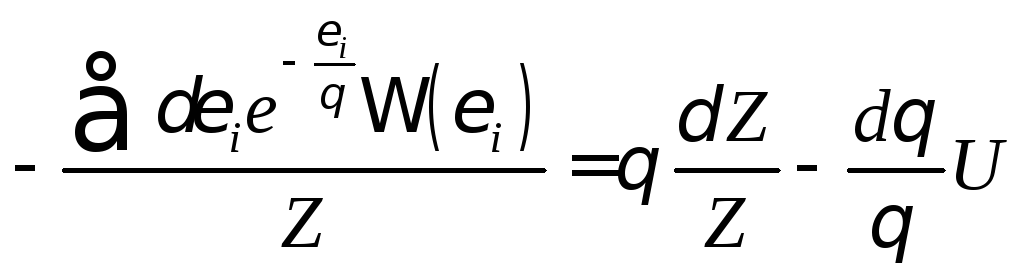 .
.
Подставляем последнее выражение в (2.3.3):
![]() .
.
Для макроскопической системы:
![]() .
.
Следовательно
![]() и
и![]() .
Поскольку энтропия
.
Поскольку энтропия![]() есть функция состояния, то элементарное
изменение этой величины
есть функция состояния, то элементарное
изменение этой величины![]() заменяем дифференциалом
заменяем дифференциалом![]() .
.
Если энергетические
уровни системы остаются неизменными
(внешние параметры не меняются), то
энергия, подводимая к системе или
отдаваемая ею, идёт на изменение
распределения вероятностей микросостояний.
Изменение энергии подсистемы возникает
вследствии непосредственного
взаимодействия частиц среды и подсистемы.
Эту часть изменения энергии называют
количеством теплоты
![]() .
Таким образом:
.
Таким образом:
![]() (2.3.4)
(2.3.4)
Для квазистатических процессов:
![]() (2.3.5)
(2.3.5)
Подставляя (2.2.5) и (2.2.7) в соотношение (2.2.4) находим полное изменение внутренней энергии системы:
![]() (2.3.6)
(2.3.6)
Для квазистатических
процессов
![]() .
Если внешний параметр – объём системыV,
то
.
Если внешний параметр – объём системыV,
то
![]() (2.3.7)
(2.3.7)
Это одно из важнейших термодинамических соотношений.
Количество теплоты
![]() ,
так же как и работа, не является функцией
состояния. Количество теплоты
,
так же как и работа, не является функцией
состояния. Количество теплоты![]() ,
которым подсистема обменивается с
окружающей средой, зависит от процесса.
Функция состояния – это функция, которая
в заданном состоянии системы имеет
вполне определённое значение независимо
от того, каким путём или способом система
в это состояние приводится. Для функции
состояния интеграл по замкнутому циклу
изменения состояний равен нулю. Например
,
которым подсистема обменивается с
окружающей средой, зависит от процесса.
Функция состояния – это функция, которая
в заданном состоянии системы имеет
вполне определённое значение независимо
от того, каким путём или способом система
в это состояние приводится. Для функции
состояния интеграл по замкнутому циклу
изменения состояний равен нулю. Например![]() ,
для обратимых процессов
,
для обратимых процессов![]() .
.
