
- •V.7 Карбонільні сполуки
- •7.1 Класифікація, номенклатура, ізомерія
- •ІзобутилметилкетонЦиклопентен–3–он
- •7.2 Фізичні властивості
- •7.3 Будова карбонільної групи
- •7.4 Хімічні властивості
- •I Реакция нуклеофильного приєднання аn
- •Ця реакція лежить в основі оксимного титрування – методу аналізу для кількісного визначення карбонільних сполук.
- •Пропаналь 4–Нітрофенілгідразин 4–Нітрофенілгідразон пропаналя
- •Реакція каталізується лугами, оскільки слабка кислота hcn має невелику концентрацію нуклеофільних частинокCn–. Механізм реакції складається з утворення нуклеофілу cn–:
- •Ацетон Етилмагнійбромід
- •І.5 Реакції конденсації
- •Іі Реакції оліго- і полімеризації
- •Триоксан
- •V Диспропорціювання альдегідів
- •Бензальдегід (60%) бензиловий спирт Бензоат калію
- •VI Реакція вуглеводневого радикалу
- •7.5 Добування карбонільних сполук
- •7.6 Окремі представники. Викростання оксосполук
I Реакция нуклеофильного приєднання аn
Механізм реакцій нуклеофільного приєднання зумовлюється полярністю звязку С=О,
яка забезпечує виникнення електрофільного (С+) та основного центрів (:О:). Більшість реакцій АN протікає за однією із схем:

 +Nu:
R O–
+H+
+Nu:
R O–
+H+
R




 –––––––––––>
C –––––––––––
R OH
–––––––––––>
C –––––––––––
R OH


 +
–
повільно
(H)R Nu швидко
C
+
–
повільно
(H)R Nu швидко
C
 C===O
––– Оксонієвий
аніон –––>
C===O
––– Оксонієвий
аніон –––>
( H)R1
+H+
R +Nu:
(H)R1
Nu
H)R1
+H+
R +Nu:
(H)R1
Nu
Оксосполука –––––––––––> + ––––––––––– продукт
 швидко
С––ОН повільно
реакції АN
швидко
С––ОН повільно
реакції АN
(Н)R1
Карбкатіон
У першому випадку нуклеофіл атакує електрофільний центр (С+), внаслідок чого –звязок С=О розривається, а пара електронів , що утворювали –звязок, переходить на атом Оксигену, на якому виникає повний негативний заряд. Карбонільний атом С набуває sp3–гідридизованого стану і утворює –звязок з нуклеофілом (С–Nu). Проміжна сполука – оксонієвий аніон – є сильною основою, тому він легко взаємодіє з будь–якою кислотою, навіть з Н2О, відщеплюючи від них і приєднуєчи до себе протон.
За іншою схемою механізму АN на першій стадії відбувається кислотний каталіз – взаємодія карбонільного атома Оксигену із протоном Н+ і утворення карбкатіона, з повним позитивним зарядом на атомі Карбону, який переходить у sp3–гібридизований стан і на другій стадії піддається атакуванню нуклефілом.
В обох випадках лімітуючою стадією, що визначає швидкість взаємодії за механізмом АN в цілому, є приєднання нуклеофілу. Тому зрозуміло, що характер протікання реакції зумовлюється величиною позитивного заряду на карбонільному атомі С, яка залежить від будови вуглеводневого радикалу і природи замісників. Електроноакцепторні замісники (Hal, OH, NH2, SH тощо) відтягують від карбонільного С електронну густину, збільшуючи позитивний заряд на ньому, і полегшують та прискорюють протікання реакцій АN. Електронодонорні замісники (СnH2n+1), навпаки, за рахунок позитивного індуктивного ефекту (+І) зміщують електронну густину в бік атома С карбонільної групи, тому + на ньому зменшується, а це сповільнює перебіг реакцій АN. З цієї причини кетони менш реакційноздатні, ніж альдегіди, оскільки сумарний електронодонорний ефект двох радикалів у кетонах сильніший порівняно з одним радикалом у молекулі альдегіду.
Ароматичні оксосполуки теж виявляють меншу активність у реакціях нуклеофільного приєднання. Це пояснюється , –спряженням бензенового кільця з карбонільною групою, внаслідок чого спостерігається помітне зменшення часткового позитивного заряду на карбонільному атомі С.
На реакційну здатність оксосполук впливають і стеричні чинники: обємні радикали ускладнюють атакування нуклеофілом карбонільного атома Карбону і, отже, знижують швидкість реакцій.
Аліциклічні кетони виявляють вищу реакційну здатність порівняно з їх аліфатичними аналогами, що пояснюється відсутністю обертання метиленових груп СН2 навколо –звязків у циклах, тобто меншими конформаційними можливостями. Підсумовуючи розглянуті чинники, можна розташувати окремі типи карбонільних сполук у ряди за їх активністю в реакціях нуклеофільного приєднання.
Зменшення реакційної здатності в реакціях АN:
––––––––––––––––––––––––––––––––––––––––––––––>
за довжиною вуглеводневого радикалу
H–HС=О > CH3–CH=O > CH3–CH2–CH=O > CH3–(CH2)n–CH=O
за кількістю електроноакцепторних замісників
ССl3–CH=O > CHCl2=O > CH2Cl–CH=O > CH3–CH=O
за розташуванням електроноакцепторного замісника
СH3–CHCl–CH=O > CH2Cl–CH2–CH=O
за природою замісника
СH3–CHCl–CH=O > CH3–CH2–CH=O > CH3–CH(CH3)–CH=O
за положенням карбонільної групи
 O
O
C H3–CH2–C
> CH3–C–CH3
H3–CH2–C
> CH3–C–CH3
H
O
за стеричними і конформаційними факторами
CH3 CH3
CH3–CH2–C–CH2–CH3 > CH3–C–––C–––C–CH3
O CH3 O CH3

> CH3–CH2–C–CH2–CH3
О
– за наявністю ароматичності



 О
О
 н–С6Н14–С
> >
>
н–С6Н14–С
> >
>
Н
–––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––>
зменшення реакційної здатності в реакціях АN
Розглянемо найважливіші реакції приєднання за природою нуклеофілів до карбонільних сполук різних .
І.1. Реакції АN з оксигенвмісними нуклеофілами
Взаємодія з водою характерна для альдегідів, в яких на карбонільному атомі С+ є досить значний дефіцит електронної густини. Внаслідок реакції утворюються гідратні форми альдегідів – гемінальні діоли, або гем–діоли:
OH
 O
O

 R–C
+ H2O
R–CH–OH
R–C
+ H2O
R–CH–OH
H
Альдегід Гем–діол
Зміщення рівноваги залежить від реакційної здатності оксосполуки. Наприклад, формальдегід при 250С практично на 100% перебуває в гідратнованому стані, ацетальдегід – вже тільки на 51%, а пропаналь – на 46 %. Для насичених аліфатичних альдегідів з довгим або розгалуженим вуглецевим ланцюгом гідратна форма майже не зустрічається. А незаміщені кетони практично не взаємодіють з водою.
Альдегіди з електроноакцепторними замісниками в –положенні утворюють стійкі гідратні форми, наприклад:
CCl3–CH=O + H2O ––> CCl3–CH(OH)2
Трихлоретаналь 2,2,2–Трихлоратандіол–1,1
(хлораль) (хлоральгідрат)
Хлоральгідрат використовують як лікарський засіб із снотворною та анестезуючою дією.
Взаємодія із спиртами, в яку вступають головним чином альдегіди, меншою мірою – кентони з аліциклічною структурою.
Внаслідок реакції приєднання АN молекули спирту до молекули альдегіду утворюються напівацеталь – клас органічних сполук, що містять при одному атомі С одночасно і гідроксильну (ОН) і алкоксильну (R–O) групи, наприклад:
OH
 O
O
С Н3–C
+ CH3–CH2–OH
CH3–CH–O–CH2–CH3
Н3–C
+ CH3–CH2–OH
CH3–CH–O–CH2–CH3
 H
Н+
H
Н+
Ацетальдегід Етанол 1–Етоксиетанол–1
(напівацеталь)
Реакція оборотна, оскільки напівацеталі, хоч і виявляють стійкість у лужному середовищі, але піддаються гідролізу в присутності кислоти.
Напівацеталі здатні до подальшої взаємодії з другою молекулою спирту, перетворюючись в ацеталі – речовини, в молекулах яких один атом С сполучений з двома алкоксильними групами:
OH O–CH2–CH3
 СН3–CH–O–CH2–CH3
+ CH3–CH2–OH
CH3–C––O–CH2–CH3
+ H2O
СН3–CH–O–CH2–CH3
+ CH3–CH2–OH
CH3–C––O–CH2–CH3
+ H2O
H+
Напівацеталь Спирт 1,1–Диетиоксиетан
(ацеталь)
Однак необхідно звернути увагу, що утворення повного ацеталю із напівацеталя проходить вже за механізмом нуклеофільного заміщення.
Загальну схему реакції, яка складається з приєднання за механізмом АN і заміщення за механізмом SN, можна представити так:
 OH
..
OH OH
OH
..
OH OH
 O
+H+
C2H5OH
+
H +H+
+H+
O
+H+
C2H5OH
+
H +H+
+H+



 CH3–C
CH3–C+
H CH3–CH–O–C2H5
CH3–CH–O–CH2–CH3
CH3–C
CH3–C+
H CH3–CH–O–C2H5
CH3–CH–O–CH2–CH3
 H
Напівацеталь
H
Напівацеталь


 H
+
H
H + CH2–CH3
H
+
H
H + CH2–CH3
 O
..
O
O
..
O
–H2O + C2H5OH –H+



 CH3–CH–O–CH2–CH3
CH3–CH–O–CH2–CH3
CH3–CH–O–CH2–CH3
CH3–CH–O–CH2–CH3
CH3–CH–O–CH2–CH3
CH3–CH–O–CH2–CH3
O–CH2–CH3
 CH3–CH–O–CH2–CH3
CH3–CH–O–CH2–CH3
Ацеталь
Стійкість напівацеталей і повних ацеталей до лужного середовища лежить в основі захисту оксогрупи у складі гетеросполук (оксокислот, оксоестерів і т.п.), коли необхідно провести якусь реакцію з іншою функціональною групою, зберігаючи при цьому карбонільну групу. Наприклад, при відновлюванні естеру оксокислоти, спочатку захищають оксогрупу при її взаємодії із спиртом (найчастіше – з етиленгліколем), піддають відновлюванню естерну групу і тільки після цього знімають ацетальний чи напівацетальний захист з карбонілу:

CH2––CH2 H+
+ ––––––––––––––––––––>
OH OH захист оксогрупи
Метиловий естер Етиленгліколь
2–Оксоциклогексанкарбо–
нової кислоти
(метил–6–оксоциклогексан–
 карбоксилат)
карбоксилат)
[H], кат
–––––––––––––> –––––––––––––––––––––––––>
відновлення естерної групи
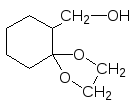

знімання захисту
–––––> ––––––––––––––––>
+H2O, H+
2–Гідроксиметил–
циклогексанон
І.2 Реакції АN із Сульфурвмісними нуклеофілами
Найважливішою є взаємодія з насиченим розчином гідросульфіту натрію, яка дозволяє виділити карбонільні сполуки із їх суміші з іншими органічними речовинами. Внаслідок реакції утворюються кристалічні осади – гідросульфітні похідні оксосполук, або –гідроксисульфонати натрію.
OH OH O
 O
O
CH3–C + :S––ONa ––––> CH3–CH––S–ONa
 H
H
O O
Етил––гідроксисульфонат натрію
Гідросульфітні похідні гідролізуються у кислому чи лужному середовищі :
R–CH–SO3Na + HCl –––––––> R–CH=O + NaCl + SO2 + H2O
H2O
OH
R–CH–SO3Na + NaHCO3 –––––––> R–CH=O + Na2CO3 + SO2 + H2O
H2O
OH
І.3 Реакції АN з Нітрогенвмісними нуклеофілами
Найважливішими N–нуклеофілами є амоніак NH3 та інші сполуки, які можна розглядати як його похідні: аміни NH2–R, гідроксиламін NH2–OH, гідразин NH2–NH2 тощо.
Як правило, ці реакції не завершуються нуклеофільним приєднанням – одразу після нього протікає відщеплення води, тому точніше буде позначити їх механізм як АN –E, тобто сукупність нуклеофільного приєднання та елімінування:

 R
R
R
R

 C==O
+ NH2–X
––> C==N–X + H2O
C==O
+ NH2–X
––> C==N–X + H2O
(H)R1 (H)R1
Реакція каталізується як кислотами, так і лугами, тому відповідно і гідроліз одержаних похідних може відбуватися у кислому чи нейтральному середовищі.
 Механізм
реакції приєднання – відщеплення (AN–E)
у загальному
вигляді зображується так:
O–
H :OH
Механізм
реакції приєднання – відщеплення (AN–E)
у загальному
вигляді зображується так:
O–
H :OH

 R
+
–
..
..
H+
R
+
–
..
..
H+


 C====O
+ NH2–X
R–C––N+––X
R––C––N––X
C====O
+ NH2–X
R–C––N+––X
R––C––N––X
(H)R1
(H)R1 H (H)R1 H
Оксосполука Біполярний іон Гем–аміноспирт

 H
+
H
H
+
H
O
–H2O + –H+


 R–C––N––X R–C––N
R––C==N––X
R–C––N––X R–C––N
R––C==N––X
(H)R1 H (H)R1 (H)R1
Оксонієвий катіон Карбкатіон Імін
Взаємодія з амоніаком на першій стадії (АN) дає гемінальний аміноспирт, який швидко
дегідратується на другій стадії (Е), перетворюючись на імін, або основу Шиффа – клас сполук, що містять у головному ланцюгу іміногрупу >C=NH.
Іміни альдегідів надзвичайно легко циклізуються, утворюючи альдегідоамоніаки – шестичленні цикли, в яких атоми Нітрогену і Карбону розміщуються почергово. Наприклад, внаслідок тримеризації іміну оцтового альдегіду одержують ацетальдегідамоніак, який має торгівельну назву вулкацит і застосовується як прискорювач при вулканізації каучуків:
 CH3
CH3
CH
3СН3–СН=NH ––––––––––––––––> HN NH
Ацетімін Тримеризація
HC CH
H3C NH CH3
Ацетальдегідамоніак
Особливу схильність до циклізації виявляє продукт взаємодії формальдегіду з амоніаком. Спочатку утворюється гем– аміноспирт
 NH2
NH2
HCH=O + NH3 ––> CH2
 OH
OH
Амінометанол
який через декілька швидких стадій дає кристалічну сполуку з каркасною структурою, що нагадує кристалічну структуру алмазу, – гексаметилентетрамін (уротропін); сумарно процес зображують схемою:
 CH2
CH2
N N
6HCH=O + 4NH3 ––> + 6H2O
CH2 CH2
N
CH2 CH2
CH2
N
Гексаметилентетрамін (уротропін)
Уротропін використовують у медицині як антисептичний засіб, а також як основу для одержання сильної вибухівки – гексогену:
 СН2 СН2
СН2 СН2
O2N NO2
N N N N
5 CH2 CH2 + 24HO–NO2 ––––––––––> 5 CH2 CH2 + 15 HCOOH + 7N2+12H2O
(CH3CO)2O
N N
CH2 CH2 CH2 NO2
N Гексоген
Іміни кетонів подібних сполук не утворюють
Взаємодія з аміносполуками приводить до заміщених імінів
R–CH=O + NH2–R1 ––––––> R–CH=N–R1 + H2O
Альдегід Первинний Заміщений імін
амін
 Іміни,
утворені з аліфатичних альдегідів і
аліфатичних аміносполук,малостійкі;
вони швидко розкладаються чи
полімеризуються. На відміну від них
ароматичні заміщені ініми більш
стабільні, наприклад:
Іміни,
утворені з аліфатичних альдегідів і
аліфатичних аміносполук,малостійкі;
вони швидко розкладаються чи
полімеризуються. На відміну від них
ароматичні заміщені ініми більш
стабільні, наприклад:
Бензальдегід Анілін N–Бензиліденанілін
Подібно до розглянутої проходить реакція під час біохімічних процесів на одній із стадій зорового циклу.
Взаємодія з гідроксиламіном дає кристалічні осади – оксими – клас сполук, що містять оксимну групу >C=N–OH:
CH3–C=O + NH2–OH ––> CH3–C=N–OH + H2O
CH3 Гідроксиламін СН3
Ацетон Оксим ацетону
