
- •V.7 Карбонільні сполуки
- •7.1 Класифікація, номенклатура, ізомерія
- •ІзобутилметилкетонЦиклопентен–3–он
- •7.2 Фізичні властивості
- •7.3 Будова карбонільної групи
- •7.4 Хімічні властивості
- •I Реакция нуклеофильного приєднання аn
- •Ця реакція лежить в основі оксимного титрування – методу аналізу для кількісного визначення карбонільних сполук.
- •Пропаналь 4–Нітрофенілгідразин 4–Нітрофенілгідразон пропаналя
- •Реакція каталізується лугами, оскільки слабка кислота hcn має невелику концентрацію нуклеофільних частинокCn–. Механізм реакції складається з утворення нуклеофілу cn–:
- •Ацетон Етилмагнійбромід
- •І.5 Реакції конденсації
- •Іі Реакції оліго- і полімеризації
- •Триоксан
- •V Диспропорціювання альдегідів
- •Бензальдегід (60%) бензиловий спирт Бензоат калію
- •VI Реакція вуглеводневого радикалу
- •7.5 Добування карбонільних сполук
- •7.6 Окремі представники. Викростання оксосполук
Іі Реакції оліго- і полімеризації
 Це
тип реакцій характерний, в основному,
для альдегідів. При тривалому зберіганні
вони здатні піддаватися циклічній три-
чи тетрамеризації
Це
тип реакцій характерний, в основному,
для альдегідів. При тривалому зберіганні
вони здатні піддаватися циклічній три-
чи тетрамеризації
3НСН=О ------------
Формальдегід
Триоксан

4НСН=О ----------
Тетраоксан
 Ацетальдегід
залежно від умов теж може давати різні
олігомери:
Ацетальдегід
залежно від умов теж може давати різні
олігомери:
200C
3CH3-CH=O ---------
Паральдегід

00C
4СH3-CH=O -----------
Метальдегід
Метальдегід використовується як паливо – так званий “сухий спирт”.
Формальдегід легко полімеризується з утворенням полімера лінійної будови – параформа, який є білим порошком, що при нагріванні знову розкладається на формальдегід. Ця властивість використовується при зберіганні та транспортуванні мурашиного альдегіду.
полімеризація
nHCH=O ------------------ HO-(CH2-O)n-H
Параформ (n = 10-12)
ІІІ Реакції відновлення
При відновленні альдегідів утворюються первинні спирті, а кетонів – вторинні:
[H]
R-CH=O --------------- R-CH2-OH,
Альдегід Первинний спирт
[H]
R-C(О)-R1 --------------- R-CH(OH)-R1.
Кетон Вторинний спирт
Як відновники використовують різні сполуки.
1) Відновлення комплексними гідридами – алюмогідридом літію Li[AlH4], борогідридом натрію Na[BH4] та їх похідними, наприклад триметоксиалюмогідридом літію Li[AlH(OCH3)3] чи триетилборогідридом натрію Na[BH(C2H5)3]. Відновники цього типу особливо цінні при відновлюванні ненасичених карбонільних сполук, оскільки вони селективно відновлюють групу >CH=O, не займачу звязків С=С і СС. У той же час комплексними гідридами не можливо відновлювати деякі гетерофункціональні оксосполуки, що містять цианогрупу -СN, нітрогрупу – NO2, естерну групу – СООR, які відновлюються легше карбонільної групи >CH=O.
Реакцію з Li(AlH4] проводять в апротонних (неполярних розчинниках), оскільки алюмогідрид розкладається водою і навіть спиртами, а з Na[BH4], більш стійкому до дії апротонних розчинників, - у спиртовому чи водному середовищі, наприклад:
Li[AlH4]
CH2=CH-CH=O + H2 ------------------- CH2=CH-CH2-OH
Акролеїн етер Аліловий спирт
Na[BH4]
C6H4-C-CH3 + H2 ------------------- C6H5-CH-CH3
етер
О ОН
Ацетофенон -Фенілетанол
2
 )Каталітичне
гідрування
проводиться воднем за жорстких умов,
тому може відновлювати не тільки
карбонільну групу, але і кратні звязки
та інші функціональні групи (
-CN, -NO2,
-COOR):
)Каталітичне
гідрування
проводиться воднем за жорстких умов,
тому може відновлювати не тільки
карбонільну групу, але і кратні звязки
та інші функціональні групи (
-CN, -NO2,
-COOR):
500C, 70 Атм
+ 2H2 ---------------------
Ni
Циклопентен-3-он Циклопентанол
3) Відновлення за реакцією Клемменсена амальгамовим цинком у концентрованій соляній кислоті при нагріванні, який відновлює карбонільну групу до метиленової (-СН2-):

 1000C
1000C
+ 2Zn + 4HCl ------- +2ZnCl2 +H2O

 Hg
Hg
НО НО
4-Гідроксиацетофенон 4-Етилфенол
4) Відновлення за реакцією Кіжнера-Вольфа гідразином у лужному середовищі у присутності розчинника з високою температурою кипіння (наприклад, етиленгліколь)

 KOH,
2000C
KOH,
2000C
+ N2H4 ------------------- + N2 + H2O
C2H4(OH)2
1-Фенілпропанон-1 Пропілфенол
Дві останні реакції – за Клемменсеном і Кіжнером-Вольфом доповнюють одна одну, оскільки дозволяють відновлювати гетерофункціональні альдегіди і кетони, що містять групи, чутливі до кислого чи до лужного середовища. Залежно від цього можна відновлювати карбонільні сполуки найзручнішим методом.
ІV Реакції окиснення
Альдегіди окиснюються значно легше, ніж кетони. При окисненні альдегідів утворюються відповідні карбонові кислоти, а окиснення кетонів звичайними окисниками найчастіше проходить деструктивно, із розривом звязків у вуглецевому ланцюгу і дає суміш продуктів, які належать до різних класів:

 O
[O] O
O
[O] O

 R-C
----------
R-C
R-C
----------
R-C
H О––H
Альдегід Карбонова кислота

 [O],
t0
O O
[O],
t0
O O

 R-C
–CH2-R1
----------
R-C + R1-C
R-C
–CH2-R1
----------
R-C + R1-C
H OH
O
Кетон Суміш карбонових кислот
 [O],
t0
O
[O],
t0
O
 R-C
–-CH-R1
----------
R-C + СН3-С-R1
R-C
–-CH-R1
----------
R-C + СН3-С-R1
ОH
O СН3 О
Із загальної закономірності вибивається мурашиний альдегід, який при окисненні як правило перетворюється не у карбонову кислоту, а в оксид карбону (ІV).
 O
[O]
O
[O]
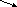 H-C
---------
CO2
+ H2O.
H-C
---------
CO2
+ H2O.
H
Формальдегід
Для окиснення альдегідів використовують лужний чи нейтральний розчин KMnO4, сірчанокислий розчин K2Cr2O7 або CrO3, а для окиснення кетонів – пероксидні сполуки, що містять пероксидну місткову групу –О-О-, наприклад, пероксиоцтова кислота СН3-С(О)-ООН, мононадсірчана H2SO5 і особливо трифторпероксиоцтова CF2-C(O)-OOH.

 O
О
O
О

 3CH3-C
+ 2KMnO4
+ H2O
3CH3-C
+ 2MnO2
+ 2KOH
3CH3-C
+ 2KMnO4
+ H2O
3CH3-C
+ 2MnO2
+ 2KOH
H ОН
Ацетальдегід Оцтова кислота

 O
O
O
O

 CH3-CH2-C-CH3
+ CF3-C
-------
CH3-CH2-C
+ CF3COOH
CH3-CH2-C-CH3
+ CF3-C
-------
CH3-CH2-C
+ CF3COOH
O-OH O-CH3
O
Бутанон Трифторперокси- Метилпропінонат Трифтор-
оцтова кислота (естер) оцтова кислота
Якісні реакції на альдегідну оксогрупу базуються саме на відновлювальній здатності альдегідів. Кетони в такі реакції не вступають. Існує декілька відомих якісних реакцій, в яких застосовуються різні якісні реагенти:
Реактив Толенса – оксид срібла у вигляді аміачного комплексу дає яскраву реакцію “срібного дзеркала”:

 O
t0
O
O
t0
O
R
 -C
+ 2[Ag(NH3)2]OH
--------
R-C + 2Ag
+ 4NH3
+ H2O
-C
+ 2[Ag(NH3)2]OH
--------
R-C + 2Ag
+ 4NH3
+ H2O
H OH
Альдегід Реактив Толенса Кислота
Реактив Толенса не є специфічним реагентом лише на альдегіди, він окиснює сполуки і деяких інших класів – багатоатомні феноли, амінофеноли, ароматичні аміни, гідроксикетони, вуглеводи з альдегідними оксогрупами.
Реактив Фелінга, або фелінгова рідина – комплекс гідроксида міді (ІІ) із змішаною калієво-натрієвою сіллю винної кислоти (тартратом натрія–калія або сегнетовою сіллю).
COOK KOOC
 H
H
O CH-O O-CH O
R-C + 2 Cu + 2H2O ------ R-C + Cu2O +
H CH-O O-CH OH
H
COONa NaOOC
Альдегід Реактив Фелінга (комплексний
тартрат міді (ІІ) із сегнетовою сіллю)
+ KOOC-CH(OH)-CH(OH)-COONa
Сегнетова сіль (тартарат калію-натрію)
При дії реактивом Фелінга на альдегіди утворюється червоний осад Cu2O – реакція “мідного дзеркала”.
Для спрощення запису схему реакції “мідного дзеркала” при взаємодії альдегідів з реактивом Фелінга записують так:

 O
O
O
O

 R-C
+ 2Cu(OH)2
------------------
R-C + Cu2O
+ 2H2O
R-C
+ 2Cu(OH)2
------------------
R-C + Cu2O
+ 2H2O
Н винная кислота ОН
Фелінгова рідина подібно до реактива Толенса теж може окиснювати сполуки інших класів, але на відміну від нього не взаємодіє з ароматичними альдегідами.
Реактив Бенедикта – цитратний комплекс міді (ІІ), утворений гідроксидом міді (ІІ) з лимонною кислотою (НООС-СН2-СН(ОН)-СН2-СООН) – ще один різновид реакції “мідного дзеркала”:

 O
O
O
O

 R-C
+ 2Cu(OH)2
--------------------
R-C + Cu2O
+ 2H2O
R-C
+ 2Cu(OH)2
--------------------
R-C + Cu2O
+ 2H2O
H лимонна кислота OH
