
- •V.7 Карбонільні сполуки
- •7.1 Класифікація, номенклатура, ізомерія
- •ІзобутилметилкетонЦиклопентен–3–он
- •7.2 Фізичні властивості
- •7.3 Будова карбонільної групи
- •7.4 Хімічні властивості
- •I Реакция нуклеофильного приєднання аn
- •Ця реакція лежить в основі оксимного титрування – методу аналізу для кількісного визначення карбонільних сполук.
- •Пропаналь 4–Нітрофенілгідразин 4–Нітрофенілгідразон пропаналя
- •Реакція каталізується лугами, оскільки слабка кислота hcn має невелику концентрацію нуклеофільних частинокCn–. Механізм реакції складається з утворення нуклеофілу cn–:
- •Ацетон Етилмагнійбромід
- •І.5 Реакції конденсації
- •Іі Реакції оліго- і полімеризації
- •Триоксан
- •V Диспропорціювання альдегідів
- •Бензальдегід (60%) бензиловий спирт Бензоат калію
- •VI Реакція вуглеводневого радикалу
- •7.5 Добування карбонільних сполук
- •7.6 Окремі представники. Викростання оксосполук
Ацетон Етилмагнійбромід
CH3
–––––––––> CH3–C–CH2–CH3 + MgOHBr
OH
2–Метилбутанол–2
Останнім часом замість магнійорганічних сполук почали використовувати більш реакційноздатні літійорганічні сполуки, особливо у реакціях з малоактивними кетонами, наприклад:
CH3
H2O
СH2=CH–CH2–Li + CH3–C––CH–CH3 ––––––> CH2=CH–CH2–C–––CH–CH3 –––––––>
етер
O CH3 OLi CH3
CH3
––––––> CH2=CH–CH2–C–––CH–CH3 + LiOH
OH CH3
4,5–Диметилгексен–1–ол–4
І.5 Реакції конденсації
Більшість реакцій конденсації карбонільних сполук теж протікають за механізмом нуклеофільного приєднання АN, який може в окремих випадках завершуватися елімінуванням.
1) Альдольна і кротонова конденсації проходять у присутності лугів. У такі реакції вступають карбонільні сполуки, які містять в –положенні щонайменше один атом Гідрогену, тобто мають –СН–реакційний центр.
Внаслідок альдольної конденсації утворюються альдолі (–гідроксиальдегіди), а внаслідок кротонової конденсації , яка проходить при нагріванні, – ,–ненасичені карбонільні сполуки:
KOH, 100C
2R–CH2–CH=O –––––––––––––––––––––> R–CH2–CH–CH–CH=O
альдольна конденсація
ОН R
Альдегід Альдоль
KOH, t0C
2R–CH2–CH=O –––––––––––––––––––––> R–CH2–CH=C–CH=O
кротонова конденсація
R
,–Ненасичений альдегід
Наприклад, при дії лугом на оцтовий альдегід утворюються такі продукти:
H OH


 O
O 100C
O t0
O
O 100C
O t0


 CH3–C
+ CH2–C
–––––––––> CH3–CH–CH2–C
–––––––>
CH3–C
+ CH2–C
–––––––––> CH3–CH–CH2–C
–––––––>
H H OH– H
Оцтовий альдегід –Гідроксибутаналь
(альдоль)
 O
O
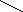 –––––––>
CH3–CH=CH–C
+ H2O
–––––––>
CH3–CH=CH–C
+ H2O
H
Бутен–2–аль (кротоновий альдегід)
Саме кротоновий альдегід і дав назву цьому типу конденсації для всіх інших карбонільних сполук.
Альдольна конденсація відбувається за таким механізмом. Під дією лугу від –СН–кислотного центру молекули карбонільної сполуки відщеплюється протон і вона перетворюється на сильний нуклеофіл – карбаніон. Нуклеофіл атакує карбонільний атом С другої молекули з утворенням оксонієвого аніона – сильної основи, яка здатна приєднувати інший протон, відщеплюючи його навіть від води:
–
R–CH–CH=O + OH– –––––> R–CH–CH=O + H2O
H Карбаніон (нуклеофіл)
 –O–
–O–
 +
O –
Н2О
+
O –
Н2О
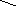 R–CH2–C
+ CH–CH=O ––––––> R–CH2–CH–CH–CH=O
–––––––>
R–CH2–C
+ CH–CH=O ––––––> R–CH2–CH–CH–CH=O
–––––––>
H
R R
Альдегід Карбаніон оксонієвий аніон
OH
–––––––> R–CH2–CH–CH–CH=O + OH–
R
Альдоль
Альдольну і кротонову конденсації часто проводять з різними вихідними оксосполуками, підбираючи їх таким чином, щоб одна за рахунок електрофільного центру (С+) відігравала роль карбонільної компоненти, а інша – метиленової, з досить високою СН–кислотністю. Наприклад, змішуючи у лужному середовищі бензальдегід, в якому СН–кислотний центр відсутній, з ацетальдегідом який в –положенні містить достатньо рухливі атоми Гідрогену, одержують ,–ненасичений альдегід вже при кімнатній температурі:
Н

 200C,
КОН
200C,
КОН
+ СH–CH=O –––––––––> +H2O
Н
Бензальдегід Ацетальдегід Коричний альдегід
(карбонільна (метиленова
компонента) компонента)
Альдольна конденсація кетонів проходить значно складніше, під дією насичених розчинів Ва(ОН)2, з утворенням –гідроксикетонів, які легше піддаються дегідратації порівняно з –гідроксиальдегідами:
O H OH
CH3–C + CH2–C–CH3 –––––––––––> CH3–C–CH2–C–CH3 –––––––>
Ba(OH)2
CH3 O CH3 O
Ацетон 4–Гідрокси–4–метилпентанон–2
––––––––> CH3–C=CH–C–CH3 + H2O
СН3 О
4–Метилпентен–3–он–2
Необхідно ще раз підкреслити, що оксосполуки, які в –положенні не містять жодного атома Гідрогену, в реакцію альдольної конденсації не вступають. Однак у сильнолужному середовищі такі альдегіди піддаються диспропорціюванню за реакцією Канніццаро, яку буде розглянуто дещо піздніше.
Мурашиний альдегід, в якому –положення взагалі відсутнє, може, подібно до кетонів, вступати в альдольну конденсацію у насиченому розчині Ва(ОН)2 (чи Са(ОН)2).
2HCH=O ––––––––––––––> CH2–CH=O
Ca(OH)2
Формальдегід ОН Гліколевий альдегід
При поступовому нарощуванні ланцюгу за рахунок альдольної конденсації отримують синтетичні моносихариди:
+HCH=O
СН2–СН=O + HCH=O ––––––––––> CH2–CH–CH=O ––––––––––>
Cа(ОН)2 Са(ОН)2
ОН ОН ОН
Гліколевий альдегід
 +HCHO
O
+HCHO
O
 –––>
CH2–CH–CH–CH=O
––––––––> CH2–CH–CH–CH–C
–––>
CH2–CH–CH–CH=O
––––––––> CH2–CH–CH–CH–C
Ca(OH)2 H
OH OH OH OH OH OH OH
Альдопентоза
2) Конденсація з ацетиленом та його похідними, які містять потрійний звязок у крайньому положенні. Завдяки частковому негативному заряду на атомі Карбону в алкінах будови НСС–R вони можуть виступати як нуклеофіли. Реакція каталізується карбідом міді (І) Cu2C2, твердим сухим лугом (NaOH, KOH) чи алкоголятом С2Н5ONa.
Конденсація карбонільних сполук із алкінами використовується для одержання ненасичених спиртів – первинних із формальдегіду, вторинних із інших альдегідів і третинних із кетонів.
HCH=O + HCC–R ––––––––––––> CH2–CC–R
C2H5ONa
OH
Формальдегід Алкін Первинний спирт
R1–CH=O + HCC–R ––––––––––––> R1–CH–CC–R
кат
OH
Альдегід Алкін Вторинний спирт
R2
R1–C–R2 + HCC–R ––––––––––––> R1–C–CC–R
кат
OH
Кетон Алкін Третинний спирт
3) Конденсація з фенолами характерна головним чином для формальдегіду. Цю реакцію, яка має велике промислове значення, було розглянуто при вивченні теми “Феноли”. Вона протікає за механізмом електрофільного заміщення, в якому роль електрофілу відіграє альдегід – за рахунок часткового позитивного заряду на карбонільному атомі С.


 -----------
-----------
+ -
HCH=O + --------- 2-Гідроксибензиловий спирт

-----------

НО 4-Гідроксибензиловий спирт
Однак, якщо оцінювати конденсацію, вважаючи субстратом альдегід, а реагентом фенол, то її теж можна віднести до типу АN відносно формальдегіду.
