
- •6.050502 «Инженерная механика»
- •Введение
- •Лекция №1 производство черных металлов
- •Лекция 2 механические свойтсва металлов и сплавов и методы их определения.
- •Статические испытания
- •Испытания на растяжение
- •Испытания на сжатие
- •Испытания на сжатие
- •Испытание на изгиб
- •Испытания на кручение
- •Испытания на кручение
- •Твердость
- •Другие методы определения твердости
- •Динамические испытания на изгиб образцов с надрезом
- •Усталость и изнашивание
- •Лекция № 3 атомно – кристаллическое строение металлов и сплавов. Реальное строение кристаллов
- •Реальное строение металлических кристаллов
- •Лекция 4 процесс кристаллизации металлов исплавов
- •Лекция № 4 строение сплавов. Диаграммы состояния двойных сплавов.
- •Лекция №5 диаграмма состояния железо - углерод
- •Диаграмма состояния железоуглеродистых сплавов.
- •Лекция 6 формирование структур чугунов. Виды чугунов
- •Практическое применение диаграммы Fe—Fe3c.
- •Лекция 7 общие положения термической обработки
- •Лекция 8 практика термической обработки углеродистой стали
- •Влияние углерода на твердость термически обработанных сталей
- •Определение прокаливаемости стали
- •Лекция 9 химико – термическая обработка: цементация стали
- •Лекция 10 Маркировка и применение легированных сталей Введение
- •Классификация легированных сталей
- •II. Классификация по содержанию углерода:
- •III. Классификация по содержанию легирующих элементов:
- •Маркировка легированных сталей
- •Применение легированных сталей
- •Лекция 11 Маркировка Цветных металлов и сплавов Введение
- •Медь и ее свойства
- •Сплавы на основе меди
- •Алюминий и его сплавы
- •Подшипниковые сплавы
- •Лекция 12 композиционные материалы
- •Классификация композиционных материалов и перспективы развития
- •Металлические композиционные материалы
Лекция № 3 атомно – кристаллическое строение металлов и сплавов. Реальное строение кристаллов
Все вещества могут находиться в трех агрегатных состояниях: твердом, жидком и газообразном, переходы между которыми (так называемые фазовые переходы) сопровождаются скачкообразными изменениями свободной энергии F (F = U — TS, где U — внутренняя энергия; Т —температура; S — энтропия), энтропии, плотности и других физических свойств. Четвертым агрегатным состоянием часто называют плазму — сильно ионизированный газ (т. е. газ заряженных частиц — ионов, электронов), образующийся при высоких температурах (свыше 105 К). Однако это утверждение неточно, так как между плазмой и газом нет фазового перехода. Тем не менее, плазма резко отличается от газа прежде всего сильным электрическим взаимодействием ионов и электронов, проявляющимся на больших расстояниях.
Реализация того или иного агрегатного состояния вещества зависит главным образом от температуры и давления, при которых оно находится.
Т.о. можно отметить, что в газообразном состоянии атомы расположены хаотически, в жидком состоянии имеют близкий порядок в расположении атомов, а в кристаллическом состоянии имеется и ближний и дальний порядок в расположении атомов.
П Рисунок
1- Кристаллографическая плоскость
Это обуславливает то, что в кристалле каждый атом имеет одно и тоже ближайшее количество атомов – соседей, расположенных на Одинаковом расстоянии.
Кристаллическая решетка – это неоднократное повторение кристаллографической плоскости во всех направлениях.
Кристаллическую решетку можно «построить», выбрав для этого определенный «строительный блок» (аналогично постройке стены из кирпичей) и многократно смещая этот блок по трем непараллельным направлениям. Такая «строительная» единица кристаллической решетки имеет форму параллелепипеда и называется элементарной ячейкой. Все элементарные ячейки, составляющие кристаллическую решетку, имеют одинаковую форму и объемы. Атомы могут располагаться как в вершинах элементарной ячейки, так и в других ее точках (в узлах кристаллической решетки). В первом случае элементарные ячейки называются простыми (примитивными), во втором — сложными. Если форма элементарной ячейки определена и известно расположение всех атомов внутри нее, то имеется полное геометрическое описание кристалла, т.е. известна его атомно-кристаллическая структура.
В кристаллографии рассматривают 14 типов элементарных ячеек. Их называют пространственными решетками Бравэ. Для характеристики элементарной ячейки задают шесть величин: три ребра ячейки а, Ь, с и три угла между ними. Эти величины называются параметрами элементарной ячейки (кристаллической решетки). Все 14 решеток Бравэ распределены по семи кристаллическим системам (сингониям) в соответствии с ориентацией и относительными величинами параметров решетки (рис. 2). Каждая кристаллическая система включает одну или несколько типов пространственных кристаллических решеток. В простой решетке атомы располагаются только по вершинам решетки, в объемноцентри-рованной еще один атом в центре решетки, в гранецентрированной еще по одному атому в центре каждой грани, и в базоцентрированной еще по одному атому в центрах пары параллельных граней.
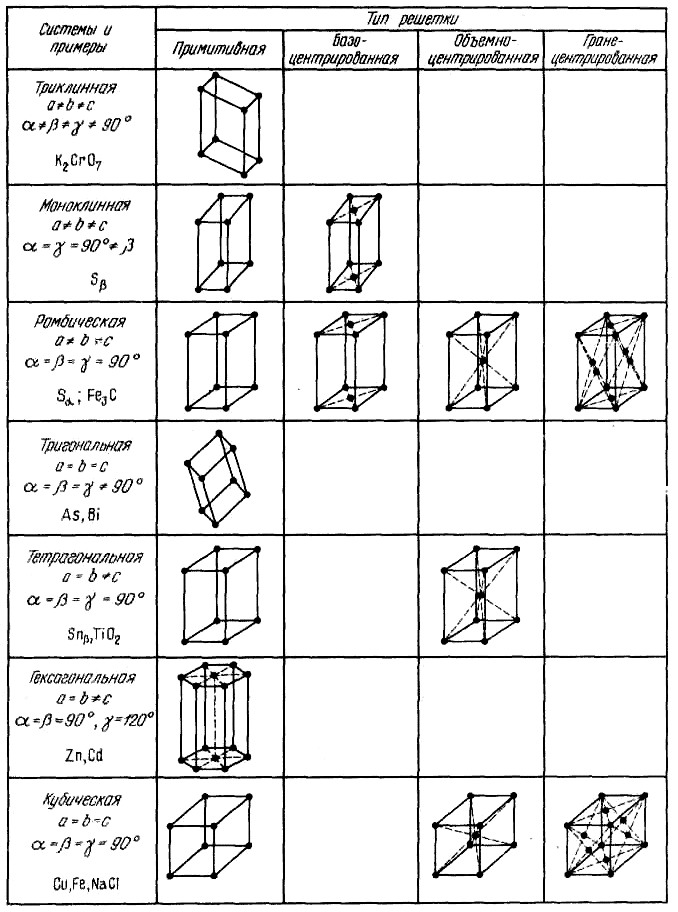
Рисунок 2 – Основные типы кристаллических решеток и их характеристики
Наиболее распространенными среди металлов являются гексагональная плотноупакованная решетка (ГПУ) –Mg, Zn, Co, Ti; гранецентрированная кубическая решетка (ГЦК) – Fe, Ni, Cu, Al, Pb, Ag, Au; объемно-центрированная кубическая решетка (ОЦК) – Fe, Cr, W, V, Mo (рисунок 3).
Компактность структуры является одним из факторов, уменьшающим свободную энергию твердого тела, т. е. обеспечивающим его равновесное состояние и следствием особенностей электронной структуры металлов и характером их межатомного взаимодействия. Поэтому основной характеристикой кристаллической решетки является координационное число. За координационное число принято число ближайших соседей данного атома, находящихся от него на одинаково близком расстоянии.
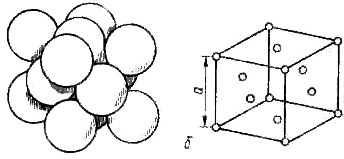

Рисунок 3- Основные виды кристаллических решеток и расположение в них атомов.
Точечное расположение атомов в кристаллических решетках, приведенных на рисунке 3, является условным, так как в действительности атомы имеют определенный размер и могут соприкасаться друг
с другом. Для характеристики величины атома служит атомный радиус, под которым понимается половина расстояния между ближайшими соседними атомами. Параметры элементарной ячейки а, Ь, с и атомные радиусы измеряются в ангстремах (1Å – 10-8 см). Параметры решетки металлов (их также называют периодами решетки) находятся в пределах 0,2—6,7 Å и определяются методом рентгеноструктурного анализа с точностью до третьего, а при необходимости и до четвертого или даже пятого знака после запятой.
