
- •6.050502 «Инженерная механика»
- •Введение
- •Лекция №1 производство черных металлов
- •Лекция 2 механические свойтсва металлов и сплавов и методы их определения.
- •Статические испытания
- •Испытания на растяжение
- •Испытания на сжатие
- •Испытания на сжатие
- •Испытание на изгиб
- •Испытания на кручение
- •Испытания на кручение
- •Твердость
- •Другие методы определения твердости
- •Динамические испытания на изгиб образцов с надрезом
- •Усталость и изнашивание
- •Лекция № 3 атомно – кристаллическое строение металлов и сплавов. Реальное строение кристаллов
- •Реальное строение металлических кристаллов
- •Лекция 4 процесс кристаллизации металлов исплавов
- •Лекция № 4 строение сплавов. Диаграммы состояния двойных сплавов.
- •Лекция №5 диаграмма состояния железо - углерод
- •Диаграмма состояния железоуглеродистых сплавов.
- •Лекция 6 формирование структур чугунов. Виды чугунов
- •Практическое применение диаграммы Fe—Fe3c.
- •Лекция 7 общие положения термической обработки
- •Лекция 8 практика термической обработки углеродистой стали
- •Влияние углерода на твердость термически обработанных сталей
- •Определение прокаливаемости стали
- •Лекция 9 химико – термическая обработка: цементация стали
- •Лекция 10 Маркировка и применение легированных сталей Введение
- •Классификация легированных сталей
- •II. Классификация по содержанию углерода:
- •III. Классификация по содержанию легирующих элементов:
- •Маркировка легированных сталей
- •Применение легированных сталей
- •Лекция 11 Маркировка Цветных металлов и сплавов Введение
- •Медь и ее свойства
- •Сплавы на основе меди
- •Алюминий и его сплавы
- •Подшипниковые сплавы
- •Лекция 12 композиционные материалы
- •Классификация композиционных материалов и перспективы развития
- •Металлические композиционные материалы
Лекция № 4 строение сплавов. Диаграммы состояния двойных сплавов.
Диаграмма состояния - это графическое изображение состояния сплавов изучаемой системы в зависимости от их химического состава и температуры.
Диаграммы состояния показывают устойчивые, равновесные, состояния сплавов, т.е такие, которые при данных условиях обладают минимальной свободной энергией. Поэтому их называют также и диаграммами фазового равновесия. Зная диаграмму состояния, можно представить полную картину формирования структуры любого сплава, определить температуры литья и обработки давлением, установить возможность проведения и режимы термической обработки металлоизделий.
Закономерности всех изменений в многофазной системе подчиняются правилу фаз Гиббса. Оно дает возможность предсказать и проверить процессы, происходящие в сплавах при нагреве V. охлаждении; показывает, происходит ли кристаллизация при постоянной температуре или в определенном температурном интервале, указывает, какое количество фаз может одновременно находиться в равновесии. Правило фаз устанавливает следующую зависимость между числом степеней свободы С ( вариантностью) системы, числом компонентов К и числом фаз Ф , находящихся в равновесии:
С=К-Ф+2
Числом степеней свободы С называется число независимых внешних и внутренних факторов С температура, давление, концентрация), которые можно изменять, не изменяя числа фаз, находящихся в равновесии.
При построении диаграмм состояния металлических сплавов давление принимают постоянным, тогда:
С=К-Ф+1
Диаграммы состояния строят экспериментально, используя наиболее часто термический метод, с помощью которого получают кривые охлаждения отдельных сплавов системы в координатах время-температура. По остановкам и перегибам на этих кривых определяют температуры превращений.
Температуры, соответствующие фазовым превращениям, называются критическими точками.
Точки, отвечающие началу кристаллизации, называются точками ликвидуса, а концу кристаллизации - точками солидуса.
По полученным кривым охлаждения (критическим точкам)строят диаграмму состояния в координатах: по оси абсцисс - концентрация компонентов, по оси ординат - температура.
ДИАГРАММА. СОСТОЯНИЯ СПЛАВОВ С НЕОГРАНИЧЕННОЙ РАСТВОРИМОСТЬЮ КОМПОНЕНТОВ В ТВЕРДОМ СОСТОЯНИИ

Полная взаимная растворимость в твердом состоянии возможна лишь для металлов с однотипными (изоморфными) и близкими по периодам кристаллическими решетками, образующих при сплавлении непрерывный ряд твердых растворов замещения. Соответствующая этому случаю диаграмма представлена на рис. I.
Имеем: компоненты А ( например, Сu ) и В (например, Ni); фазы - жидкий раствор Ж и твердый раствор б.
Поле диаграммы разделено на три области фазового состояния, разделяемые линиями tACtB и tADtB. Линия tACtb представляет собой геометрическое место то ликвидус и называется линией ликвидуса.
Выше этой линии все сплавы находятся в жидком состоянии. Линия tADtB - геометрическое место точек солидус - называется линией солидуса, ниже которой все сплавы находятся в твердом состоянии. Область между этими линиями соответствует равновесию жидкости и кристаллов твердой фазы.
Вначале получают кривые охлаждения для чистых компонентов, а затем для сплавов различного состава.
Кривая I получена при охлаждении компонента А ( Сu ). Выше температуры tА (для меди - 1086°С ) металл находится в жидком состоянии. Кристаллизация начинается при этой температуре через промежуток времени ф1 и заканчивается в момент ф2 . Согласно правилу фаз, имеем: компонент I ( металл А ), фазы 2 ( жидкий металл и кристаллы А ), следовательно,
С = К - Ф + 1 = 1 - 2 + 1= 0,
т.е. кристаллизация должна происходить при постоянной температуре. Ниже температуры tA происходит только охлаждение образовавшихся кристаллов компонента А. Аналогичные процессы происходят и при охлаждении компонента B.
Сплав II, содержащий, например, 60 % компонента B ( Ni ) и 40 % компонента A ( Сu ) выше температуры t1 ( точка l1 на линии ликвидуса ) находится в состоянии однородного жидкого раствора. При этой температуре жидкий раствор становится насыщенным по отношению к б-фазе и начинается кристаллизация, сопровождающаяся уменьшением скорости охлаждения. В интервале температур t1-t2 находятся две фазы: насыщенные жидкий и твердый растворы. Поскольку в данном случае количество компонентов К = 2, то С = 2 - 2+1 = 1, из чего следует, что кристаллизация сплава должна происходить в интервале температур. В этом состоит существенное отличие процесса кристаллизации двухкомпонентных сплавов от процесса кристаллизации чистых компонентов, происходящего при постоянной температуре.
При температуре t2 ( точка S2 на линии солидуса ) кристаллизация сплава заканчивается, и ниже ее никаких превращений не происходит.
Аналогичные процессы происходят и при охлаждении всех других сплавов, образованных компонентами А и В.
Следует усвоить, что в процессе кристаллизации изменяются химический состав (концентрация) фаз и количество каждой фазы. Пользуясь диаграммой состояния, можно в той области диаграммы, где существует две фазы, определить их состав и относительные количества при любой температуре. Для этого необходима использовать правила отрезков.
Первое правило отрезков применяют для определения состава фаз. Так, например, для того, чтобы в сплаве 2 (рис. I) определить составы жидкой и твердой фазы при температуре Ь черв» точку К характеризующую состояние сплава при этой температуре, надо пролети горизонтальную линию - коноду до пересечения с линями, ограничивающими данную двухфазную область. Проекция точки пересечения коноды с линией ликвидус l на ось концентраций – точка I - показывает состав жидкой фазы, а проекция точки пересечения S к он оды с линией солидус на эту ось - точка S` состав твердой фазы.
Из рис. I видно, что состав первых кристаллов твердого раствора б, образовавшихся при температуре t1 , отвечает точке S`1 , а последних г при температуре t2 - точке S`2 , т.е. вменяется в соответствии с линией солидус на участке l1- l2. Состав жидкой фазы изменяется при этом от l1- в начале кристаллизации до l2. в конце, т.е. в соответствии с линией ликвидус на участке l1- l2.
Это может быть записано в виде:
![]()
![]()
![]()
Индексы при буквах указывают состав твердой и жидкой фаз соответственно при заданной температуре .
ДИАГРАММА. СОСТОЯНИЯ СПЛАВОВ С ОГРАНИЧЕННОЙ РАСТВОРИМОСТЬЮ КОМПОНЕНТОВ В ТВЕРДОМ СОСТОЯНИИ С ЭВТЕКТИКОЙ
Д иаграмма
представлена на рис. 2.
иаграмма
представлена на рис. 2.
Имеем: компоненты А и B, фазы - жидкий раствор Ж, твердые растворы б и в. Оба компонента неограниченно растворимы в жидком состоянии, ограниченно в твердом и не образуют химических соединений.
На приведенной диаграмме tACtB – линия ликвидус, линия tAECFtB – линия солидус.
Твердый раствор б образован на базе компонента А. Область его существования ограничена линией tAES, часть которой ES вертикальна, что указывает на постоянную растворимость компонента и в решетке компонента А во всем интервале температур ниже tэ (в приведенном примере 10 %).
В отличие от этого, состав твердого раствора В, образованного на базе компонента О, при понижении температуры изменяется. Обратите внимание на то, что растворимость компонента А в решетке компонента В максимальна при температуре, т.е. отвечает точке г (в нашем примере 20 % ), и с понижением температуры уменьшается в соответствии с ходом линии FK до 5 %, что отвечает 95 % компонента B).
В отличие от сплавов, лежащих левее линии ES и правее FК , являющихся однофазными, сплавы, лежащие между этими линиями, находятся за пределами растворимости и являются двухфазными, состоящими из кристаллов, образующих разные структуры.
Линия ECF называется линией "эвтектического превращения», которое состоит в одновременном выделении из жидкости кристаллов твердого раствора состава точки F. Запомните, что механическая смесь двух ( или более) разнородных кристаллов, одновременно кристаллизующихся из жидкости, называется эвтектикой. Эвтектическую реакцию можно записать в следующем виде:
![]()
(реакция нонваривнтая) :
С = К – Ф + 1 = 2-3+1 = 0.
Следует усвоить, что количества каждой из фаз в эвтектической смеси могут быть определены с помощью второго правила отрезков:
![]()
Сплав I называется эвтектическим ( наиболее легкоплавким ). Сплавы, лежащие левее точки С , называются доэвтектичеокими ,а правее заэвтектическими.
При температурах выше tЭ эвтектический сплав находится в жидком состоянии, а при достижении этой температуры вся его масса претерпевает эвтектическое превращение по описанной выше . схеме. Обратите внимание, что на кривой охлаждения ( рис. 2 ) этому превращению отвечает температурная остановка ( т.к.C=О), длительность которой определяется массой кристаллизующейся жидкости. Последующее охлаждение сплава продолжается только после . полного завершения эвтектической реакции. Конечная структура сплава - пластинчатая эвтектика ( может быть и другое ее строение ) изображена на рис. 2.
В отличие от сплава | ,в заэвтекгическом сплаве || эвтектическому превращению предшествует выделение из жидкого раствора в интервале точек 1-2 кристаллов в , обогащенных компонентом О , в результате чего жидкая фаза обедняется этим компонентом.
Уясните, что при охлаждении до эвтектической температуры ( точка 2 ) состав кристаллов в изменяется в соответствии с линией МF , а жидкости - в соответствии с линией 1C . При достижении этой температуры количество первичных кристаллов ft состава точки F определяется отрезком С2 , а количество оставшейся жидкости состава точки С - отрезком 2F. Эго количество жидкости, составляющее часть массы сплава ( а не всю массу, как в сплаве I ),при температуре точки 2 превращается в эвтектику (б+в).
При дальнейшем охлаждении сплава II вследствие, уменьшения растворимости компонента A в решетке компонента B по линии FK будет происходить распад твердого раствора в с выделением в этой фазе вторичных кристаллов б состава точки S. (Необходимо уяснить, что это относится как к в-фазе, выделившейся из жидкости выше линии ECF, так и к находящейся в эвтектике).
Конечная структура сплава II в+эвтектика (б+.в)+б||
В сплаве ||| первичная кристаллизация, происходящая в интервале температур между точками 4 и 5 , сопровождается изменением состава твердой фазы по линии L5 , а жидкой - по линии 4N . Она заканчивается образованием в - твердого раствора", состав которого соответствует составу сплава. Такая однофазная структура сохраняется до температуры точки 6 . . •
При охлаждении сплава ||| ниже точки 6 , по мере уменьшения концентрации в твердом растворе в , избыточное количество компонента А выделяется из этой фазы в виде кристаллов б||. состава точки S, как и в предыдущем случае. Таким образом, конечная структура рассматриваемого сплава - кристаллы В -твердого раствора с выделениями в них вторичных кристаллов б||.
Кристаллизация доэвтектических сплавов (т.е. лежащих между точками E и C ) начинается на линии tAC выделением из жидкости кристаллов б-твердого раствора. При температуре tЭ остаток жидкости превращается в эвтектику (б+в),и конечная их структура состоит из этой эвтектики, количество которой тем больше, чем ближе состав сплава к эвтектическому, и кристаллов б -твердого раствора без выделений вторичных кристаллов.
Заканчивая изучение диаграммы, обратите внимание на го, что при одинаковом фазовом составе сплавов в диапазоне концентраций от точки 5 до точки К (б и в -твердые растворы ) их конечные структуры различны, чем определяется различие их свойств.
Уясните также, что протяженность областей существования твердых растворов б и в зависит от взаимной растворимости компонентов А и В . При полном отсутствии растворимости эти области отсутствуют и диаграмма имеет вид, изображенный на рис. 3.
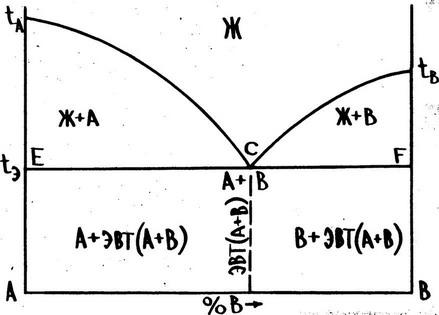
Рис.3
