
- •Министерство образования и науки украины
- •Атомно - молекулярное учение. Основные понятия и законы химии.
- •Расчет относительных молекулярных и молярных масс веществ
- •Расчеты эквивалентов и молярных масс эквивалентов элементов
- •Стехиометрические расчеты по химическим уравнениям
- •Строение|стройка| атомов и свойства элементов
- •Электронные формулы
- •Правила, на основе|основании| которых|каких| составляют|сдают| электронные формулы
- •Составление|сдает| электронных формул
- •Информативность электронных формул
- •3. Химический характер элемента ( металл, неметалл )
- •4. Состав|склад| и свойства соединений элементов.
- •Х и м и ч е с к а я с в я з ь |с|| и с в о й с т в а в е щ е с т в
- •Типы химических связей:
- •Ковалентная связь.
- •Ионная связь.
- •Металлическая связь.
- •Классификация неорганических соединений
- •Оксиды|оксид|
- •Основные оксиды -
- •Кислотные оксиды -
- •Гидроксиды
- •Основания|основание|
- •Кислоты
- •Амфотерные гидроксиды
- •Средние соли
- •Основные соли
- •Кислые соли
- •Основные закономерности протекания химических реакций
- •Энергетика химических реакций
- •2. Химическая кинетика
- •Факторы, которые|какие| влияют на скорость реакции
- •Температура
- •Правило Вант – Гоффа
- •Концентрация реагентов
- •Химическое равновесие
- •Дисперсные системы и растворы
- •Энергетические явления при растворении.
- •Растворимость
- •Способы выражения концентрации растворов массовые
- •Объемные
- •Свойства разбавленных растворов неелектролитов|
- •Законы Рауля.
- •Растворы электролитов
- •Количественные характеристики процесса диссоциации.
- •Неорганические соединения как электролиты
- •Амфотерные гидроксиды
- •Формы содержания |содержания| воды в веществах
- •Физические свойства воды
- •Вода как электролит
- •Жесткость в о д ы
- •Гидролиз солей
- •Электролитическая диссоциация комплексных соединений
- •Номенклатура комплексных соединений
- •Способы получения комплексных соединений
- •Комплексные соединения в природе и технологии
- •Составление уравнений окислительно - восстановительных реакций методом электронного баланса.
- •Распространение и значение окислительно|окисный| – восстановительных реакций.
- •Э л е к т р о х и м и я
- •Основные понятия электрохимии
- •Г а л ь в а н и ч е с к и е е л е м е н т и –
- •Электрохимический ряд напряжения металлов (стандартные электродные потенциалы при 250с)
- •К о р р оз и я м е т а л л о в
- •Средства борьбы с коррозией.
- •Э л е к т р о л и з
- •Применение электролиза:
- •Министерство образования и науки украины
- •Атомно - молекулярное учение. Основные понятия и законы химии.
- •Расчет относительных молекулярных и молярных масс веществ
- •Расчеты эквивалентов и молярных масс эквивалентов элементов
- •Стехиометрические расчеты по химическим уравнениям
- •Строение|стройка| атомов и свойства элементов
- •Электронные формулы
- •Правила, на основе|основании| которых|каких| составляют|сдают| электронные формулы
- •Составление|сдает| электронных формул
- •Информативность электронных формул
- •3. Химический характер элемента ( металл, неметалл )
- •4. Состав|склад| и свойства соединений элементов.
- •Х и м и ч е с к а я с в я з ь |с|| и с в о й с т в а в е щ е с т в
- •Типы химических связей:
- •Ковалентная связь.
- •Ионная связь.
- •Металлическая связь.
- •Классификация неорганических соединений
- •Оксиды|оксид|
- •Основные оксиды -
- •Кислотные оксиды -
- •Гидроксиды
- •Основания|основание|
- •Кислоты
- •Амфотерные гидроксиды
- •Средние соли
- •Основные соли
- •Кислые соли
- •Основные закономерности протекания химических реакций
- •Энергетика химических реакций
- •2. Химическая кинетика
- •Факторы, которые|какие| влияют на скорость реакции
- •Температура
- •Правило Вант – Гоффа
- •Концентрация реагентов
- •Химическое равновесие
- •Дисперсные системы и растворы
- •Энергетические явления при растворении.
- •Растворимость
- •Способы выражения концентрации растворов массовые
- •Объемные
- •Свойства разбавленных растворов неелектролитов|
- •Законы Рауля.
- •Растворы электролитов
- •Количественные характеристики процесса диссоциации.
- •Неорганические соединения как электролиты
- •Амфотерные гидроксиды
- •Формы содержания |содержания| воды в веществах
- •Физические свойства воды
- •Вода как электролит
- •Жесткость в о д ы
- •Гидролиз солей
- •Электролитическая диссоциация комплексных соединений
- •Номенклатура комплексных соединений
- •Способы получения комплексных соединений
- •Комплексные соединения в природе и технологии
- •Составление уравнений окислительно - восстановительных реакций методом электронного баланса.
- •Распространение и значение окислительно|окисный| – восстановительных реакций.
- •Э л е к т р о х и м и я
- •Основные понятия электрохимии
- •Г а л ь в а н и ч е с к и е е л е м е н т и –
- •Электрохимический ряд напряжения металлов (стандартные электродные потенциалы при 250с)
- •К о р р оз и я м е т а л л о в
- •Средства борьбы с коррозией.
- •Э л е к т р о л и з
- •Применение электролиза:
- •Атомно - молекулярное учение. Основные понятия и законы химии.
- •Расчет относительных молекулярных и молярных масс веществ
- •Расчеты эквивалентов и молярных масс эквивалентов элементов
- •Стехиометрические расчеты по химическим уравнениям
- •Строение|стройка| атомов и свойства элементов
- •Электронные формулы
- •Правила, на основе|основании| которых|каких| составляют|сдают| электронные формулы
- •Составление|сдает| электронных формул
- •Информативность электронных формул
- •3. Химический характер элемента ( металл, неметалл )
- •4. Состав|склад| и свойства соединений элементов.
- •Х и м и ч е с к а я с в я з ь |с|| и с в о й с т в а в е щ е с т в
- •Типы химических связей:
- •Ковалентная связь.
- •Ионная связь.
- •Металлическая связь.
- •Классификация неорганических соединений
- •Оксиды|оксид|
- •Основные оксиды -
- •Кислотные оксиды -
- •Гидроксиды
- •Основания|основание|
- •Кислоты
- •Амфотерные гидроксиды
- •Средние соли
- •Основные соли
- •Кислые соли
- •Основные закономерности протекания химических реакций
- •Энергетика химических реакций
- •2. Химическая кинетика
- •Факторы, которые|какие| влияют на скорость реакции
- •Температура
- •Правило Вант – Гоффа
- •Концентрация реагентов
- •Химическое равновесие
- •Дисперсные системы и растворы
- •Энергетические явления при растворении.
- •Растворимость
- •Способы выражения концентрации растворов массовые
- •Объемные
- •Свойства разбавленных растворов неелектролитов|
- •Законы Рауля.
- •Растворы электролитов
- •Количественные характеристики процесса диссоциации.
- •Неорганические соединения как электролиты
- •Амфотерные гидроксиды
- •Формы содержания |содержания| воды в веществах
- •Физические свойства воды
- •Вода как электролит
- •Жесткость в о д ы
- •Гидролиз солей
- •Электролитическая диссоциация комплексных соединений
- •Номенклатура комплексных соединений
- •Способы получения комплексных соединений
- •Комплексные соединения в природе и технологии
- •Составление уравнений окислительно - восстановительных реакций методом электронного баланса.
- •Распространение и значение окислительно|окисный| – восстановительных реакций.
- •Э л е к т р о х и м и я
- •Основные понятия электрохимии
- •Г а л ь в а н и ч е с к и е е л е м е н т и –
- •Электрохимический ряд напряжения металлов (стандартные электродные потенциалы при 250с)
- •К о р р оз и я м е т а л л о в
- •Средства борьбы с коррозией.
- •Э л е к т р о л и з
- •Применение электролиза:
- •Министерство образования и науки украины
- •Атомно - молекулярное учение. Основные понятия и законы химии.
- •Расчет относительных молекулярных и молярных масс веществ
- •Расчеты эквивалентов и молярных масс эквивалентов элементов
- •Стехиометрические расчеты по химическим уравнениям
- •Строение|стройка| атомов и свойства элементов
- •Электронные формулы
- •Правила, на основе|основании| которых|каких| составляют|сдают| электронные формулы
- •Составление|сдает| электронных формул
- •Информативность электронных формул
- •3. Химический характер элемента ( металл, неметалл )
- •4. Состав|склад| и свойства соединений элементов.
- •Х и м и ч е с к а я с в я з ь |с|| и с в о й с т в а в е щ е с т в
- •Типы химических связей:
- •Ковалентная связь.
- •Ионная связь.
- •Металлическая связь.
- •Классификация неорганических соединений
- •Оксиды|оксид|
- •Основные оксиды -
- •Кислотные оксиды -
- •Гидроксиды
- •Основания|основание|
- •Кислоты
- •Амфотерные гидроксиды
- •Средние соли
- •Основные соли
- •Кислые соли
- •Основные закономерности протекания химических реакций
- •Энергетика химических реакций
- •2. Химическая кинетика
- •Факторы, которые|какие| влияют на скорость реакции
- •Температура
- •Правило Вант – Гоффа
- •Концентрация реагентов
- •Химическое равновесие
- •Дисперсные системы и растворы
- •Энергетические явления при растворении.
- •Растворимость
- •Способы выражения концентрации растворов массовые
- •Объемные
- •Свойства разбавленных растворов неелектролитов|
- •Законы Рауля.
- •Растворы электролитов
- •Количественные характеристики процесса диссоциации.
- •Неорганические соединения как электролиты
- •Амфотерные гидроксиды
- •Формы содержания |содержания| воды в веществах
- •Физические свойства воды
- •Вода как электролит
- •Жесткость в о д ы
- •Гидролиз солей
- •Электролитическая диссоциация комплексных соединений
- •Номенклатура комплексных соединений
- •Способы получения комплексных соединений
- •Комплексные соединения в природе и технологии
- •Составление уравнений окислительно - восстановительных реакций методом электронного баланса.
- •Распространение и значение окислительно|окисный| – восстановительных реакций.
- •Э л е к т р о х и м и я
- •Основные понятия электрохимии
- •Г а л ь в а н и ч е с к и е е л е м е н т и –
- •Электрохимический ряд напряжения металлов (стандартные электродные потенциалы при 250с)
- •К о р р оз и я м е т а л л о в
- •Средства борьбы с коррозией.
- •Э л е к т р о л и з
- •Применение электролиза:
Амфотерные гидроксиды
1. Амфотерные гидроксиды - продукт исключительно непрямой гидратации в результате ионного обмена.
2. Ме(ОН)n n= 2,3,4
3. Ве(ОН)2 – гидроксид берилия, Fe(ОН)3 – гидроксид железа (3)
4. Графическая формула: Н – О – Ве – О – Н
5. Типы связи: Ве – О – преимущественно ионная, О – Н – ковалентная| полярная.
металл неметалл неметалл неметалл
6. Агрегатное состояние|стан|: твердые, аморфные, хрупкие, неустойчивые к|до| повышению температур, теплопроводность средняя, электропроводимость|электропроводность| отсутствует.
7. Химические свойства:
а) отношение к|до| воде: слабо растворимые
Взаимодействие:
б) с оксидами: основными MnO + A1(OН)3 Mn(A1O2)2 + Н2О
основный амфотерный
кислотными SO2 + Zn(OH)2 ZnSO3 + H2O
кислотный амфотерный
амфотерными SnO2 + Pb(OH)2 → PbSnO3 + H2O
амфотерный амфотерный
в) з гидроксидами: щелочами 3NaOH + A1(OH)3 Na 3 A1O3 + 6H2O
кислотами 3H2SO4 + 2Fe(OH)3 Fe2(SO4)3 + 6H2O
амфотерными Be(OH)2 + Ge(OH)4 → BeGeO3 + 3H2O
амфотерный| амфотерный|
г) с солями не реагируют
д) с металлами не реагируют
е) при нагревании раскладываются на оксид и воду: 2Fe(OH)3 → Fe2O3 + 3H2O
8. Способы получения:
непрямая гидратация| в результате|вследствие| ионного обмена:
Fe2(SO4)3 + 6NaOH → 3Na2SO4 + 2Fe(OH)3↓
СОЛИ
Соли : средние, основные, кислые.
Средние соли
1. Средние соли – продукт полного замещения катионов водорода катионами металлов в кислотах, или продукт полного замещения гидроксогрупп основания кислотными остатками.
Fe(OH)2 + 3HCl → FeCl3 + 3H2O
средняя соль
H3PO4 + 3NaOH → Na3PO4 + 3H2O
средняя соль
3. Номенклатура: называют кислотный остаток соответствующей кислоты ( смотри Номенклатуру кислот ), латинское название металла в родительном падеже и степень его окисления (кроме металлов главной|головной| подгруппы I и II групп).
III V II
4. Графические формулы: Al+3 (N+5 O-2 3)3 Al (N O3)3
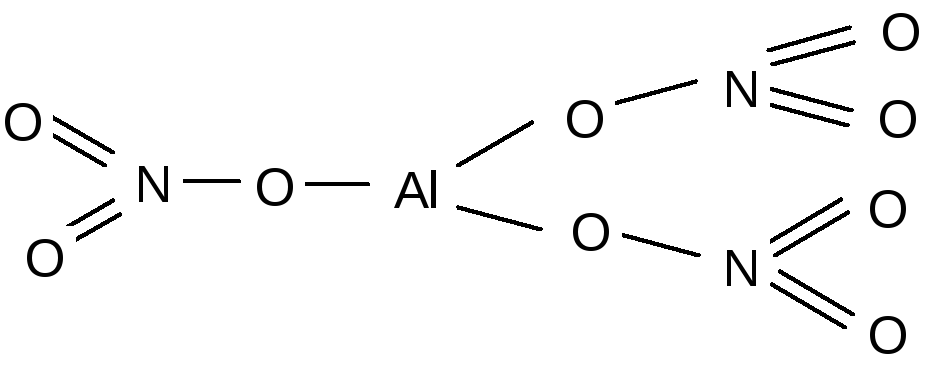
5. Химические связи: Al| - O - преимущественно ионная
металл неметалл
O – N - ковалентная| полярная
неметалл неметалл
6. Физические свойства:
Агрегатное состояние|стан|: твердые, кристаллические, хрупкие, высокие температуры кипения и плавления ( кроме нитратов и карбонатов), не имеют запаха, соединения, которые|какие| содержат d – элементы могут иметь цвет. Теплопроводность средняя. Электропроводимость|электропроводность| отсутствует.
7. Химические свойства:
а) Отношение к|до| воде : растворимые в воде соли ( см. Таблицу растворимости) диссоциируют | по типу сильных электролитов.
Na2SO4 → 2Na+ + SO42-
б) Взаимодействие с |гидроксидами| в растворах:
а) основаниями MgSO4 + 2NaOH Mg(OH)2 ↓ + Na2SO4
б) кислотами Na2CO3 + 2HC1 2NaC1 + H2O + CO2
в) Взаимодействие с солями: в растворах при условиях образования труднорастворимых | соединений
BaC12 + Na2SO4 BaSO4 + 2NaC1
г) Взаимодействие с металлами: в растворах реагируют с металлами, которые|какие| предшествуют в ряде|в ряду| напряжения | металлу, что входит в состав соли
Fe + CuSO4 FeSO4 + Cu
д) Термолиз : подлежат соли летучих кислот
CaCO3 CаO + CO2
Pb(NO3)2 2PbO + 4 NO2 + O2
8. Получение:
а) Взаимодействие металлов с неметаллами:
2Na + S → Na2S
б) Взаимодействие окислов|оксида|:
CaO + CO2 CaCO3
в) Взаимодействие гидроксидов|:
3NaOH + H3PO4 → Na3PO4 + 3H2O
основание|основание| кислота соль
Fe(OH)3 + 3 HNO3 → Fe(NO3)3 + 3H2O
амфот. кислота соль
KOH + Zn(OH)2 → K2ZnO2 + H2O
основание|основание|ние амфот|. соль
г) Взаимодействие солей :
Na2SiO3 + 2HCl → H2SiO3 + 2NaCl
д) Взаимодействие солей с металлами:
FeSO4 + Mg > MgSO4 + Fe
Дополнительную информацию относительно|касательно| разнообразных|многообразных| способов получения солей можно найти в учебниках.
