
Загальна фізика / Теоретичні курси / Конспект лекцій з фізики №1
.2.pdf
2.1.4 Основне рiвняння молекулярно-кiнетичної теорiї
iдеальних газiв
Основне рiвняння молекулярно-кiнетичної теорiї iдеального газу визначає тиск газу
як функцiю швидкостей молекул газу i як функцiю температури. Враховуючи те, що атоми (або молекули) iдеального газу представляють невзаємодiючi кульки, якi абсолютно пружно зiткаються мiж собою та зi стiнками посудини, молекули газу, що зiткаються зi стiнками посудини, утворюють тиск.
При абсолютно пружному зiткненнi
зi стiнкою посудини молекула, яка летить нормально до стiнки, змiнює свiй iмпульс пiсля зiткнення на протилежно спрямований i змiна iмпульсу p0 за модулем дорiвнює
p0 = p02 − p01 = |
(120) |
|
|
= m0 v − (−m0 v) = 2 m0 v , |
|
||
де m0 i v вiдповiдно маса та швидкiсть мо- |
|
||
лекули. |
|
|
|
За час t до площадки |
S можуть дiста- |
|
|
тися молекули, що знаходяться в об’ємi S · |
|
||
v · t (рис. 23), i, кiлькiсть N яких пропор- |
|
||
цiйна концентрацiї n = N/V молекул, та |
|
||
дорiвнює |
|
|
|
N = n · S · v · |
t . |
(121) |
Рис. № 23: |
Але тiльки третина молекул вiд загальної кiлькостi N молекул дiстанеться площадки S, бо треба враховувати лише тi молекули, якi рухаються в напрямку, який є перпендикулярним до площадки S. Крiм того, кiлькiсть молекул ще зменшиться вдвiчi, бо треба враховувати лише тi молекули, якi рухаються в бiк до площадки S, а не вiд неї. Тобто, кiлькiсть N ′ молекул, якi створюють тиск на площадку S, є
N ′ = |
1 |
(122) |
6 n · S · v · t . |
31

Звiдки змiна iмпульсу p, молекул, якi створюють тиск, дорiвнює
p = N ′ · p0 = |
1 |
n · |
S · v · |
t · 2 · m0 |
· v |
||
|
|||||||
6 |
|||||||
p = |
1 |
n · m0 |
· v2 · S · |
t . |
(123) |
||
|
|||||||
3 |
|||||||
Згiдно з другим законом Ньютона змiна iмпульсу тiла дорiвнює iмпульсу сили F , що дiє на тiло
|
|
|
|
|
|
|
p |
(124) |
|
p = F · |
t . |
|
F = |
|
. |
||||
t |
|||||||||
Виходячи з визначення тиску (P = F/ |
S), знайдемо тиск, що створюють |
||||||||
молекули iдеального газу на обрану площадку S |
|
|
|
||||||
P = |
|
F |
= |
|
p |
. |
|
|
(125) |
|
S |
|
|
|
|
||||
|
|
|
|
t · S |
|
|
|
||
Враховуючи (124), вираз (125) перепишемо наступним чином |
|
||||||||
P = (1/3) n m0 v2 . |
|
|
(126) |
||||||
Але кожна з усiх N молекул iдеального газу рухається зi своєю швидкiстю vi (i = 1, 2, ··· N ). Тому введемо середню квадратичну швидкiсть молекул
|
|
>= v |
|
|
|
|
< v |
кв |
1 N |
v2 . |
(127) |
||
|
u |
|
i |
|
||
|
|
u N i=1 |
|
|
|
|
|
|
u |
X |
|
|
|
t
Звiдки отримаємо головне рiвняння молекулярно-кiнетичної теорiї
iдеального газу |
|
p = (1/3) n m0 < vкв >2 . |
(128) |
Звiдки |
|
p V = (1/3) N m0 < vкв >2= |
|
= (1/3) m < vкв >2 , |
(129) |
де враховано що n = N/V i N m0 = m (m – маса газу, який займає об’єм V ). Головне рiвняння (128) можна представити у виглядi
|
p V = (1/3) N m0 < vкв >2= |
|
||||
|
N m0 |
< vкв >2 |
m < vкв >2 |
(130) |
||
(2/3) |
|
|
= (2/3) |
|
, |
|
|
2 |
2 |
||||
|
|
|
|
|
||
або |
|
|
|
|
|
|
|
|
p V = (2/3) E , |
|
|
(131) |
|
32

|
m < vкв >2 |
|
||
де |
|
= E. Для одного моля газу ν = 1 i m = M рiвняння (130) i |
||
2 |
||||
|
|
|
||
(130) змiниться на |
|
|||
|
|
p Vm = (1/3) M < vкв >2 |
(132) |
|
i |
|
|
|
|
|
|
p Vm = (2/3)Em Em = (3/2)p Vm . |
(133) |
|
Згiдно з законом Менделеєва-Клайперона для одного моля газу (ν = 1, m = M ; p Vm = R T ). Порiвнюючи рiвняння Менделеєва-Клайперона для одного моля (119) i рiвняння (132) з однаковими лiвими частинами, маємо
R T = (1/3) M < vкв >2 . |
(134) |
Тобто, термодiнамiчна температура газу є функцiєю швидкостi молекул газу (чим вища швидкiсть молекул, тим вища термодинамiчна температура газу). Враховуючи те, що стала Больцмана дорiвнює k = R/NA, отримаємо
< vкв >= v |
|
|
|
= v |
|
|
|
= v |
|
|
|
|
|
3RT |
|
|
|
|
3kT . |
(135) |
|||||
|
|
3RT |
|
|||||||||
u |
|
M |
u |
|
|
u |
|
|
|
|
||
u |
|
u m0NA |
u m |
|
||||||||
t |
|
|
|
t |
|
|
t |
|
|
|
|
|
Середня кiнетична енергiя < ε0 > поступального руху однiєї молекули iдеального газу дорiвнює
< ε0 >= |
E |
= |
Em |
= |
m0 |
< vкв >2 |
= (3/2) |
R T |
= (3/2) k T . |
(136) |
N |
|
|
2 |
|
||||||
|
|
NA |
|
NA |
|
|||||
Тобто, енергiя однiєї молекули залежить лiнiйно вiд термодинамiчної температури
< ε0 >= |
3 |
k T . |
(137) |
|
2 |
||||
|
|
|
2.1.5Функцiя розподiлу Максвела
Функцiя розподiлу Максвела (рис. 24) молекул iдеального газу за швидкостями
|
|
f (v) = |
dN (v) |
, |
(138) |
|
|
N dv |
|||
|
|
|
|
|
|
або |
|
|
|
|
|
|
dN (v) |
= f (v) dv = dS |
|
|
(139) |
|
N |
|
|
||
|
|
|
|
|
|
дозволяє обчислити вiдносну кiлькiсть молекул dN (v)/N , швидкостi яких лежать в iнтервалi швидкостей вiд v до v + dv, як площу заштрихованої трапецiї шириною dv пiд кривою f (v) (рис. 24).
33

Застосувавши методи теорiї ймовiрностей, Максвел знайшов вираз функцiї розподiлу f (v) молекул iдеального газу за швидкостями
f (ν) = 4πv |
|
|
|
|
|
m0v2/(2k T ) , |
|
m0 |
! |
3 v2 exp |
|||
u |
|
|
|
h− |
i |
|
u |
|
2π k T |
|
|
||
t |
|
|
|
|
|
|
(140) за допомогою якої була обчислена середня швидкiсть < v >, середня квадратична швидкiсть < vкв > та найвiрогiднiша швидкiсть viм i знайшов спiввiдношення мiж ними
q q
viм = 2RT /M ; < v >= 8RT /(π M ) = 1.13viм , i
< vкв >= 1, 22 viм. |
(141) |
2.1.6Барометрична формула
Барометрична формула враховує те, що молекули газу, коли розглядаються великi об’єми газу, знаходяться у потенцiальному полi тяжiння Землi i, тому, є (рис. 25) залежнiсть тиску газу вiд його висоти h над поверхнею Землi.
Якщо тиск газу на висотi h над рiвнем землi дорiвнює p, то на висотi h+dh тиск повинен дорiвнювати p−dp (тиск зменшується зi збiльшенням висоти).
Рiзниця тискiв p на висотах h i h + dh дорiвнює
p = p − (p − dp) = dp . |
(142) |
Згiдно з законами гiдростатики рiзниця тискiв повинна дорiвнювати вазi маси газу, яка знаходится в об’ємi з висотою dh i площею 1 м2. Тобто
dp = −ρ g dh , |
(143) |
де ρ i g вiдповiдно густина газу i прискорення вiльного падiння. Знак ” – ” у виразi (143) вiдповiдає тому, що зi зростанням dh тиск dp зменшується.
34
Густину газу ρ знайдемо з рiвняння Менделеєва-
Клайперона |
|
|
|
|
|
||
|
m |
|
|
m |
|
p M |
|
p V = |
|
R T |
ρ = |
|
= |
|
. |
M |
V |
R T |
|||||
|
|
|
|
|
|
(144) |
|
Пiсля пiдстановки (144) у вираз (143) отримаємо диференцiальне рiвняння для знаходження тиску
|
M g |
|
|
|
|
|
|
|
dp |
|
M g |
|||
dp = − |
|
|
pdh |
|
|
|
|
= |
|
dh . |
||||
R T |
|
p |
R T |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
(145) |
|
Проiнтегруємо рiвняння (145) |
|
|
|
|||||||||||
|
p2 dp |
|
M g h2 |
|
|
|
|
|
|
|||||
|
Z |
|
|
|
= − |
|
Z |
dh . |
|
(146) |
||||
|
|
p |
R T |
|
||||||||||
|
p1 |
|
|
h1 |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Пiсля iнтегрування рiвняння (146)отримаємо залежнiсть тиску вiд висоти
ln |
p2 |
= − |
M g |
(h2 |
− h1) p2 |
= p1e−M g(h2−h1)/(R T ) . |
(147) |
p1 |
R T |
Вираз (147) називається барометричною формулою. Якщо за нульову висоту (h1 = 0) приймається рiвень моря, на якому тиск дорiвнює нормальному тиску (p1 = p0), барометрична формула (147) запишеться у виглядi
p = p0 e−M g h/(R T ) , |
(148) |
де p – тиск газу на висотi (h). Прилади, що побудованi за принципом вимiрювання висоти над рiвнем моря за вимiрюванням тиску, мають назву альтиметри або барометрiв висотомирiв.
Враховуючи те, що p = nkT (головне рiвняння молекулярно-кiнетичної теорiї iдеальних газiв) та R = k NA, а також те, що M = m0 NA, вираз (148) буде мати вигляд
n = n0 e−M g h/(R T ) або n = n0 e−m0 g h/(k T ) n = n0 e−Π/(k T ) ,
(149) де n0 i n вiдповiдно концетрацiя газу на нульовiй висотi i висотi h. Вираз (149) має назву розподiл Больцмана.
2.1.7 Середнi значення числа зiткнень та довжини пробiгу
молекул газу
35
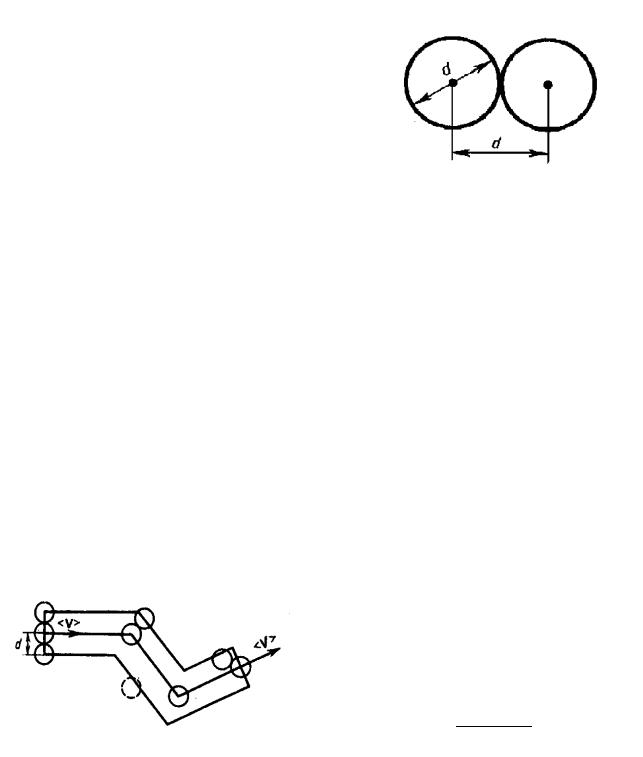
Середнi значення числа зiткнень < z > та довжина вiльного пробiгу < l > молекул газу залежать вiд концетрацiї газу n, середньої швидкостi < v > молекул i вiд розмiру (дiаметру d) молекул. Молекули газу, якi знаходяться у хаотичному русi, неперервно зiткаються одна з однiєю. Мiж двома послiдовними зiткненнями молекули проходять деякий шлях l, який називається довжиною вiльного пробiгу.
Враховуючи те, що рiзнi молекули мiж
двома послiдовними зiткненнями проходять рiзнi шляхи l, вводиться поняття
середньої довжини вiльного пробiгу < l > молекули.
Мiнiмальна вiдстань, до якої зближуються при зiткненнi центри двох молекул, називається ефективний дiаметр молекули d (рис. 26 ).
Середня довжина вiльного пробiгу < l > можна визначити за формулою
< l >= |
< v > |
, |
(150) |
|
< z > |
||||
|
|
|
де < v > i < z > вiдповiдно середня арифметична швидкiсть молекул i середнє число зiткнень, яке випробовує одна молекула газу за 1 с. Середнє число зiткнеь за 1 с дорiвнює кiлькостi молекул, що знаходяться в об’ємi ”ломаного” цилiндра (рис. 27)
< z >= n V , |
(151) |
де n – коцентрацiя молекул газу i V = 4 π d2 < v > (< v > – середня швидкiсть молекул або шлях, який прходить молекула за 1 с). Тобто
< z >= n π d2 < v > . |
(152) |
З урахуванням руху iнших сусiднiх молекул величини < z > та < l > змiню- |
|||||||||||||
ються в |
√ |
|
раз i дорiвнюють |
|
|
|
|
|
|
|
|
||
2 |
|
|
|
|
|
|
|
|
|||||
|
|
|
√ |
|
|
2 |
|
1 |
|
(153) |
|||
|
|
|
|
|
|||||||||
|
|
|
< z >= 2 πd |
|
< v > |
< l >= |
√ |
|
π d2n |
. |
|||
|
|
|
|
2 |
|||||||||
|
|
|
Рис. № 27: |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
2.2 |
Основи термодинамiки |
|
||||
|
|
|
|
|
|
|
2.2.1 |
Внутрiшня енергiя газу |
|
||||
Внутрiшня енергiя iдеального газу U – енергiя хаотичного (теплового)
36
руху мiкрочастинок системи (атомiв, молекул газу).
Внутрiшня енергiя iдеального газу U – однозначна функцiя термодинамiчного стану системи (тобто, в кожному станi система характеризується достатньо визначеною внутрiшньою енергiєю), незалежно вiд того, як параметри системи змiнилися, якi характеризують стан системи в даний час.
”Перехiд” системи з одного стану в iнший визначається лише рiзницею значень внутрiшнiх енергiй системи в цих станах (U2−U1) i не залежить вiд ”форми шляху” переходу системи.
У термодинамiцi вводиться поняття
кiлькiсть ступенiв свободи атомiв, молекул, або частинок iдеального газу – це мiнiмальна кiлькiсть незалежних координат, за допомогою яких стає можливим повний опис змiни енергiї атомiв або молекул iдеального газу при змiнi їх положення у просторi, якщо атоми здiйснюють поступальнi, обертальнi та коливальнi рухи.
Для одноатомного газу iснує лише три ступенi свободи, якi пов’язанi з поступальним рухом атома вiдносно трьох осей декартової системи коорди-
нат. Тому, iодн.ат. = 3 (обертальний рух не змiнює положення атома у просторi
i не змiнює його енергiю).
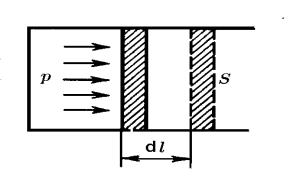
Для двоатомного газу iснує три ступенi свободи, якi необхiднi для опису поступального руху та двi ступенi свободи для опису обертального руху двоатомної молекули вiдносно двох вi-
сей обертання (рис. 28 б). Тому, iдв.ат. = 3 + 2 = 5 (обертання двоатомної моле-
кули вiдносно третьої осi не приводить до додаткової змiни енергiї при змiнi положення молекули у просторi порiв-
Рис. № 28: |
няно з тим, що описують обертання мо- |
|
37
лекули вiдносно двох перших осей). Для триатомного газу iснує три
ступенi свободи, якi необхiднi для опису поступального руху та три ступенi вiльностi для опису обертального руху триатомної молекули вiдносно трьох
осей обертання (рис. 28 в). Тому, iтр.ат. = 3 + 3 = 6.
Для опису коливань атомiв, наприклад, двоатомної молекули необхiдно ввести додатковi ступенi свободи, якi вiдповiдають змiнi потенцiальної та кi-
нетичної енергiї молекул. Тому, iдв.ат. = 3 + 2 + 2iкол..
Взагалi ж кiлькiсть ступенiв свободи молекул визначається за формулою
i = iпост. + iоберт. + 2iкол. . |
(154) |
Слiд, однак, зауважити, що ступенi свободи, якi пов’язанi з коливаннями атомiв, необхiдно враховувати лише при досить високих температурах (T ≥ 103 К).
У класичнiй статистичнiй фiзицi iснує закон Больцмана, який свiдчить про рiвномiрний розподiл енергiї по ступенях свободи молекул, згiдно з яким для системи, яка знаходиться у станi термодинамiчної рiвноваги (з незмiнними тиском, об’ємом та масою), на кожну поступальну, обертальну та коливальну ступiнь свободи припадає енергiя, що дорiвнює k T /2. Тобто, як i було отримано ранiше (137), середня енергiя ε0 однiєї молекули газу (i = 3) дорiвнює
< ε0 >= |
3 |
k T = |
i |
k T . |
(155) |
2 |
|
||||
|
2 |
|
|
||
Для одного моля (ν = 1) i довiльної маси m iдеального газу внутрiшнi енергiї Um та Um вiдповiдно дорiвнюють
Um = |
i |
k T NA = |
i |
R T, |
U = |
m |
|
i |
R T = ν |
i |
R T. |
(156) |
|
|
M 2 |
|
|||||||||
2 |
2 |
|
|
2 |
|
|
||||||
2.2.2Робота газу проти зовнiшнiх сил
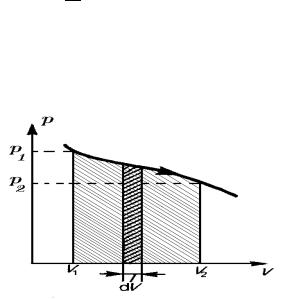
Робота газу δA проти зовнiшних сил F при змiнi його об’єму dV = S dl
дорiвнює (рис. 29)
→ →
δA = F dl = p S dl = p dV
V2 |
|
|
A = Z |
p dV, |
(157) |
V1 |
|
|
38
де p = FS , S, i l – вiдповiдно тиск, площа поршня та довжина, на яку змiщується поршень при змiнi об’єму газу при виконаннi ним роботи.
Графiчно елементарну роботу газу проти зовнiшнiх сил δA можна представити заштрихованою площею вузької смуги пiд кривою p = f (V ), що має ширину dV , яка зображена в координатах p − V на рис. 30. Повну роботу A, яку виконує газ при збiльшеннi об’єму вiд V1 до V2, при якому тиск змiнюється вiд значення p1 до p2, вiдображають у виглядi заштрихованої фiгури пiд кривою p = f (V ) в iнтервалi об’ємiв V1 - V2 (рис. 30).
2.2.3Рiвняння першого начала термодинамiки
Теплота Q, яка надається термодинамiчнiй системi (газу), витрачається на змiну внутрiшньої енергiї U = U2 − U1 системи i на здiйснення системою роботи A проти зовнiшних сил. У диференцiальнiй формi рiвняння першого начала термодинамiки має вигляд
δQ = dU + δA , |
(158) |
де δQ i δA вiдповiдно нескiнченно малi кiлькiсть теплоти та робота, яку виконує газ.
2.2.4Теплоємнiсть iдеального газу
Питома c та молярна Cm теплоємностi iдеального газу вiдповiдно дорiвнюють кiлькостi теплоти δQ, яка змiнює температуру одиницю маси,
або маси одного моля газу на 1 К |
|
|
|
|
|
|||
c = |
δQ |
. Cm = |
1 δQ |
Cm = cM . |
(159) |
|||
|
|
|
|
|||||
m dT |
ν dT |
|||||||
|
|
|
|
|||||
Теплоємнiсть одного моля газу при постiйному об’ємi CV (dV = 0) визначається з рiвняння першого начала термодинамiки δQm = dUm +
39

p dVm, яке записується для одного моля. Тобто, для iзохоричного процесу δQm = dUm i теплоємнiсть CV дорiвнює
|
dUm |
|
d |
i |
R T ! |
|
i |
|
|
|
|
2 |
|
(160) |
|||||
CV = |
|
= |
|
|
|
= |
|
R . |
|
dT |
|
dT |
2 |
||||||
Теплоємнiсть одного моля газу при постiйному тиску Cp (p =
const) визначається теж з рiвняння першого начала термодинамiки |
|
||||||||||||
|
Cp = |
δQm |
= |
dUm |
+ |
pdVm |
. |
(161) |
|||||
dT |
dT |
|
|
||||||||||
|
|
|
|
|
|
|
dT |
|
|||||
Виходячи з рiвняння Менделеєва-Клайперона (118), знайдемо pdVm |
|
||||||||||||
p Vm = R T |
|
|
|
p dVm = R dT . |
(162) |
||||||||
Звiдки отримаємо |
|
|
|
|
|
|
|
|
|
|
|||
Cp = |
dUm |
+ |
pdVm |
|
= CV + |
R dT |
= CV + R . |
|
|||||
|
|
|
|
||||||||||
|
dT |
dT |
|
|
|
dT |
|
||||||
|
|
|
|
Cp = CV + R |
(163) |
||||||||
Рiвняння (163) має назву рiвняння Майера, з якого виходить, що завжди Cp > CV на величину газової сталої R = 8, 31 мольДж·К.
Вiдношення γ = |
Cp |
залежить лише вiд кiлькостi ступенiв свободи молекули |
||||||
CV |
||||||||
газу |
|
|
|
|
|
|
||
|
|
Cp |
|
i + 2 |
|
|
||
|
|
γ = |
= |
. |
(164) |
|||
|
|
CV |
|
|||||
|
|
|
|
i |
|
|||
2.2.5Робота, що виконує газ при рiзних iзопроцесах
Для iзобаричного процесу (p = const) робота газу проти зовнiшних сил дорiвнює
V2 |
pdV = p (V2 − V1) = |
|
||
A = Z |
|
|||
V1 |
|
|
|
|
= |
|
m |
R (T2 − T1) . |
(165) |
|
|
|||
|
M |
|||
Це є можливим, оскiльки для iзобаричного процесу для постiйної маси газу можна записати два рiвняння Менделеєва-Клайперона
m
p V2 = M R T2
40
