
Загальна фізика / Теоретичні курси / Конспект лекцій з фізики №1
.2.pdf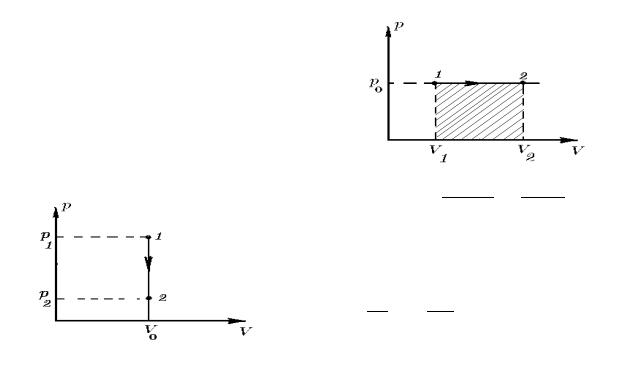
i |
|
m |
|
|
|
p V1 |
= |
R T1. |
(166) |
||
M |
|||||
|
|
|
|
Звiдки, знайшовши рiзницю лiвих та правих частин рiвняннь (166), отримає- |
|||||
мо |
|
|
m |
|
|
|
|
p (V2 − V1) = |
R (T2 − T1) |
||
|
|
|
|||
|
|
M |
|||
або |
|
|
|
|
|
p V = |
m |
R T. |
(167) |
|
|
M |
|
||||
|
|
|
|
|
|
Дiйсно, для iзобаричного процесу (p = p0 = const) робота A дорiвнює площi заштрихованого прямокутника (рис. 31).
Для iзотермiчного процесу (T = |
|
|
const), виходячи з рiвняння (118), за- |
|
|
лежнiсть тиску вiд об’єму має вигляд |
|
|
p = m R T |
= const. |
(168) |
M V |
V |
|
Рис. № 31:
Звiдки, якщо тиск газу змiнюється за законом Бойля-Марiотта, робота, що виконує газ A проти зовнiшних сил, дорiвнює
V2 |
V2 |
A = Z |
pdV = Z |
V1 |
V1 |
m R T dV = M V
|
m |
R T ln |
V2 |
= |
m |
R T ln |
p1 |
. |
(169) |
|
|
M |
V |
M |
|
||||||
Рис. № 32: |
|
|
|
p |
2 |
|
|
|||
|
1 |
|
|
|
|
|
|
|||
|
|
|
|
|
При iзохоричному процесi (V = |
|||||
|
|
|
|
V0 |
= const, dV = 0) газ не виконує |
|||||
|
|
|
|
роботу, бо змiнює свiй об’єм |
|
|||||
|
|
|
|
|
|
|
dA = p dV ≡ 0. |
(170) |
||
|
|
|
|
Дiйсно, площа пiд кривою p |
= f (V ) |
|||||
(рис. 32) при змiнi стану системи вiд точки 1 до 2 дорiвнює нулю.
2.2.6Адiабатичний процес
Адiабатичним називається процес, коли вiдсутнiй теплообмiн газу iз зовнiшнiм середовищем (δQ = 0). Це вiд-
41

бувається, наприклад, при досить швидкiй змiнi тиску, або об’єму газу. Виходячи з рiвняння першого начала термодинамiки δQ = dU +δA, отримуємо, що при адiабатичному процесi виконується спiввiдношення
− dU = δA . |
(171) |
Тобто, враховуючи те, що δA = p dV , вираз (171) перепишемо
p dV = − dU. |
(172) |
Тобто, газ виконує роботу проти зовнiшних сил за рахунок зменшення своєї внутрiшньої енергiї. Якщо вiдома змiна температури газу T при адiабатичному процесi, робота, що виконує один моль газу, дорiвнює
|
|
U2 |
dUm = − (Um2 − Um1 ) = |
|
|
A = − Z |
|
||||
|
|
U1 |
|
|
|
− |
i |
R(T2 − T1) = −CV |
T. |
(173) |
|
|
|||||
2 |
|||||
Для довiльної маси газу m вираз (172) з урахуванням (173) трансформується
в рiвняння |
|
|
|||
|
m |
|
(174) |
||
p dV = − |
|
|
CV |
T, |
|
M |
|||||
з якого знайдемо диференцiал температури dT |
|
||||
dT = − |
M p dV |
. |
(175) |
||
|
|||||
m CV |
|||||
Знайдемо диференцiали вiд лiвої та правої частин рiвняння Менделеєва-Клайперона (диференцiал вiд виразу (118))
d(p V ) = |
m |
R dT, |
V dp + p dV = |
m |
R dT . |
(176) |
|
|
|||||
M |
M |
З другого рiвняння (176) виключимо dT , пiдставивши (175) в (176)
|
mRM pdV |
(177) |
V dp + p dV = − |
M mCV . |
Пiсля скорочень в правiй частинi виразу (177) отримаємо
R |
(178) |
V dp + p dV = −CV p dV. |
42

Враховуючи те, що R = Cp − CV |
i Cp/CV |
= γ, вираз (178) переходить в |
|||||||||||||||||
диференцiальне рiвняння Пуасона з роздiльними змiнними |
|
||||||||||||||||||
|
|
|
|
V dp = −(γ − 1) p dV, |
|
|
|
|
|||||||||||
|
|
|
|
|
|
dp |
|
dV |
|
|
|
|
|
(179) |
|||||
|
|
|
|
|
|
|
|
|
= −γ |
|
|
. |
|
|
|
|
|
||
|
|
|
|
|
|
p |
V |
|
|
|
|
|
|||||||
Пiсля iнтегрування рiвняння (179) отримаємо |
|
|
|
|
|||||||||||||||
p2 dp |
V2 dV |
|
p2 |
|
|
V2 |
|
p2 |
|
V1 |
|
||||||||
Z |
|
= −γ Z |
|
ln |
|
= −γ ln |
|
|
ln |
|
= γ ln |
|
. |
(180) |
|||||
p |
V |
p1 |
V1 |
p1 |
V2 |
||||||||||||||
p2 |
|
V1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Потенцiювання виразу (180) дає рiвняння адiабатичного процесу або рiв-
няння Пуасона
p1 V1γ = p2 V2γ = ··· = p V γ = const , |
(181) |
де γ = Cp/CV – показник адiабати, або коефiцiєнт Пуасона дорiвнює
γ = |
Cp |
= |
cp |
= |
i + 2 |
> 1. (182) |
||
C |
V |
c |
i |
|||||
|
|
|
|
|||||
|
|
|
V |
|
|
|
||
Рiвняння Пуасона можна представити в iнших змiнних T, V p, T виходячи з рiвняння Менделеєва-Клайперона (118)
T V γ−1 = const, |
|
T γ p1−γ = const . |
(183) |
Рiвняння Пуасона (181) вiдрiзняється вiд рiвняння закону Бойля-Марiотта (115) тим, що в рiвняннi (181) об’єм V має показник адiабати γ = cp/cV
Рис. № 33: |
|
const |
(184) |
|
|
p = |
|
. |
|
|
V γ |
|||
Оскiльки коефiцiєнт Пуасона завжди бiльше одиницi (γ = cp/cV > 1 ), графiк залежностi p = F (V ) бiльш ”рiзький” (тобто, тиск, наприклад, бистрiше спадає iз зростом об’єму), що показано на рис. 33 (переривиста крива вiдповiдає
const !
закону Бойля-Марiотта p = , суцiльна крива лiнiя описує адiабатич-
V
ний процес).
Роботу δA, яку виконує газ проти зовнiшних сил при його адiабатичному розширеннi, визначається за формулою
m |
(185) |
δA = −M CV dT. |
43

Повна робота газу A при адiабатичному розширеннi, якщо вiдома змiна його об’єму вiд V1 до V2 i i температури вiд T1 до T2, дорiвнює
|
|
m |
|
|
T2 |
|
|
|
m |
|
|
|
|
|
|
|
|
||
|
|
|
|
Z |
|
|
|
|
|
|
|
|
|
|
|
||||
A = − |
|
|
CV |
dT = |
|
CV (T1 − T2) |
|
|
|
||||||||||
M |
M |
|
|
|
|||||||||||||||
|
|
|
|
|
|
T1 |
|
|
|
|
|
|
(186) |
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
A = |
p1 V1 |
1 |
− |
|
V1 |
!γ−1 |
= |
R T1 |
|
m |
1 |
− |
V1 |
!γ |
|||||
|
|
|
|
|
|
|
|||||||||||||
|
γ − 1 |
|
V2 |
|
|
(γ − 1) M |
V2 |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
(187) |
|
|
|
|||
2.2.7Термiчний коефiцiєнт корисної дiї
При коловому (або циклiчному) процесi система (iдеальний газ), проходячи через ряд станiв, якi характеризуються макроскопiчними параметрами: температура T , тиск p i об’єм V , повертається в початковий стан. Будь-який замкнутий цикл змiни стану iдеального газу можна розкласти на два процеси: збiльшення i зменшення об’єму газу.
При збiльшеннi об’єму при переходi iз стану 1 в стан 2 газ виконує додатню роботу проти зовнiшнiх сил. На графiку цю додатню роботу +A1 можна представити площею пiд кривою залежностi тиску вiд об’єму (1 − a − 2), яка вiдповiдає зменшенню тиску вiд p1 до p2 (рис. 34 а).
Якщо ”траєкторiя” змiни параметрiв iдеального газу в координатах p−V при зменшеннi об’єму газу (2 −б−1) не
спiвпадає з траєкторiєю(1 − a − 2), то газ виконує вiд’ємну роботу −A2, яка дорiвнює площi (рис. 34а) пiд кривою залежностi тиску вiд об’єму (2 −б −1).
Сумарна робота A, яку виконує газ, параметри якого змiнюються по замкненiй траєкторiї, дорiвнює площi, яка ”обмежена” кривою залежностi тис-
I
ку вiд об’єму (1−a−2−б−1), бо A = A1 −A2 > 0. При цьому A = p dV > 0.
44

Цикл, в якому параметри газу змiнюються за стрiлкою годинника, називається прямим циклом. У разi змiни стану параметрiв газу по траєкторiї проти годинникової стрiлки годинника (обернений цикл), газ виконує
I
вiд’ємну работу A = p dV < 0 (рис. 34 б).
Прямий цикл використовується у циклiчних двигунах, якi виконують роботу за рахунок отриманої iз зовнi теплоти. Обернений цикл використовується у холодильних машинах, в яких за рахунок роботи зовнiшнiх сил переноситься теплота до тiл з бiльш високою температурою вiд тiл з меншою температурою.
При циклiчному процесi повна змiна внутрiшньої енергiї U = 0 (бо параметри газу в початковiй та кiнцевiй точках "траєкторiї"однаковi) i вся теплота Q, яка надається газу, йде на виконання їм роботи
Q = Q1 − Q2 = U + A = A, |
(188) |
де Q1 – кiлькiсть теплоти, яка надається системi вiд нагрiвача, Q2 – кiлькiсть теплоти, яка повертається газом пiсля закiнчення повного циклу.
Термiчний коефiцiєнт корисної дiї для кругового циклу є
η = |
Q1 − Q2 |
. |
(189) |
|
Q1 |
|
|
Коловий процес називається оборотним, якщо вiн може проходити як в прямому, так i в зворотному напрямку. Причому це такий процес, якщо система змiнюється спочатку в прямому, а потiм в зворотному напрямку i повернення системи (iдеального газа) в початковий стан не приводить до термодинамiчних змiн в самiй системi i змiн у зовнiш-
ньому середовищi. Тобто, траєкторiї змiни
Рис. № 35:
термодинамiчних параметрiв як в прямому, так i в зворотному напрямках повнiстю спiвпадають.
Класична термодинамiка розглядає рiвноважнi (квазiстатичнi) процеси, коли в кожний наступний, або попереднiй моменти часу система (iдеальний газ) характеризується рiвноважними параметрами: тиском, об’ємом i температурою (тобто, перехiд вiд одного стану в iнший вiдбувається за досить
45

довгий час спостереження без будь-яких змiн в оточуючому середовищi). Будь-якi рiвноважнi процеси є оборотними i є iдеалiзацiєю реальних процесiв.
Циклом Карно називається прямий круговий цикл iдеальної теплової машини, який вiдповiдає оборотнiй змiнi стану iдеального газу (без урахування витрат на теплопровiднiсть, теплове випромiнювання, тертя i т.д.), який включає двi iзотерми (одна описує iзотермiчне розширення газу, а друга – iзотермiчне стиснення) i двi адiабати – розширення i стиснення газу (рис. 35).
Для циклу Карно термiчний коефiцiєнт корисної дiї η визначається температурами нагрiвача T1 i холодильника T2
η = |
T1 − T2 |
. |
(190) |
|
T1 |
|
|
Справедливiсть цiєї формули буде доведено у наступному параграфi.
2.2.8Ентропiя iдеального газу
Ентропiя iдеального газу dS – це вiдношення кiлькостi теплоти δQ, яку отримує газ, до температури нагрiвача
δQ |
= dS . |
(191) |
|
T |
|||
|
|
Це вiдношення ще також називається зведеною кiлькiстю теплоти.
Для iдеального газу, який здiйснює замкнутий оборотний iзотермiчний (dU = 0) цикл, iнтеграл по замкнутiй "траєкторiї" дорiвнює нулю
S = I |
δQ |
= 0 , |
(192) |
T |
бо для оборотного замкнутого циклу δQ = dU + dA = 0 (площа фiгури, яку обмежує замкнутий оборотний цикл змiни стану газу в координатах p − V , дорiвнює нулю та dU ≡ 0).
46

Для необоротного замкнутого циклу ен-
тропiя iдеального газу збiльшується |
|
|
|
|
|
|
|
|
||||
S = S2 − S1 = I |
δQ |
= I |
d |
U + dA |
> 0, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
T |
|
T |
|
|
|
|
|
|||||
|
|
|
|
|
(193) |
|
|
|
|
|
||
бо робота, яку виконує газ при необоротно- |
|
|
|
|
|
|||||||
му замкнутому циклi, є додатньою. Тобто |
|
|
|
|
|
|||||||
для довiльного замкнутого циклу ентропiя |
|
|
|
|
|
|||||||
iдеального газу дорiвнює нулю, або збiль- |
|
|
|
|
|
|||||||
шується |
|
|
|
|
|
|
|
|
|
|
|
|
S ≥ 0. |
|
|
(194) |
|
|
|
|
|
||||
При змiнi стану газу з положення 1 в поло- |
|
|
|
|
|
|||||||
ження 2 змiна ентропiї |
S1−2 дорiвнює |
|
|
|
|
|
|
|
||||
|
|
|
|
|
2 |
δQ |
2 |
d |
U + δA |
|
|
|
|
S1−2 = S2 − S1 = Z |
|
|
= Z |
|
. |
(195) |
|||||
|
T |
|
T |
|||||||||
|
|
|
|
|
1 |
|
|
1 |
|
|
|
|
Наведений вираз дозволяє визначити зростання ентропiї для довiльного переходу стану iдеального газу. Оскiльки
dU = |
m |
CV dT, а δA = p dV = |
|
m |
R T |
dV |
, |
|||||||||||||||
|
|
|
|
V |
||||||||||||||||||
|
M |
|
|
|
|
|
|
|
|
|
|
|
|
|
M |
|
|
|||||
знайдемо змiну ентропiї |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S1 |
|
2 |
= |
m |
CV |
T2 |
dT |
|
+ R |
V2 |
dV |
. |
|
||||||||
|
− |
|
|
|
|
|
V |
|
||||||||||||||
|
|
|
|
M |
|
Z |
T |
Z |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
T1 |
|
|
|
|
V1 |
|
|
|
|
|
|
|||
або |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
m |
|
|
|
T2 |
|
|
|
|
V2 |
! . |
|
|||||||
|
S1−2 |
= |
CV ln |
+ R ln |
|
|||||||||||||||||
|
M |
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
T1 |
|
|
|
V1 |
|
|
|
||||||
Для адiабатичного процесу, коли δQ = |
|
|
|
|
|
|
|
|
|
|||||||||||||
0, отримуємо, що |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S1−2 = 0 S = const. |
(199) |
|
|
|
|
|
|
|
|
|
||||||||||||
Для iзотермiчного процесу (T = const)
|
|
m |
|
V2 |
(200) |
||||
S1−2 = |
|
|
|
R ln |
|
|
. |
||
|
M |
V1 |
|||||||
Для iзохоричного процесу (V = const) |
|||||||||
|
m |
|
|
T2 |
(201) |
||||
S1−2 = |
|
|
CV ln |
|
. |
||||
M |
T1 |
||||||||
(196)
(197)
(198)
47

Визначимо коефiцiєнт корисної дiї η циклу Карно, який представлено в координатах T − S на рис. 36. На дiлянцi 1−2, яка вiдповiдає адiабатичному розширенню газу (рис. 34), робоче тiло отримує тепло Q1 вiд нагрiвача з температурою T1. Виходячи з формули (191), яка визначає змiну ентропiї, кiлькiсть теплоти Q1 дорiвнює
Q1 = T1 S2−1 = T1 (S2 − S1) . |
(202) |
На дiлянцi 3 − 4, яка вiдповiдає адiабатичному стисненню газу, робоче тiло вiддає деяку кiлькiсть теплоти −Q2, яка дорiвнює
|
−Q2 = T2 |
S1−2 = T2 (S1 − S2) . |
|
|
(203) |
|||
За визначенням коефiцiєнт корисної дiї η дорiвнює |
|
|
|
|
||||
η = |
Q1 − Q2 |
= |
T1 (S2 − S1) + T2 (S1 − S2) |
= |
T1 − T2 |
. |
(204) |
|
|
Q1 |
T1 (S2 − S1) |
|
T1 |
|
|||
2.3 Одиницi вимiрювань, константи в молекулярнiй фiзицi
1.Маса газу – [m]=кг.
2.Атомна одиниця маси – [mi] = 1 а.о.м.= 1, 66054·
10−27 кг.
3.Вiдносна молекулярна маса – [Mr] = mмол/mi.
4.Об’єм газу – [V ] =м3.
5.Об’єм одного моля – Vm = 22, 41·10−3 м3/моль.
6.Температура – [T ] = K.
7.Густина газу – [ρ] = " mV # = мкг3 .
8.Питомий об’єм – [v] = V /m = 1/ρ = м3/кг.
9.Молярна маса – [M ]=кг/моль (M = Mr·10−3 кг/моль).
10.Кiлькiсть речовини – [ν] = [m/M] = моль.
11.Тиск – [p] = Па = мН2 .
12.Кiлькiсть молекул – [N ] = 1.
13.Число Авогадро – NA = 6, 022 · 1023 [моль−1].
14.Концентрацiя молекул газу – [n] = " NV # = (м3 моль)−1.
15.Температурний коефiцiєнт розширення газiв – [α] = 1/273, 15 К−1.
48
16.Молярна газова стала – R = 8, 31 Дж/(моль ·К).
17.Стала Больцмана – k = R/NA = 1, 38 · 10−23 Дж/К.
18.Нормальний тиск – p0 = 1, 013 · 105 Па.
19.Потрiйна точка води – T = 273, 15 К.
20.Кiлькiсть теплоти – [Q] = Дж.
21.Питома теплоємнiсть – [c] = Дж/(кг·К).
22.Молярна теплоємнiсть – [Cm] = Дж/(моль·К).
23.Ентропiя (зведена кiлькiсть теплоти) – [S] = Дж/К.
49

3Електрика та постiйний струм
3.1Електростатика
Точковий заряд Q – заряд, який розташовано в точцi i, лiнiйнi розмiри якого значно меншi, нiж вiдстанi, на яких розглядається дiя цього заряду на iншi.
Пробний заряд Q0 – завжди додатнiй точковий заряд довiльної величини.
3.1.1Закон збереження електричного заряду
Алгебраїчна сума електричних зарядiв будьякої замкненої системи (системи, що утворюється k зарядами, i яка не обмiнюється зарядами iз зовнiшнiми тiлами) залишається незмiнною, незалежно вiд того, якi процеси вiдбуваються в системi. Закон збереження електричного заряду можна сформулювати у виглядi
k |
Qi = const. |
(205) |
X |
|
|
i
3.1.2Закон Кулона
Модуль вектора сили взаємодiї мiж двома нерухомими точковими зарядами прямо пропорцiйний добутку зарядiв Q1 i Q2 i обернено пропорцiйний квадрату вiдстанi r2 мiж ними
Fq = k |
|Q1 Q2| |
, |
(206) |
|
r2 |
||||
|
|
|
де k є коефiцiєнт пропорцiйностi i в СI дорiвнює
k = |
1 |
(207) |
4πε0ε |
i де ε0 – електростатична стала (ε0 = 8, 85 · 10−12 Кл2/Н·м2), величина ε
характеризує, у скiльки разiв сила Кулона у вакуумi бiльша нiж сила Кулона,
Рис. № 37:
яка дiє мiж тими ж зарядами, у даному середовищi.
50
