
- •Бекмырза кенжебатыр жағыпарұлы Рекомбинационные процессы и радиационные дефекты в облученных сульфатах щелочных металлов
- •Введение
- •1.4 Дефектообразование в сульфатах щелочных металлов
- •3 Собственная люминесценция сульфатов щелочных металлов
- •3.1 Спектр излучения и возбуждения кристаллов
- •80 К и 300 к, лист 1
- •3.2 Природа собственной люминесценции сульфатов щелочных металлов
- •4 Электронно-дырочные центры захвата в облученных сульфатах щелочных металлов
- •Энергия, эВ
- •Температура, к
1.4 Дефектообразование в сульфатах щелочных металлов
В последние годы большое количество соединенийсемейства
A' A'' BX 4
(где
A' ,
A'Li, Na, K , Rb,Cs, NH4 , N (CH3 )4
и др. и
BX 4 SO4 , SeO4 , ZnCl4 , ZnBr4 , BeF4 ,
MoO4 ,WO4
и др.) являются очень интересными объектами из за разнообразия
физических свойств последовательности фазового перехода, включающего в себя несоизмеримые суперионные, ферроэлектрические, сегнетоэлектрические
фазы. Исключительно с суперионными проводниками ( Li2 SO4 ,
LiNaSO4
и др.)
соединения
A' A'' BX 4
демонстрируют высокотемпературную неупорядоченную
D
. 6h
Kurzynski [68] квалисифицировал эти соединения на четыреотдельные
группы согласно последовательности структурных фаз. Кристалл
LiKSO4
был
выделен в отдельную группу, в виду его необычной последовательности фазовых переходов (Рис 1.7).

Рисунок 1.7 – Последовательность фазовых переходов кристалла
LiKSO4
[69]
Температуры в этой схеме, в основном, соответствуют литературным данным, посвященным процессам нагревания [70, 71, 72, 73, 74, 75, 76].
Несмотря на большое количество экспериментальных и теоретических
работ посвященных исследованиям кристаллов
LiKSO4
в температурном
диапазоне 200-1000 К, существуют еще не мало спорных точек зрения относительно последовательности фазовых переходов. Эти спорные моменты связанные в основном с существованием, или ее отсутствием, некоторых фазовых переходов и симметрий этих структурных фаз.
На самом деле, установлены только структуры соответствующие фазам I и
D
принадлежащей пространственной группе
4 ( P6
/ mmc ) [77].
6h 3
LiKSO4
находится в фазе (III),
которая обладает гексогональнойсимметрией принадлежащей
C 6
( P63
) с двумя формульными единицами в
элементарной ячейке[78, 68]. Между этими гексагональными фазами существует структурная фаза (II) которая симметрией конечно ниже, чем гексагональная. В этой фазе присутствуют и орторомбическая и модулированная структуры. Модулированная структура несоизмерима между 743 К и 940 К, и соизмерим в температурном диапазоне 711-743 К [77]. Pimenta с соавторами [79] представил модель, которая согласовывает эти два объяснения: двойное-К орторомбическая модуляция расстройства вероятности.
На рисунке 1.8 представлена проекция структуры при комнатной температуре в плоскости, перпендикулярной к гексагональной оси с [78, 68]. Ион калия локализуется вдоль гексагональной оси. Ионы сульфата ориентируются таким образом, чтобы три иона кислорода располагались перпендикулярно гексагональной оси, а четвертый вдоль тройной оси этой структуры. Инны лития и серы также локализуются вдоль тройной оси этой структуры. Два иона сульфата этой же элементарной ячейки направлены по винтовой к плоскости шестигранника, вдоль оси с. Принимая во внимание полярность данной группы симметрии, можно сделать вывод о приоэлектричности этого кристалла при комнатной температуре [80]. Также в этой фазе вдоль гексагональной оси присутствует оптическая активность [76,
80]. Еще один немаловажный аспект в структуре кристалла
LiKSO4
при
комнатной температуре, который связан с динамичным ориентационным
разупорядочением ионов сульфата. Шультц, Цукер и Фрэч [68] наблюдали как ион кислорода занимает три разные позиции вокруг тройных осей. Средняя позиция по тройным осям, и это сохраняет структуру симметрии. При понижении температуры в кристалле происходит фазовое превращение при 205 К. Bansal и соавторы [70] при исследовании рамановской спектроскопии, для фазы IV предложили треугольную структуру вдоль пространственной
C 3v
( P31c ). А Tomaszewski и Lukaszewicz [71] предложили
C 6v
( P63 mc ). При
исследовании нейтронной дифракции Zhang, Yan и Boucherle [81] предположили что имеет место предложенная в работе [70] треугольная симметрия и определили атомные положения в этой симметрии. Bhakay- Tamhane и Sequiera [74] предложили что присутствие двух видов малых размеров побудило авторов [71] отдать предпочтение к структуре с более высокой симметрией.
Проекция треугольной структуры на базисную плоскость представлено также на рисунке 1.8. Отличием в данной структуре от структуры при комнатной температуре является то что сульфат поворачивается в своей элементарной ячейке. В работе [81] показано, что в этой фазе ориентация ионов сульфатов сохраняется неизменной.
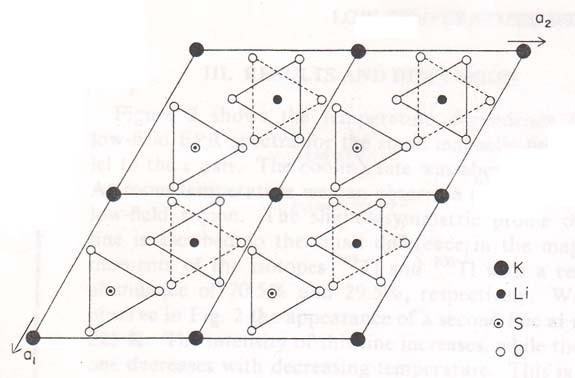
Рисунок 1.8 - Проекция четырех элементарных ячеек кристалла LiKSO4 в базисной плоскости для III и IV фазы. Затушеванные треугольники
представляют ориентацию сульфата тетраэдров в фазе III. Один сульфат в каждой элементарной ячейкиявляется переориентация в фазе IV (пунктирные треугольники). Два тетраэдра через элементарные ячейкисмещаются на с / 2 вдоль оси c [69]
Если продолжать процесс охлаждения кристалл подвергается следующему фазовому переходу при температуре около 190 К. Моноклинная структура с
пространственной группой
C4 (Cc)
представлена в работах [74, 76],
S
2v (Cmc21 )
C 12
доменную суперпозицию ниже 190 К при исследовании оптических свойств этих кристаллов. Еще один важный признак IV-V фазового перехода, это замораживание ориентационной разупорядоченности [71, 74]. Further с соавторами [82] наблюдали ферроэластические домены в этой фазе.
О структуре при более низких температурах известно совсем мало. В работах [71, 74] авторы наблюдали фазовые переходы при температуре 165 К, но другими работами это не было подтверждено. Структура низкой симметрии при температуре жидкого азота была рассмотрена в работах [74, 76]. Исследования ЭПР выявило структуру осевой симметрии. [72, 83]. Fonseca с соавторами [72] представили реентерабельную гексагональную структуру фазы VII.
Еще одна важная составляющая касается кинетики последовательности
низкотемпературного фазового перехода в кристалле
LiKSO4 . Это было
подчеркнуто в работе [71], последовательность подвержена влиянию термического цикла имеющихся пар дефектов в образцах. Bhakay и соавторы также наблюдали разные структуры в нескольких температурных диапазонах фазовых переходов.
В целях уточнения таких спорных моментов в работе[69] была исследована последовательность низкотемпературных фазовых переходов
методом ЭПР в кристалле
LiKSO4 . Этот кристалл был исследован методами
ЭПР, в которых ион
Tl2
используется в качестве парамагнитного зонда.
Как уже было подчеркнуто, две основные проблемы последовательности
низкотемпературных фазовых переходов в кристалле
LiKSO4
связаны с
существованием нескольких фазовых переходов и с симметриями, которые имеютместо в фазах при низких температурах относительно первой проблемы, определение температуры перехода связанной с существованием разных структур в разных температурных диапазонах кажется очень трудным [71, 72, 74, 76]. Были установлены [69] III-IV и IV-V структурные переходы в широком температурном диапазоне. Фазовый переход V-VI в данной работе не наблюдался. Примерно при этой температуре происходит полное исчезновение фазы IV.
Полученные результаты дают объяснения спорным моментам симметрии. При 77 К наблюдались абсолютно разные спектры, зависящие от скорости охлаждения. Структура с осевой симметрией наблюдалась при температуре 77 К, только после процесса очень быстрого охлаждения. Этот результат предполагает случайное замораживание иона сульфата в разупорядоченном положении, в котором он пребывал при комнатной температуре. Это может быть объяснено реентрабельной фазой рассмотренной в работах [72, 83].
Также была продемонстрирована важность рассмотрения, учитывая существование ещё двойных вложении, и касающиеся их симметрии. Явно наблюдаемая симметрия кристалла, в макроскопическом смысле, больше чем его реальная симметрия. Этоможетбытьобъяснено тем, что предположенные в работе [71] гексагональная и орторомбическая симметрии соответствуют фазам IV и V соответственно.
Осевая симметрия фаз III и IV может быть проверена при помощи
определения Зеемана и супертонких тензоров парамагнитного центра
Tl2.
Оказалось возможным создать ферроэластичную область в образце, при температуре 190 К, применяя одноосное давление. Угловая зависимость спектра ЭПР в ферроэластичной фазе V связывается с моноклинной
структурой, вероятно, принадлежащей пространственной группе
С 4 ,
s
выморожения и показывает, что имеет место наклонение осью а.
SO4
группы рядом с
В работе [84] методом ЭСР в качестве дефекта избытка первичных
электронов найден O-
ион в облученном рентгеновскими лучами кристалле
K2 SO4 .Дефекты избытка первичных электронов флормирующиеся
4
в кристалле
K2 SO4
должны быть описаны как [O- ,SO2- ] , а не
3
SO- . Это утверждение не соответствует хорошо
4
SeO3-
в облученных селенатах [85]. Это же различие
4
встречаются в хлоратах и перхлоратах, броматах и перброматах:
ClO- и
3 -
O- [86, 87]. Искажения
структуры, необходимые для компенсации присоединенного электрона на
BrO-
3 -
относительно низколежащим атомными уровнями 5s , 4d
и 5 p .
В работе [88] проведены спектроскопические изучения и электрическая
проводимость облученных лучами смешанных систем
Li2 SO4 Na2 SO4 . При
синтезе кристалла
LiNaSO4
использовались кристаллы
Li2 SO4 ,
Na2 SO4 . После
облучения лучами в кристалле
LiNaSO4 , на спектре ЭПР четко видно
образование ионов радикалов
SO-
и SO-
являющиеся результатом
4 3
наличие связей соответствующих
SO2-
ионам. После воздействия облучения не
4
проводимость смешанных систем
Li2 SO4 Na2 SO4
было исследовано в диапазоне
температур при
30 430о К . Энергия создания Френкельевских дефектов
равнялась 3,2 эВ. После облучения кристалла гамма лучами зарегистрировано очередное уменьшение значения электрической проводимости, сопровождавшееся ростом первоначальной энергии активации. Вольт - амперные характеристики показывают, пространственный заряд ограниченного
тока преобладает при высоких напряжениях, тогда как омические проводимость наблюдалась при низких температурах. Исследование при изотермическом отжиге показывает, уменьшение электрической проводимости с увеличением времени отжига и процесс отжига.
Термостимулированное экзоэлектронное излучение температурно-
обработанных чистых и Sm , Dy допированных
K2 SO4
кристаллов показано в
работе [89]. Порошок
K2 SO4
является очень сильным экзоэлектронным
излучателем [90]. Каждый пик свечениясогласуется с одним видом электронной ловушки. Поэтому, смещение пиков, обнаруженные в
рекристаллизованных чистых и допированных кристаллах
K2 SO4 , указывают на
генерацию новых электронных ловушек путем плавления этого вещества. Интенсивность термостимулированного экзоэлектронного излучения не рекристаллизованного материала отличается по всему спектру.
Максимум в области
600о С
может соответствовать изменениям
кристаллической решетки с ромбической
K2 SO4
на гексагональную
K2 SO4 , которое только начинает проявляется при данной температуре[91]. Изменения создают несовершенства решетки, которые известны как электронные ловушки. В данной работе максимум интенсивности термостимулированного экзоэлектронного излучения появляется при
температуре отжига около
900о С . Этоможет быть изза деградации
кристаллической решетки. По мере приближения к точке плавления интенсивность термостимулированного экзоэлектронного излучения опять уменьшается, т.к вероятность излучения электрона уменьшается распределением по решетке.
ОБЪЕКТЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объекты исследования.
Объектами исследования данной работы являлись кристаллы
Na2 SO4 ,
K 2 SO4 ,
LiKSO 4 ,
NaKSO 4 ,
LiNaSO 4 .
Большое количество исследований были посвящены синтезу и росту кристаллов нелинейных оптических (НЛО) материалов, благодаря их потенциальному применению в области телекоммуникаций, фотоники и оптоэлектронике. В настоящее время, разработаны многочисленные неорганические нелинейные оптические материалы [92, 93, 94]. Кристаллы
LiKSO4
принадлежат к семейству кристаллов собщей структурной
формулой
M' M'' AX4
( M 'Li, Na ,
M''= K, Cs,
Rb, NH4 ,
N2 H5 , и группа
AX4 SO4 ,SeO4 , BeF4 ). В настоящее время, большое внимание уделяется этим
2- 2-
кристаллам благодаря их сегнетоэлектрическим, пьезоэлектрическим свойствам и ионной проводимости. В течение последних двух десятилетий, обширные исследования были посвящены росту, структурным и фазовым переходам
кристаллов
LiKSO4 . Кристалл
LiKSO4
обладает гексагональной структурой с
пространственной группой
P63 , при комнатной температуре [95, 96]. Кроме
того, наблюдались несколько структурных фазовых переходов ниже [97] и выше комнатной температуры [98].
В работе [99] рассмотрен процесс роста монокристаллов
LiKSO4
методом
медленного испарения при комнатной температуре. Был проведен рентгеновский дифракционный анализ выращенных кристаллов. Также, был проведен спектральный анализ ультрафиолетовой, видимой и ближней инфракрасной области спектра, проведены оптические измерения ширины запрещенной зоны, измерены генерации второй гармоники.
Кристаллы
LiKSO4
были синтезированы путем химической реакции
сульфата лития с сульфатом калия, в стехиометрическом соотношении 1: 1 при растворении бидистиллированной воды (растворителя) при комнатной температуре. Химическая реакция синтеза данного кристалла приведена в формуле (2.1):
K 2SO4 H 2O Li2 SO4 LiKSO4 : H 2O
(2.1)
Насыщенный раствор сульфата лития калия был растворен в бидистиллированной воде. Влага из раствора выпаривалась в без пыльных условиях. Процесс роста кристаллов занимал 25 дней, после которых получали бесцветные и прозрачные кристаллы. Для того чтобы повысить качество кристалла, собранные кристаллы подвергали перекристаллизации несколько раз.
Исследование монокристаллов
LiKSO4
методом дифракции рентгеновских
лучей показывает, что кристаллы
LiKSO4 , при комнатной температуре,
обладают гексагональной структурой с пространственной группой
P63 .
Размеры элементарной ячейки
a b
5,1453 ( 2 ) A
и c
8,6342 ( 7 ) A . Эти
значения хорошо согласуются с данными работы [95]. Элементарная ячейка этого кристалла состоит из двух молекул. Структура кристалла состоит из
ионов
Li
и SO2-
лежащих наосях третьего порядка и ионаK с
4
(Рисунок 2.1) [95].

Рисунок 2.1 - Координационный полиэдр иона
K , вид вдоль оси с [99]
В таблице 2.1 приведены параметры элементарной ячейки кристалла
LiKSO4
в зависимости от фазового состояния. При повышении температуры в
районе 700 К кристалл из оптически одноосного становится двуосным ромбическим и двойникуется, образуя хорошо выраженные тройники со 120-
градусными границами. Эта
G2 -фаза является сегнетоэластической и может
быть монодоменизирована механическими напряжениями. Более
высокотемпературная фаза
G1 плохо изучена из-за трудности проведения
исследований при температурах порядка 1000К. Исследования
низкотемпературных фаз G4
и G5
более многочисленны. Установлено, что при
охлаждении фаза G3 сохраняется до ~200 К, а затем последовательно переходит
в G4
и в районе 185 К – в G5 .
Связь между сульфатом натрия и сульфатом калия, представляет интерес в
кристаллографии из-за того, что каждое соединение обладает несколькими кристаллографическими структурами. Существование твердого раствора в этих соединениях является очень интересным для структурной кристаллографии, в виду большой разницы в ионных радиусах между натрием (0,98 А) и калием
(1,33 А), которая равна 0,35 А или 35,7%. Натрий и калий обычно не объединяються в изоморфный ряд. Калий обычно группируются с рубидием и цезием, но не с натрием. в выработке изоморфный взаимосвязь между щелочных сульфатов исключены сульфат натрия из его рядов.
Таблица 2.1 - Последовательные фазы в
LiKSO4
|
Фаза |
Пространственная группа, Тi, К |
a |
b |
с |
Z |
Литература |
|
в ангстремах | ||||||
|
G1 |
P61mc, P63/mmc |
5.295 |
9.081 |
8.706 |
2 |
[100] |
|
|
941-948 |
|
|
|
| |
|
G2 |
Pc21n Pbn21 |
5.229 |
8.665 |
4 |
[101] | |
|
|
708 |
|
|
|
|
|
|
G3 |
P63 |
5.146 |
|
8.636 |
2 |
[102] |
|
|
201, 242 |
|
|
|
|
|
|
G4 |
P31c |
5.129 |
|
8.639 |
2 |
[103] |
|
|
178 |
|
|
|
|
|
|
G5 |
Cmc21 |
5.167 |
8.777 |
8.619 |
4 |
[102] |
Сульфат натрия существует в пяти фазовых состояниях: I, (II), III, (IV) и V.
В кристалле
Na 2SO4
фазовое состояние I является стабильным при температуре
выше
185о С
240о С , афазовое состояние III метастабильно при температуре ниже и состояние V является стабильным при обычных температурах. Фазовое
состояния II и IV являются нестабильными при обычном давлении.
Сульфат калия существует в двух полиморфных фазах, а именно: (1)
высокотемпературная фаза, называемая
- K 2SO4 , которая стабильна при
температурах выше
590o C
одноосно отрицательна, и (2) низкотемпературная
фаза называемая
- K 2SO4 , является стабильной при комнатной температуре,
обладает ромбической структурой, с пространственной группой Pmcn . В таблице 2.2 представлены кристаллографические данные различных сульфатов, упомянутых выше.
Образцы были приготовлены путем сплавления смеси
Na 2SO4
и K 2SO4 в
диапазоне молекулярных соотношений от 4:1 до 1:4. В процессе кристаллизации из расплава в сформированном кристалле образуется твердый
раствор в гексагональных формах
Na 2SO4
и K 2SO4 . Безпримесные торцевые
элементы всегда инвертируются в более низкой модификации симметрии при охлаждении. С другой стороны, существует ряд соединений между концевыми элементами которые, могут находиться твердый раствор гексагональной формы в стабильном состоянии. При температурах не сильно отличающихся от температуры стабильного состояния, структура чистых образцов максимально близка к первоначальной структуре твердого несмешанного раствора, из которого, при охлаждении получается чистый крайний элемент. В образцах, приготовленных из расплавов, пределы диапазона температур, в котором твердый раствор стабильный определить трудно.
Таблица 2.2 - Кристаллографические данные кристаллов сульфата калия, сульфата натрия и сульфатасмешанных металлов натрия и калия
|
Соединение |
Структура |
Простр. группа |
a 0 |
b0 |
c0 |
Z |
Литература |
|
Na 2SO4 |
|
|
|
|
|
|
|
|
I |
Гексагон. |
Pbnn |
5,39 |
|
7,25 |
2 |
[104] |
|
III |
Ортагон. |
Pddd |
5,59 |
8,91 |
6,98 |
4 |
[105] |
|
IV |
Ортагон. |
|
5,85 |
12,29 |
9,75 |
8 |
[106] |
|
K 2SO4 |
|
|
|
|
|
|
|
|
|
Гексагон. |
|
5,71 |
|
7,85 |
2 |
[107] |
|
|
Ортагон. |
Pmcn |
5,77 |
10,06 |
7,52 |
4 |
[108] |
|
NaKSO4 |
Гексагон. |
P3m |
5,643 |
|
7,259 |
2 |
[109] |
Поскольку состав материала очень мелкозернистый, оптическими методами чистые образцы отделить от образцов имеющих с своем составе твердые растворы первоначальных веществ, практически невозможно. В диапазоне молекулярных соотношений от 3:1 до 1:3, или даже от 4:1, до 1:4, расслоение и инверсии являются незначительными. Эта особенность в установлении определенных границ для стабильного диапазона в материале, подготовленного методом сплавления двух кристаллов не встречается при использовании монокристаллов, полученных из раствора.
Кристаллическая структура кристалла
Li2 SO4 : H 2O
была исследована для
определения роли воды, т.к. атомные номера подходящие, кристалл легко получить испарением из водного раствора при комнатной температуре, а также известны кристаллографические данные [110]. Структура полностью была определена с помощью данных с фотографии вращающихся кристаллов, полученных при помощи молибденового излучения.
Элементарная ячейка и пространственная группа. Исследование кристалла рентгеновскими лучами, показало моноклинную ячейку, состоящую из двух
молекул,
a 5,43, b 4,83, c 8,14, 107o35' . Расчетная плотность молекул в
элементарной ячейке равна 2,075, а наблюдаемая плотность 2,052. Именно эта элементарная ячейка не является ячейкой в кристаллографическом осевом отношении [110]. Уравнения преобразования из кристаллографических индексов в индексы рентгеновских лучей приведены в формуле (2.2):
⎫
h -l' ⎪
⎬
1 1 ⎪
(2.2)
![]() l
h'
l
h'
2
l'⎪
![]() 2
⎭
2
⎭
Здесь h, k и lиндексы рентгеновскихлучей, а h’, k’ иl’
кристаллографические индексы.
Согласование между измерениями элементарной ячейки рентгеновских
лучей и осевым отношением
a : b : c 1,606 :1: 0,5633
показана всоответствии с
элементарной ячейки рентгеновских лучей 201: b0
: 1 a
![]() 2
0
2
0
1,609 :1: 0,5624 . Угол
рентгеновского луча
107o35'
согласуется с оптически измеренным углом
72o32'
между кристаллографическими направлениями (100) и (101).
Пространственная группа. Графическая индексация [111]пластин и цилиндрических пленок показала присутствие всех видов пластин, кроме типа
0k0, где k четное число. В силу того что кристалл
Li2 SO4 : H 2O
обладает всеми
пространственными группами симметрий диэдрического класса [110], кроме
C2 (P2 ), C2 (P2 ), C2 (C2 ) .
1 2 3
1
Данные полученные при помощи рентгеновского облучения не дают прямой информации о водороде, но на основе данной информации можно сделать вывод, что возможной позицией водорода может быть позиция вокруг
О5 . Ближайший сосед кислородаО5
лежит за пределамикислородного
тетраэдра, образованного вокруг
Li1 , и им является О2
(Рисунок 2.2).
О5 находится за пределами элементарной ячейки
О2 , на расстоянии 2,96 А,
расстояние до следующей элементарной ячейки такое же. Это расстояние
является результатом образованного угла между
О2 О5 О2 , который равен
108о . И если водород располагается между
О5 и
О2 , то получившийся угол
Н О Н
будет рамен
108о . Структура описывается тетраэдром из кислородов,
которые окружают атомы серы и лития.
Тетраэдр
Li1 состоит из трехатомов кислорода, из трех разных SO4
групп и
из одного кислорода из группы
H 2O , тогда как тетраэдр
Li2
состоит их четырех
разных
SO4
групп. Различные тетраэдры
LiO4
состоят из углов, но не имеют
краев и сторон. Несмотря на большое число параметров, согласование между расчетными и наблюдаемыми значениями интенсивности отражения и очень умеренное межатомное расстояние показывает, что структура надежна.
Кристаллическая структура кристалла
LiNaSO4
рассмотрена в работе [112].
Среднее значение расстояния
S - 0
хорошо согласуются с аналогичными
данными для других кристаллов [113]. тенденция к распространению значении
расстояния
S - 0
могут быть применены для рассмотрения ближайшего
соседнего окружения связанных атомов кислорода. Для более короткого
расстояния
S(2) - 0(2)
и S(3' ) - 0(3')
связи лежат на тройных осях с расстояниями
2,68 А между О(2) и
0(3' ) атомами, тогда как
S(3) - 0(6)
точка в стыке трех
многогранников ионов щелочных металлов, которые разделены между собой самыми короткими в структуре ионнымирасстояниями. И для самого
длинного расстояния
S(1) - 0(1) , который включает в себя атом кислорода, до
ближайшего соседа которого 3,01 А, и до его ближайшего катиона 2,08 А.
Межатомные расстояния в кристалле
LiNaSO4
могут быт сравнимы с
межсульфатными расстояниями в кристаллах
2,64-2,77 А [114].
CuSO4
и ZnSO4
и лежат в пределах

Рисунок 2.2 – Структура элементарной ячейкикристалла
структуры на плоскость ac
Li2 SO4:H 2O , проекции
Многоугольники образуются из атомов кислорода и в редких случаях из ионов щелочных металлов. Искажения тетраэдра, из ионов лития, появляются вдоль самой короткой из трех двойственных осей тетраэдра. Многогранник из ионов натрия является более сложным. Если рассматривать шесть ближайших
соседей, то угол
O - Na - O
может быть разным от 55 до 140o . Самый малый угол
с участием атомов кислорода, которые разделяют край с сульфатным тетраэдром. Следующий малый угол ( 66o ) образован при самом малом межсульфатном расстоянии с участием кислорода, которые разделяют идентичные, но по-разному повернутые многогранники. Образование таких восьмиугольных окружений координатно не возможно для ионов натрия. При рассмотрении следующих ближайших атомов кислорода О(6) и 0(4) в координационнойсферебылаобнаруженаискаженная антипризма Архимеда. В этом, идеальном многограннике атомы кислорода О(4) типа смещаются в
сторону иона натрия. Ион кальция в кристалле
CaNa2 (SO4 )2
[115] также
расположен на искаженной антипризме состоящей из шести близких (2,36-2,47
А) и двух более отдаленных (2,74) атомов кислорода.
Структура кристалла
KNaSO4
трехгранная,
P3m1, a 5 6066 Å ,
c 7 177 Å ,
Z 2, DX
2,69Mgm3. Кристалл синтезируется нагревом раствора
K2 SO4 и
NaSO4
в платиновом тигле при температуре 1273 К в течение 2 часов.
Синтезированные кристаллы являются бесцветными, прозрачными
призматическими кристаллами. Структура строится из
SO4
тетраэдра,
M (1)O6
октаэдра, а так же из
M (2)O10
и M (3)O12
полиэдров. В кристаллах
KNaSO4
атомы
натрия занимают позиции
M (1) и
M (2) , а атомы калия занимают позиции
M (2)
и M (3) . В кристаллах
KNaSO4
была обнаружена 3m тригональная симметрия
![]() Лауэ. Возможными
пространственнымигруппами для
кристаллов
Лауэ. Возможными
пространственнымигруппами для
кристаллов
KNaSO4
являются
P3m1, P321, P3m1. Пространственные группы
![]()
P3m1, P3m1
подходят
больше для определения структур этих кристаллов. Собранные данные по
интенсивности соответствуют образцу кристалла
0,15х0,05х0,05 мм.
KNaSO4
с размерами
Кристаллы сложных сульфатов калия и натрия были синтезированы в лабораторных условиях из водных растворов, а также из расплавов сульфатов натрия и калия в разных пропорциях. Использование различных методов исследования показало, что при высоких температурах, близких к температуре плавления сульфатнатрия и сульфаткалия становятсяизоморфными и образуют полный ряд твердых растворов. Такой же синтетический минерал, полученный из водного раствора был найден при помощирентгеноструктурного анализа и подтвержден с помощью химического анализа. Для получения ограниченного диапазона видов твердых растворов
соотношения смесей подбиралось от 1K:1Na до 5K:1Na при температуре
70о С .
Виды твердых растворов становяться ограниченными при соотношении смешиваемых веществ 3K:1Na при комнатной температуре. С увеличением содержания калия в синтезированном высокотемпературном твердом растворе, приводит к постепенному увеличению постоянной решетки, а также показателя
преломления. Соединение
NaKSO4
может быть составляющим
высокотемпературных форм твердых растворов сульфата натрия и сульфата калия.
Кристаллы
LiKSO4
и LiNaSO4 , оба обладают гексагональной структурой,
но с разными пространственными группами, могут быть представлены
двойными соединениями между
Li2SO4
и K 2SO4 , а также
Li2SO4
и Na2SO4
соответственно. Никаких структур в виде твердых растворов не было обнаружено при рентгеноструктурном анализе.
Следующие данные были определены для
LiNaSO4 :
a 0 7,64 ,
c0 9,76, (0,02 A) ;
a0 : c0 1:1,277; Z 6 , пространственная группа P31c, измеренный
удельный вес 2,515, рассчитанный удельный вес 2,527.
Термостимулированная люминесценция
Суть метода термостимулированной люминесценции, это регистрация свечения предварительно возбужденного образца при планомерном нагреве. Для измерения спектров термостимулированной люминесценции, объект охлаждается, в зависимости от поставленных задач либо до температуры жидкого азота, либо до гелиевой температуры. При этой температуре проводится облучение образца в течение продолжительного времени. По
истечении необходимого времени, облучение останавливается, и кристалл начинают медленно нагревать. И одновременно с нагревом регистрируют свечение, которое излучает нагреваемый образец.
Свечение предварительно возбужденного образца при постоянной температуре кардинально отличается от свечения этого же образца, которое происходит при равномерном увеличении температуры. Это объясняется тем, что с течением времени после остановки возбуждения, количество высвобождающихся зарядов из ловушек уменьшается, а при нагреве начинают высвобождаться заряды с более высокой энергией локализации, которые при постоянной температуре не смогли бы высвободиться.
При постоянной температуре интенсивность свечения предварительно облученных образцов уменьшается с течением времени, а интенсивность свечения образцов подверженных равномерному нагреву может нарастатьи уменьшаться с течением времени.
Процесс термостимулированной люминесценции протекает в несколько этапов. Считается, что первый этап это когда высвобождаются заряды из не глубоко расположенных ловушек, а второй когда опустошаются ловушки находящиеся на самой большой глубине.
Поэтому во время первого этапа в зону проводимости попадают заряды
одного типа - высвобожденные из неглубоких ловушек
(j m) :
dn j
j v j
![]() (1
j
)wj
nj
,
j
(1
j
)wj
nj
,
j
dt
m
![]() v
v
(2.3)
j j
j
А при втором этапе ( j m- ):
dnm- w-
nm-
,
0 nm0
(2.4)
![]() dt m
dt m
![]()
m0
m
v ![]() mm
mm
n j
- концентрация электронов на ловушках j -го сорта;
m- самый
глубокий сорт электронных ловушек;
v- концентрация электронных ловушек
j
- эффективное свечение рекомбинации свободных электронов с
j j
w- вероятностьтермического
w j
Во время повышения температуры
не является постоянной:
/
kT
wwe j
(2.5)
j 0 j
А при повышении температуры с постоянной скоростью:
T T0 t
(2.6)
где - скорость нагрева, а T0 - исходная температура.
После опустошения и неглубоких и глубоких ловушек яркость свечения уменьшается. Глубину ловушки можно определить в зависимости от температуры Тm, соответствующей максимуму кривой ТСЛ и полуширины пика
m [116]. При квазимономолекулярной кинетике Ез определяется следующим образом:
kT 2
![]() E
m
E
m
З
(2.7)
m
и при бимолекулярной кинетике
2kT 2
3![]()
m
(2.8)
Если не определен тип кинетики свечения, глубину ловушки можно определить:
E3
2,8kT 2
![]()
m
(2.9)
где =
m (Tm Tн ) ; Т
и Тв
–температуры, соответствующие половине
н![]()
высоты пика ТСЛ на низкотемпературной и высокотемпературной сторонах;
m–полуширина пика ТСЛ.
Принимая во внимание, что при высвобождении зарядов из глубоких и из
неглубоких ловушек
Tв Tm Tm Tн , а при высвобождении только из одного
вида ловушек соотношение будет обратное, то формула (2.9) дает результат, близкий к получаемому по формулам (2.7) и (2.8) [117].
В работе [116] авторами были предложены закономерности определяющие
вероятность высвобождения зарядов тепловыми колебаниями находящихся наиболее глубоко.
w0 для ловушек
w0
eTm / m
![]() m
m
(2.10)
и для случая большей вероятности повторных захватов:
w0
eTm / m
![]() m
m
2з N
![]()
p n0
(2.11)
где – скорость нагрева кристалла; P
и 3
– эффективные сечения
рекомбинации электронов с центрами свечения и локализации электронов на
центрах захвата; N – число уровней захвата; n0
свечения при температуре возбуждения T T0 .
- число ионизованных центров
Методика проведения эксперимента
Исследование спектральных характеристик кристаллов сульфатов щелочных металлов проводилось на специализированном комплексе термоактивационной спектроскопии для измерения рентгено-, фотолюминесценции, фотостимулированной люминесценции, принципиальная схема которого представлена на рисунке 2.3.
Установка состоит из азотногокриостата, кристаллодержателя
(поворачивающегося вокруг своей оси на
360o ) к которому крепится образец,
термопары, источника рентгеновского излучения - УРС-55, водородной лампы, двух монохроматоров МДР-41 с полностью компьютерным управлением при помощи аналогово-цифровых преобразователей, двух персональных компьютеров, предназначенных для управления процессом измерения и записи данных, фотоэлектронного умножителя - ФЭУ 100, милливольтметра, необходимого для измерения напряжения на термопаре и вакуумной системы, состоящей форвакуумного и абсорбционного насосов.
Источником рентгеновских лучей является настольный рентгеновский аппарат типа УРС–55 А с трубкой типа БСВ. Криостат имеет четыре окна, три из которых сделаны из кварца, а одно изготовлено из оксида бериллия и служит входным окном для рентгеновского излучения.

1 – азотный криостат,
2. – образец,
– термопара,
– источник рентгеновского излучения - УРС-55, 5 – водородная лампа,
– Монохроматор МДР-41,
– Аналогово-цифровой преобразователь, 8 – персональный компьютер,
9 – ФЭУ-100,
– милливольтметр,
– абсорбционный насос, 12 – форвакуумный насос.
Рисунок 2.3 - Принципиальная схема комплекса термоактивационной спектроскопии для измерения рентгено-, фотолюминесценции, фотостимулированной люминесценции сульфатов щелочных металлов
Для проведения экспериментальных исследований кристаллы сульфатов щелочных металлов закрепляется на кристаллодержателе. Кристаллодержатель помещается в криостат, криостат герметично закрывается. Включается вакуумная система. При атмосферном давлении внутри криостата, откачка газов производиться форвакуумным насосом. При достижении значения
давления в криостате менее
104 Па система переводится на откачивание
абсорбционным насосом. Через 15-20 минут, когда давление остаточных газов в
объеме криостата становиться менее
106 Па, установка готова для проведения
необходимых исследовании. Остаточное давление внутри криостата измеряется вакуумной лампой ПМТ-4М.
Для проведения измерений спектров при низкой температуре, в криостат заливается жидкий азот и через 10-15 минут, температура образца стабилизируется и становится равной 77 К.
Измерение спектров фотолюминесценции и фотостимулированной люминесценции производиться по одному алгоритму. Кристалл располагается
так, чтобы его поверхность образовывала угол
45o
и с возбуждающим
излучением и с оптической осью регистрационной части измерительного комплекса. Длина волны возбуждающего света выставляется при помощи компьютера на возбуждающем монохроматоре для фотолюминесценции и фотостимулированной люминесценции в коротковолновой и длинноволновой области спектра, соответственно. Регистрация люминесценции проводилась в спектральном диапазоне 250-700 нм, при помощи ФЭУ-100.
Измерение спектров рентгенолюминесценции. В этом режиме измерения, кристалл располагается перпендикулярно к возбуждающим рентгеновским лучам. Регистрация люминесценции проводилась в спектральном диапазоне 250-700 нм, при помощи ФЭУ-100.
Для проведения измерений спектров термостимулированной люминесценции использовались два вида возбуждения. Образец охлаждался до температуры жидкого азота. При этой температуре производилось облучение кристалла в течение продолжительного времени. В зависимости от конкретного кристалла и интенсивности его свечения, время облучения занимало от 30 минут до 2 часов. По истечении необходимого времени, облучение останавливалось, кристалл поворачивали облученной стороной к выходному окну криостата. Это достигается при помощи вращения кристаллодержателя вокруг своей оси без вскрытия криостата на атмосферу.
Далее включается регистрационная часть спектроскопического комплекса и начинается нагрев объекта. Нагревание осуществляется печкой, питаемой постоянным напряжением в 18 В, скорость нагрева 0,2 град/с и является псевдолинейной.
Скорость нагрева выбрана с тем учетом, что при данной скорости происходит высвобождение зарядов с разных ловушек. Люминесценция кристалла регистрируется фотоэлектронным умножителем ФЭУ-100. Ход кривой нагрева контролируется медь-константановой термопарой. Один конец, которой закреплен на кристаллодержателе, другой конец - опущен в сосуд с тающим льдом.
Для измерения спектрального состава пиков термостимулированной люминесценции был использован монохроматор МДР-41, размещенный перед фотоэлектронным умножителем.
Для подтверждения спектров фотолюминесценции измеренных на комплексе термоактивационной спектроскопии, часть спектров были повторно измерены на cпектрофлуориметре Solar СМ 2203. Эта установка дает возможность проведения экспериментальных исследовании по измерению спектров фотолюминесценции, спектров возбуждения и спектров поглощения, твердотельных образцов и растворов при комнатной температуре. Спектральный диапазон в режиме спектрометра от 200 до 820 нм, а в режиме спектрофотометра 200...1100 нм.
Внешний вид cпектрофлуориметра Solar СМ 2203 представлен на рисунке
2.4.

Рисунок 2.4 - CпектрофлуориметрСМ2203
Измерения спектров возбуждения в вакуумной ультрафиолетовой области проводилось на экспериментальной установке по измерению спектра возбуждения в вакуумной ультрафиолетовой области (Рисунок 2.5).

Рисунок 2.5 - Экспериментальнаяустановка по измерению спектра возбуждения в вакуумной ультрафиолетовой области
При измерении спектра возбуждения, из светового луча от водородной лампы с помощью вакуумного монохроматора ВМР-2 выделяется свет с определенной длинной волны, лежащей в области вакуумного ультрафиолета. Выделенный луч проходит через входное окно криостата, изготовленного из фторида магния, и попадает на поверхность кристалла. Криостат представляет собой вакуумную камеру из нержавеющей стали с тремя кварцевыми окнами для проведения оптических измерений и одним окном из фторида магния, которое служит входным окном для возбуждающего света в вакуумной ультрафиолетовой области.
Охлаждение образцов производится промышленной микрокриогенной системой МСМР-110Н-3,2/20, которая состоит из компрессора, охладителя и соединяющих их кабелей и трубопроводов. Эта система позволяет охлаждать образец до температур в диапазоне 12,5-300 К без применения жидкого гелия или азота. Охладитель имеет две ступени и крепится на верхнем фланце вакуумной камеры. К медному фланцу первой (верхней) ступени, температура которого составляет ~ 65 К,присоединен 1-й тепловойэкран,а к фланцу второй (нижней) ступени 2-й тепловой экран и медный кристаллодержатель. Держатель закрыт со всех сторон отполированными алюминиевыми пластинами, в которых имеются лишь отверстия для прохождения световых лучей. Аналогичные отверстия сделаны в тепловыхэкранах. Электроны проходят к образцу через тонкие алюминиевые фольги. Для создания хорошего теплового контакта в местах соединений используется теплопроводящая паста. Тепловые экраны и внутренняя поверхность камеры покрыты пленкой с высоким коэффициентом отражения. Такая конструкция гелиевого криостата позволила получить на образце температуру, соответствующую предельной температуре фланца второй ступени охладителя - 12.5 К [118].
Оценка точности измерительных приборов
Преобразователь манометрический термопарный ПМТ-4М предназначен для преобразования давления остаточных газов внутри кростата в электрический сигнал. Рабочий диапазон давлений (0,133-13,3) Па. Градуировачная кривая вакуумной лампы ПМТ-4М представлена на рисунке 2.6.
Измерение температуры образца проводилось при помощи дифференциальной медь-константановой термопары. Градуировочная кривая медь-константановой термопары приведена на рисунке 2.7. Как видно из градуировочной кривой погрешность измерений температуры образца при помощи медь-константановой термопары составляет (1-5) К. В литературе для данного вида термопары приведена ошибка (0,1-1) К[118].
Градуировка монохроматора проводилась по известным линиям ртутной лампы. Одному шагу шагового двигателя монохроматора соответствует изменение длины волны на 0,002 нм.
10
 1
1
0,1

0 2 4 6 8 10
Напряжение, мВ
Рисунок 2.6 - Градуировачная кривая вакуумной лампы ПМТ-4М
30
25
20
15
10
5
0
0 5 10 15 20 25 30 3
3
2
1
 0
0
75 125 175 225 275 325
-1
-2
-3
-4
-5
Температура, К
Рисунок 2.7 - Градуировачная кривая медь-константановой термопары
Выводы по второму разделу
Собран и модернизирован комплекс термоактивационной спектроскопии для измерения рентгено-, фотолюминесценции, фотостимулированной люминесценции сульфатов щелочных металлов.
Освоена методика измерения термостимулированной люминесценции, измерение спектров рентгенолюминесценции, фосфоресценции, спетров собственного излучения, измерение спектрального состава кривых ТСЛ, измерение фосфоресценции, измерение спектров создания пиков ТСЛ.
