304- Органическая химия_Черных В.П. и др_Х., 2007 -776с
.pdf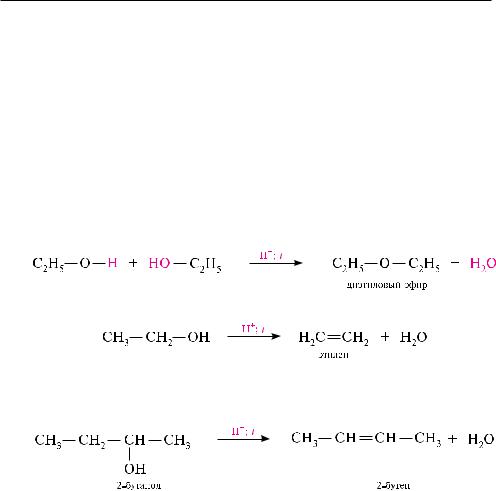
ГИДрОКСИлЬнЫе ПрОИЗВОДнЫе УГлеВОДОрОДОВ. ПрОСТЫе ЭФИрЫ
341
скорость реакции этерификации зависит от строения спирта и карбоновой кислоты. русским химиком н. а. Меншуткиным установлено, что при одной и той же кислоте скорость образования сложных эфиров уменьшается в ряду спиртов: первичный, вторичный, третичный. реакции спиртов с карбоновыми кислотами происходят по механизму нуклеофильного замещения (см. с. 431). выделяющаяся в процессе взаимодействия молекула воды образуется за счет атома водорода группы —OH спирта и гидроксильной группы карбоновой кислоты.
Дегидратация спиртов. При нагревании спиртов в присутствии концентрированной серной кислоты, безводной фосфорной кислоты или при пропускании паров спирта над катализатором алюминия оксидом Al2O3 спирты отщепляют воду, то есть подвергаются дегидратации. в зависимости от природы спирта
иусловий проведения реакции дегидратация может протекать межмолекулярно
ивнутримолекулярно.
При межмолекулярной дегидратации спиртов образуются простые эфиры:
в результате внутримолекулярной дегидратации образуются алкены:
внутримолекулярная дегидратация в ряду вторичных и третичных спиртов протекает согласно правилу Зайцева: протон отщепляется от соседнего, менее гидрогенизированного атома углерода.
Межмолекулярная и внутримолекулярная дегидратации спиртов представляют собой два конкурирующих процесса, из которых каждый в определенных условиях может стать доминирующим. отщепление воды от двух молекул спирта с образованием простых эфиров — межмолекулярная дегидратация — становится преобладающим процессом при нагревании спиртов в присутствии каталитических количеств минеральной кислоты (спирт в избытке) при температуре 140—160 °С.
Внутримолекулярная дегидратация, то есть превращение спирта в алкен, ста-
новится доминирующей при нагревании спиртов с избытком минеральной кислоты при температуре выше 170 °С. особенно легко она протекает в ряду третичных спиртов.
в случае пропускания паров спирта над Al2O3 при температуре 200—250 °с происходит межмолекулярная дегидратация с образованием простых эфиров, а при более высокой температуре (300—400 °с) протекает внутримолекулярная дегидратация, то есть образуются алкены.
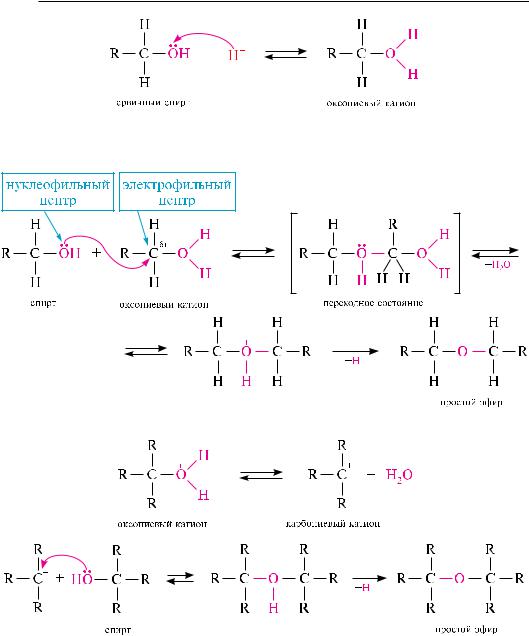
Межмолекулярная дегидратация спиртов протекает по механизму SN2 или SN1. При этом вначале молекула спирта под действием минеральной кислоты протонируется с образованием оксониевого катиона, а затем происходит замещение группы —OH:
Глава 22
342
Механизм SN2 включает образование переходного состояния, которое формируется в процессе нуклеофильной атаки электрофильного атома углерода оксониевого катиона второй молекулой спирта:
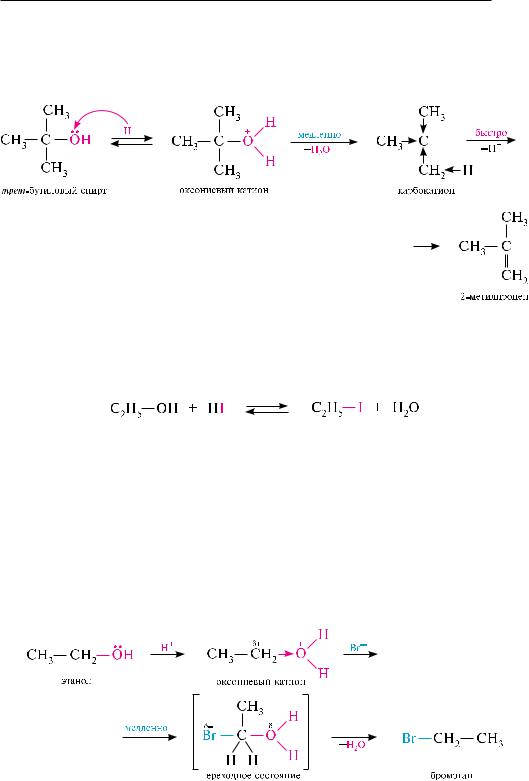
Механизм SN1 протекает через стадию образования карбониевого катиона:
Подобно галогеналканам, первичные спирты вступают в реакцию межмолекулярной дегидратации, как правило, по механизму SN2, третичные — по механизму SN1, вторичные могут реагировать как по SN2, так и по SN1-механизму.
Внутримолекулярная дегидратация спиртов в зависимости от их строения может протекать по механизму E1 и E2. Первичные спирты реагируют в большинстве случаев по механизму е2, а вторичные и особенно третичные — по механизму е1.
как и в случае нуклеофильного замещения, элиминирование спиртов протекает через стадию образования оксониевого катиона. лимитирующей стадией
ГИДрОКСИлЬнЫе ПрОИЗВОДнЫе УГлеВОДОрОДОВ. ПрОСТЫе ЭФИрЫ
343
процесса является расщепление этого катиона на молекулу воды и карбокатион. Элиминирование завершается быстрым отщеплением β-протона от карбокатиона под действием слабого основания (молекулы воды, спирта и др.) с образованием алкена.
схема внутримолекулярной дегидратации спирта по механизму е1:
Взаимодействие с галогеноводородными кислотами. При взаимодействии спир-
тов с галогеноводородными кислотами (HCl, HBr, HI) гидроксильная группа замещается на атом галогена и образуются галогеналканы. реакция является обратимой. для смещения равновесия вправо обычно из реакционной среды отгоняют воду или галогеналкан:
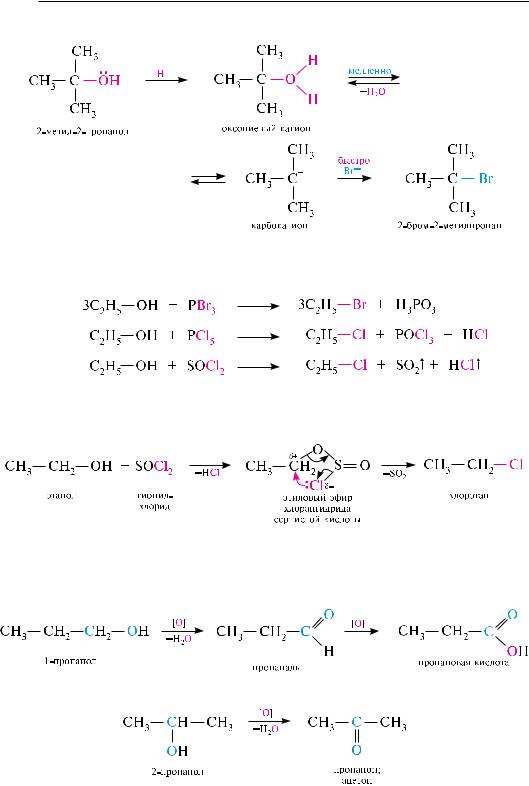
По реакционной способности со спиртами галогеноводородные кислоты распола-
гаются в ряд: HCl < HBr < HI. с йодоводородной и бромоводородной кислотами реакция протекает легко, с хлороводородной — значительно труднее. Первичные и вторичные спирты реагируют с хлороводородной кислотой только в присутствии цинка хлорида (кислота льюиса).
Реакционная способность спиртов по отношению к галогеноводородным кислотам убывает в ряду: бензиловый спирт аллиловый спирт третичные вторичные первичные. с первичными спиртами реакция протекает, как правило, по механизму SN2, с третичными — по SN1. вторичные спирты реагируют как по механизму SN1, так и по SN2. ниже приведены схемы взаимодействия спиртов с бромоводородной кислотой по механизму SN2 и SN1.
Механизм SN2:
ГИДрОКСИлЬнЫе ПрОИЗВОДнЫе УГлеВОДОрОДОВ. ПрОСТЫе ЭФИрЫ
345
третичные спирты устойчивы к окислению, однако в жестких условиях они окисляются с разрывом углеродного скелета молекулы и образованием смеси кетонов и карбоновых кислот.
вкачестве окислителей для окисления спиртов используют хрома (VI) оксид, калия дихромат в серной кислоте (хромовая смесь), калия перманганат в серной кислоте и др.
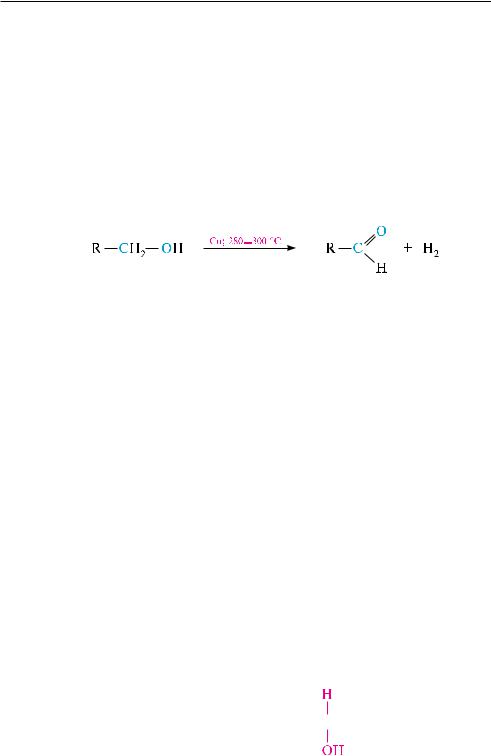
впромышленности для окисления первичных спиртов в альдегиды использу-
ют метод каталитического дегидрирования. сущность метода состоит в пропуска-
нии паров спирта над катализатором (мелкораздробленная медь) при 280—300 °с. Происходит отщепление молекулы водорода от молекулы спирта и образуется альдегид. Преимуществом каталитического дегидрирования является то, что предотвращается более глубокое окисление альдегида до кислоты:
вусловиях данной реакции из вторичных спиртов синтезируют и многие ке-
тоны.
22.1. . ИДенТИФИКаЦИя СПИрТОВ
химические методы. Для спиртов не существует качественной реакции, которая бы убедительно и однозначно указывала на наличие в молекуле гидроксильной груп-
пы. спирты можно отличить по их реакции окисления хромовым ангидридом CrO3 в водном растворе серной кислоты. Приблизительно в течение двух секунд прозрачный оранжевый раствор превращается в мутный голубовато-зеленый. однако эту реакцию не дают третичные спирты. данная реакция характерна также для альдегидов, но их можно отличить от спиртов другими специфическими реакциями (см. c. 398, 400, 407). реакция образования сложных эфиров RCOOR', имеющих характерный приятный запах, может служить для идентификации спиртов.
Первичные, вторичные и третичные спирты можно идентифицировать с помощью пробы Лукаса. она основана на различной скорости взаимодействия первичных, вторичных и третичных спиртов с раствором цинка хлорида в концентрированной хлороводородной кислоте (реактив лукаса). в результате образуется галогенопроизводное углеводорода, которое выделяется в виде мелкодисперсного осадка. взаимодействуя с реактивом лукаса, третичные спирты обнаруживаются почти сразу же, вторичные — приблизительно через 5 минут, а первичные спирты при комнатной температуре практически не реагируют.
спирты, имеющие в молекуле фрагмент 
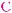

 , дают положительную
, дают положительную
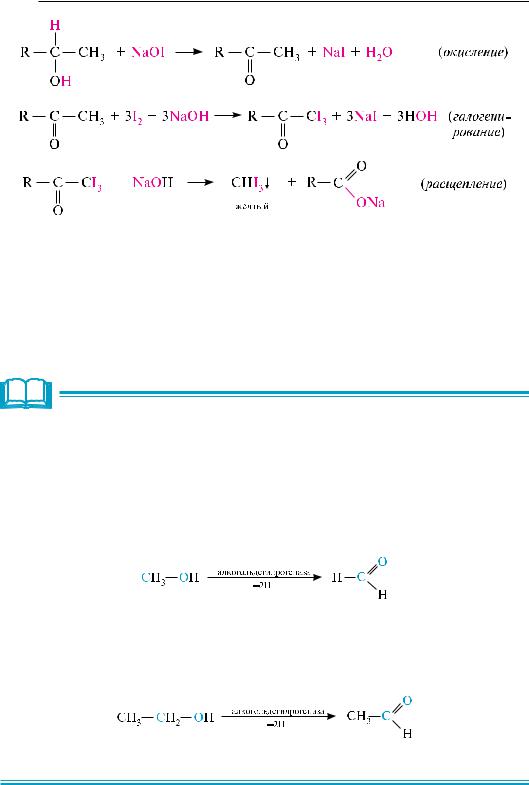
йодоформную пробу. она заключается в обработке спирта йодом и натрия гидроксидом или натрия гипойодитом NaOI:
Глава 22
34
в результате реакции образуется желтый осадок йодоформа CHI3, имеющий характерный запах. йодоформная проба не является строго специфической реакцией на спирты. Положительную йодоформную пробу также дают уксусный альдегид, метилкетоны (см. с. 406), β-дикетоны, оксимы, простые виниловые эфиры и др.
Физические методы. спирты, в молекуле которых отсутствуют хромофоры, не поглощают ультрафиолетовый свет с длиной волны более 200 нм. Электронные спектры ненасыщенных и ароматических спиртов характеризуются поглоще-
необычный антидот
Метиловый и этиловый спирты практически невозможно различить по запаху. употребление метилового спирта вовнутрь может стать причиной безвозвратной потери зрения, дыхательной недостаточности, судорог и смерти. антидотом, кажущимся на первый взгляд необычным, является этиловый спирт.
как известно, метаболизм спиртов происходит преимущественно в печени. фермент алкогольдегидрогеназа катализирует превращение спиртов в соответствующие альдегиды. При отравлении метанолом в организме образуется формальдегид, который, реагируя с белками, и вызывает вышеупомянутые симптомы.
сам метанол не опасен, но употребление его вовнутрь может стать фатальным! необходимо, как можно быстрее, ввести пострадавшему этанол с тем, чтобы успешнее конкурировать за фермент алкогольдегидрогеназу. сродство алкогольдегидрогеназы с этанолом по сравнению с метанолом в 25 раз больше! необходимо задействовать фермент в реакцию окисления этанола с образованием менее токсичного (но токсичного!) уксусного альдегида.
Это дает организму время вывести метанол без его окисления в потенциально смертельно опасный формальдегид.

ГИДрОКСИлЬнЫе ПрОИЗВОДнЫе УГлеВОДОрОДОВ. ПрОСТЫе ЭФИрЫ
347
нием за счет углеводородного радикала. Поэтому для анализа спиртов электронная спектроскопия используется крайне редко.
винфракрасных спектрах наиболее характерной является интенсивная широ-
кая полоса в области 3600—3200 см–1, обусловленная валентными колебаниями группы O—H. уширение этой полосы происходит в результате образования межмолекулярных водородных связей. в отсутствие водородных связей (разбавлен-
ный раствор спирта в неполярном растворителе CCl4) в ик-спектрах спиртов наблюдается узкая полоса в области 3640—3610 см–1. другая интенсивная широкая полоса, вызванная валентными колебаниями связи C—O, расположена в области
1200—1000 см–1.
вПМр-спектрах спиртов сигнал протона гидроксильной группы обычно обнаруживается в области 2,0—5,0 млн–1. величина химического сдвига зависит от степени ассоциации и прочности водородных связей. При уменьшении степени ассоциации, например, при разбавлении спирта четыреххлористым углеродом, сигнал протона OH-группы смещается в более сильное поле. в соответствии
сэтим положение сигнала гидроксильной группы сильно зависит от температуры, концентрации и природы растворителя. если в ик-спектрах наблюдаются полосы, обусловленные как колебаниями водородносвязанных, так и свободных гидроксильных групп, то в ПМр-спектрах спиртов наблюдается лишь один сигнал. Это связано с тем, что для регистрации ПМр-спектра необходимо больше времени, чем для ик-спектра. Поэтому фиксируется лишь один усредненный сигнал протонов OH-группы. При снятии ПМр-спектров в диметилсульфоксиде обмен протонами замедляется за счет возникновения сильных водородных связей между растворителем и спиртом. Это позволяет наблюдать расщепление сигнала гидроксильного протона за счет спин-спинового взаимодействия с соседними протонами и, таким образом, по мультиплетности сигнала устанавливать принадлежность к первичным (триплет), вторичным (дублет) или третичным (синглет) спиртам.
22.1.7. ОТДелЬнЫе ПреДСТаВИТелИ. ПрИмененИе
метанол CH3OH. бесцветная горючая жидкость с запахом, напоминающим запах этилового спирта, смешивается с водой во всех соотношениях (т. кип. 64,7 °с). ядовит, смертельная доза внутрь — 25 г, меньшие количества (~10 г) приводят к слепоте. При окислении в организме превращается в формальдегид и муравьиную кислоту. имеет значение как исходное соединение для синтеза органических веществ, как растворитель. до 1925 года метанол получали сухой перегонкой древесины, в настоящее время — каталитическим гидрированием углерода (II) оксида. реакция протекает при температуре 400 °с, давлении
250—400 атм:
Этанол с2н5он. бесцветная горючая жидкость с обжигающим вкусом и характерным запахом, смешивается с водой в любых соотношениях (т. кип. 78,3 °с).
внебольших количествах действует опьяняюще, большие дозы приводят к наркотическому состоянию. в организме окисляется до уксусного альдегида, а затем до углерода (IV) оксида и воды. широко используется как сырье и растворитель
ворганическом синтезе, в фармации и медицине (изготовление настоек, экст-
Глава 22
348
рактов, растворов), как обеззараживающее средство, для консервации различных анатомических препаратов, как горючее и др. входит в состав алкогольных напитков. для получения этанола с древнейших времен широко используется ферментативный гидролиз углеводов. в настоящее время этанол получают также гидратацией этилена:
с водой этанол образует азеотропную смесь (т. кип. 78,15 °с), состоящую из 95,572 % спирта. Поэтому выпускаемый в промышленности спирт-ректификат содержит около 96,6 % этанола. для получения безводного (абсолютного) этанола применяют специальные методы обезвоживания, такие как длительное нагревание с кальция оксидом, безводным меди (II) сульфатом или другими веществами, способными связывать воду химическим путем:
аллиловый спирт H2с=CH–CH2–OH. бесцветная жидкость с резким запахом (т. кип. 96,9 °с). смешивается с водой. используют в производстве глицерина. в промышленности получают из 3-хлорпропена:
Пропаргиловый спирт HC3C–CH2–OH. бесцветная жидкость со слабым запахом герани (т. кип. моногидрата 113,6 °с). с водой смешивается во всех соотношениях. образует азеотропную смесь, кипящую при 97 °с и содержащую 45 % пропаргилового спирта. Получают из ацетилена и формальдегида. используют в органическом синтезе.
Бензиловый спирт. бесцветная жидкость, плохо растворимая в воде, растворима в органических растворителях (т. пл. 15 °с, т. кип. 205 °с). содержится в эфирных маслах и бальзамах. относится к душистым ве- 
 ществам и используется в парфюмерии как фиксатор запаха, а также как растворитель для красителей, чернильных паст,
ществам и используется в парфюмерии как фиксатор запаха, а также как растворитель для красителей, чернильных паст,
казеина, восков и др.
22.2. двуХ-, ТреХ- и ПОлиаТОМные сПирТы
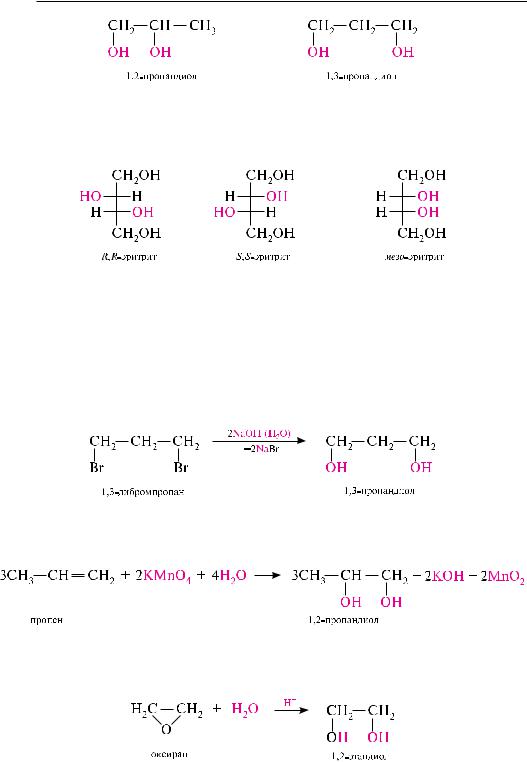
Двухатомные спирты (содержат две гидроксильные группы) называют диолами,
или гликолями.
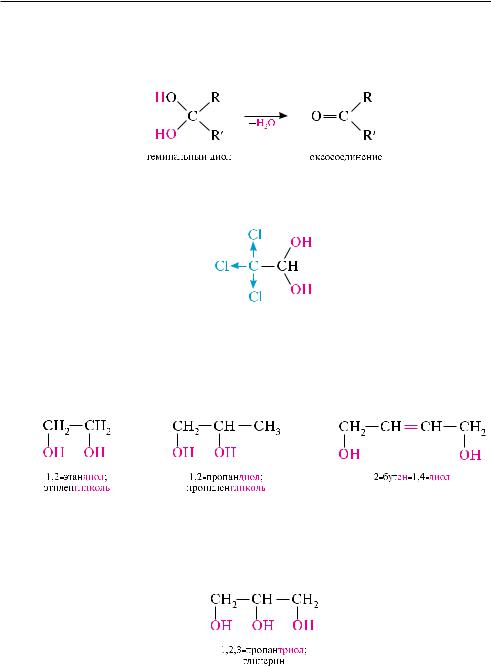
в зависимости от положения гидроксильных групп в углеродной цепи гликоли делят на -гликоли (гидроксильные группы находятся у соседних углеродных атомов, то есть в положении 1,2); -гликоли (он-группы в положении 1, 3); -гли- коли (он-группы в положении 1, 4) и т. д.:
ГИДрОКСИлЬнЫе ПрОИЗВОДнЫе УГлеВОДОрОДОВ. ПрОСТЫе ЭФИрЫ
34
-Гликоли еще называют вицинальными гликолями. Гликоли с гидроксильными группами при одном углеродном атоме (геминальные гликоли) — очень неустойчивые соединения. в момент образования они отщепляют молекулу воды и превращаются в альдегид или кетон:
такие диолы могут существовать только при наличии в молекуле сильных электроноакцепторных заместителей. так, хлоралгидрат является устойчивым соединением
По систематической номенклатуре IUPAC названия гликолей образуют, исходя из названия соответствующего углеводорода, добавляя суффикс -диол и цифровые локанты, указывающие положение гидроксильных групп в углеродной цепи.
По радикало-функциональной номенклатуре названия -гликолей производят от названия соответствующего двухвалентного радикала, к которому добавляют суф-
фикс -гликоль:
Трехатомные спирты (содержат три гидроксильные группы) называют триолами,
или глицеринами.
По заместительной номенклатуре названия трехатомных спиртов образуют путем добавления к названию соответствующего углеводорода суффикса -триол:
многоатомные спирты содержат более трех гидроксильных групп и их называют
полиолами.
так, четырехатомные спирты имеют общее название «эритриты», пятиатомные — «пентиты», шестиатомные — «гекситы» и т. д.
Структурная изомерия двух-, трех- и полиатомных спиртов обусловлена различным строением углеродного скелета и положением гидроксильных групп: