
304- Органическая химия_Черных В.П. и др_Х., 2007 -776с
.pdf
КаРБОНОВЫЕ КИСЛОТЫ. мОНОКаРБОНОВЫЕ КИСЛОТЫ
441
при нагревании с водным раствором щелочи подвергаются гидролизу, образуя аренкарбоновые кислоты:
Гидролиз нитрилов. В водных растворах кислот и щелочей нитрилы гидролизуются с образованием карбоновых кислот:
24.3.2. ФИЗИчЕСКИЕ СВОйСТВа
Ароматические монокарбоновые кислоты — бесцветные кристаллические вещества, некоторые из них имеют слабый приятный запах. Низшие гомологи малорастворимы в воде и перегоняются с водяным паром. Аренкарбоновые кислоты хорошо растворяются в этаноле и эфире.
24.3.3. ХИмИчЕСКИЕ СВОйСТВа
Реакционная способность аренмонокарбоновых кислот обусловлена наличием в их структуре карбоксильной группы и ароматического ядра.
По карбоксильной группе для них характерны реакции, свойственные насыщенным монокарбоновым кислотам (см. с. 429—433): образование солей, галогенангидридов, ангидридов, сложных эфиров и др.
Глава 24
442
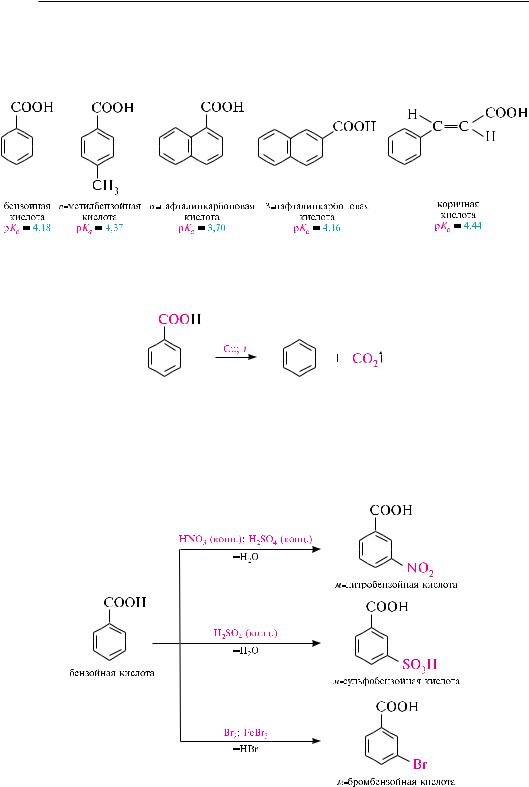
По кислотности ароматические монокарбоновые кислоты превышают насыщенные и ненасыщенные монокарбоновые кислоты алифатического ряда, что связано с повышением устойчивости аниона за счет делокализации заряда по сопряженной системе бензольного кольца. ниже приведены значения ркa некоторых кислот в воде (при 25 °с):
По мере удаления ароматического ядра от карбоксильной группы кислотность уменьшается.
При нагревании аренкарбоновых кислот в присутствии медного порошка или солей меди свыше 200 °с происходит декарбоксилирование:
За счет ароматического кольца аренмонокарбоновые кислоты вступают в реакции электрофильного замещения (нитрование, сульфирование, галогенирование), свойственные ароматическим углеводородам (см. подразд. 14.5.1). карбоксильная группа, проявляя –I- и –М-эффекты, дезактивирует ароматическое кольцо по отношению к электрофильным реагентам, поэтому реакции электрофильного замещения протекают значительно труднее, чем для незамещенных аренов. являясь заместителем II рода, карбоксильная группа направляет замещение в мета-положение:

КарБОнОВЫе КИСлОТЫ. мОнОКарБОнОВЫе КИСлОТЫ
443
24.3.4. ОТДелЬнЫе ПреДСТаВИТелИ. ПрИмененИе
с6н5—соон |
Бензойная кислота. белое кристаллическое вещество (т. пл. |
122 °с), легко возгоняется, плохо растворяется в воде, хорошо — |
в этаноле и бензоле. в виде сложных эфиров содержится в некоторых природных маслах, например в гвоздичном масле; в виде бензилового эфира входит в состав перуанского бальзама.
бензойную кислоту используют как исходное вещество в производстве красителей, душистых веществ, лекарственных средств. Применяют в медицине как антисептическое и противогрибковое средство. натриевая соль бензойной кислоты (натрия бензоат) применяется как отхаркивающее средство при бронхитах.
Фенилуксусная кислота. белое кристаллическое веще- с6н5–сн2–соон ство (т. пл. 77 °с). благодаря наличию активированной
метиленовой группы фенилуксусная кислота легко вступает в реакции конденсации с альдегидами, кетонами, ангидридами кислот и др.
используют в органическом синтезе для получения душистых веществ и лекарственных средств.
Коричная кислота (транс-3-фенилпропеновая кис- с6н5–сн=сн–соон лота). белое кристаллическое вещество (т. пл. 133 °с).
содержится в виде сложных эфиров в эфирных маслах, смолах, бальзамах. используют в синтезе душистых веществ и лекарственных средств.
24.4. иденТиФиКациЯ МОнОКарБОнОвыХ КислОТ
идентификация карбоновых кислот с помощью химических методов основана на особенностях химического поведения карбоксильной группы, в частности на способности к образованию труднорастворимых солей с тяжелыми металлами (Fe, Ag, Cu и др.) и достаточно легко идентифицируемых производных (амидов, сложных эфиров).
При действии карбоновых кислот на гидрокарбонаты щелочных металлов выделяется углерода (IV) оксид, образующий с баритовой водой белый осадок
BaCO3.
для идентификации ненасыщенных карбоновых кислот используют также реакционную способность кратной связи (обесцвечивание раствора калия перманганата, а также бромной воды или раствора брома в тетрахлорметане).
ароматические карбоновые кислоты могут быть обнаружены по образованию окрашенных продуктов замещения с участием бензольного ядра.
уф-спектры для алифатических монокарбоновых кислот малопоказательны, так как они поглощают в области ниже 220 нм. для ароматических кислот характерно смещение полосы «бензольного поглощения» (около 260 нм) в сторону более длинных волн (за счет удлинения цепи сопряжения).
в ик-спектрах карбоновых кислот для карбоксильной группы характерны две полосы поглощения: в области 3300—2500 см–1 ( OH для ассоциированных молекул) и 1720—1700 см–1 ( C=O). область валентных колебаний он-группы перекрывается с валентными колебаниями сн-групп (около 3000 см–1). для ароматических кислот характерным является поглощение ароматического ядра.

Глава 24
444
идентификацию карбоновых кислот с помощью масс-спектрометрии используют редко. для этой цели их переводят в летучие сложные эфиры, которые дают достаточно отчетливый пик молекулярного иона:
ПМр-спектры карбоновых кислот характеризуются сигналом протона карбоксильной группы, который расположен в слабом поле ( = 10…13 млн–1).

глава 25
диКарБОнОвые КислОТы
Дикарбоновыми кислотами называют производные углеводородов, содержащие в своем составе две карбоксильные группы.
25.1. насыЩенные диКарБОнОвые КислОТы
Насыщенными дикарбоновыми кислотами называют производные предельных углеводородов, содержащие в своем составе две карбоксильные группы.
25.1.1. нОменКлаТУра. ИЗОмерИя
в номенклатуре дикарбоновых кислот широко применяют тривиальные названия. По заместительной номенклатуре IUPAC названия дикарбоновых кислот образуют из названий родоначального углеводорода с добавлением суффикса
-диовая кислота.
в табл. 25.1 приведены названия важнейших представителей дикарбоновых кислот:
|
|
|
Таблица 25.1. |
|
названия дикарбоновых кислот |
|
|
|
|
|
|
соединение |
|
название кислоты по номенклатуре |
|
|
|
|
|
|
тривиальной |
заместительной |
|
|
|
||
|
|
|
|
HOOC—COOH |
|
Щавелевая |
Этандиовая |
|
|
|
|
HOOC—CH2—COOH |
|
Малоновая |
Пропандиовая |
HOOCCH(CH3)сOOH |
|
Метилмалоновая |
Метилпропандиовая |
HOOC(CH2)2COOH |
|
янтарная |
бутандиовая |
HOOC(CH2)3COOH |
|
Глутаровая |
Пентандиовая |
HOOC(CH2)4COOH |
|
адипиновая |
Гександиовая |
HOOC(CH2)5COOH |
|
Пимелиновая |
Гептандиовая |
HOOC(CH2)6COOH |
|
Пробковая |
октандиовая |
изомерия дикарбоновых кислот обусловлена разной структурой углеродного скелета молекулы.
25.1.2. СПОСОБЫ ПОлУЧенИя
дикарбоновые кислоты могут быть получены теми же методами, что и монокарбоновые кислоты. в качестве исходных веществ используют соответствующие бифункциональные соединения.
Окисление двупервичных гликолей, диальдегидов и гидроксикислот:

Глава 25
44
Гидролиз динитрилов:
25.1.3. ФИЗИЧеСКИе СВОЙСТВа
дикарбоновые кислоты — белые кристалические вещества, хорошо растворимые в воде. температуры плавления кислот с четным числом атомов углерода выше температур плавления соседних кислот с нечетным числом атомов углерода.
25.1.4. хИмИЧеСКИе СВОЙСТВа
дикарбоновые кислоты за счет наличия двух карбоксильных групп диссоциируют ступенчато, образуя анион (pKa1) и дианион (pKa2):
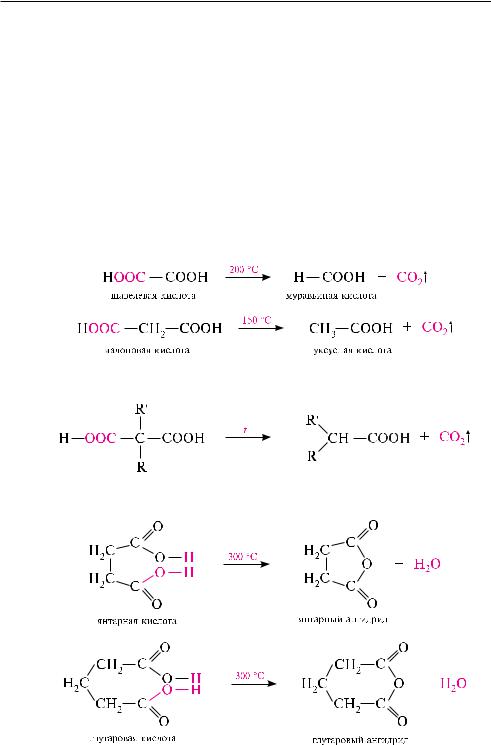
По первой ступени дикарбоновые кислоты обладают более сильными кислотными свойствами, чем монокарбоновые кислоты с аналогичным числом атомов углерода. Это обусловлено взаимным влиянием карбоксильных групп (–I-эф- фект). вторая карбоксильная группа, обладая электроноакцепторными свойствами, способствует делокализации заряда аниона и тем самым повышает его устойчивость. По мере удаления карбоксильных групп друг от друга их взаимное влияние ослабевает, вследствие чего кислотность по первой ступени снижается.
отрыв протона от второй карбоксильной группы происходит значительно труднее из-за низкой стабильности дианиона. Поэтому по второй ступени кислотность дикарбоновых кислот значительно ниже, чем по первой, особено для щавелевой и малоновой кислот. ниже приведены значения pKa (в H2O) для некоторых дикарбоновых кислот:


ДИКарБОнОВЫе КИСлОТЫ
44
данная реакция используется в аналитической практике (количественном анализе) для установления титра KMnO4:
5ноос–соон + 2KMnO4 + 3H2SO4 = 10CO2 + K2SO4 + 2MnSO4 + 8H2O
качественной реакцией для обнаружения щавелевой кислоты и ее растворимых солей является образование нерастворимой соли кальция оксалата:
ваналитической практике данную реакцию используют также для обнаруже-
ния ионов са2+.
Щавелевую кислоту используют для очистки металлов от ржавчины и накипи,
ав качестве протравы — в кожевенном производстве. Применяют также в синтезе
бриллиантового зеленого (см. с. 242).
малоновая кислота ноос—сн2—соон. белое кристаллическое вещество (т. пл. 135 °с), растворимое в воде, этаноле, эфире. содержится в соке сахарной свеклы. впервые была получена при окислительном декарбоксилировании яблочной кислоты:
внастоящее время малоновую кислоту получают гидролизом цианоуксусной кислоты:
соли и сложные эфиры малоновой кислоты называют малонатами.
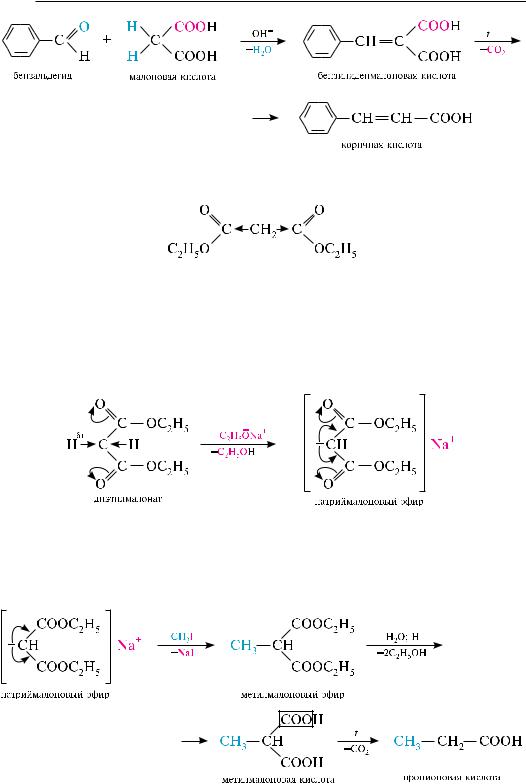
в результате электроноакцепторного влияния карбоксильных групп в молекуле малоновой кислоты атомы водорода метиленовой группы приобретают подвижность (сн-кислотность). Поэтому в присутствии оснований малоновая кислота способна образовывать не только дианион с участием двух карбоксильных групп, но и частично — трианион за счет ионизации активной метиленовой группы. с участием метиленовой группы малоновая кислота в присутствии оснований вступает в реакцию конденсации с альдегидами и кетонами, не содержащими атома водорода при атоме углерода в -положении (конденсация кнёвенагеля). в результате реакции образуются ненасыщенные монокарбоновые кислоты:
Глава 25
450
важным производным малоновой кислоты является ее диэтиловый эфир, получивший название «малоновый эфир».
в молекуле малонового эфира, как и в молекуле соответствующей кислоты, имеется активная метиленовая группа, за счет которой он вступает в различные реакции замещения. Малоновый эфир используется в органическом синтезе для получения моно- и дикарбоновых кислот. так, при действии на малоновый эфир натрия алкоголята атом водорода метиленовой группы замещается и образуется натриймалоновый эфир, в котором анион весьма устойчив вследствие делокализации заряда за счет карбоксильных групп:
натриймалоновый эфир легко алкилируется, ацилируется и реагирует с другими электрофильными реагентами. При алкилировании образуется алкилмалоновый эфир, который в процессе гидролиза превращается в алкилмалоновую кислоту. алкилмалоновые кислоты легко декарбоксилируются с образованием карбоновых кислот:
