
304- Органическая химия_Черных В.П. и др_Х., 2007 -776с
.pdf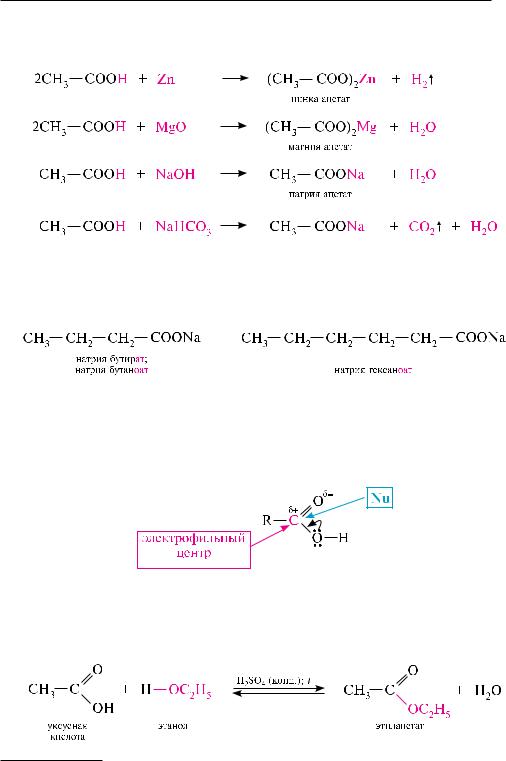
Глава 24
432
реакция этерификации обратима. образовавшийся сложный эфир в кислой среде подвергается гидролизу до исходных кислоты и спирта. для смещения равновесия в сторону образования сложного эфира либо используют избыток одного из реагентов (обычно спирта), либо удаляют из реакционной среды воду. легче всего сложные эфиры образуются из первичных спиртов и низших карбоновых кислот. вторичные спирты и высшие кислоты реагируют медленнее. третичные спирты, из-за пространственных препятствий, вступают в реакцию этерификации с большим трудом. кроме того, под действием минеральных кислот третичные спирты легко подвергаются внутримолекулярной дегидратации с образованием алкенов (см. с. 342). каталитическое действие серной кислоты состоит в активировании молекулы карбоновой кислоты. Механизм этерификации может быть представлен следующей схемой:
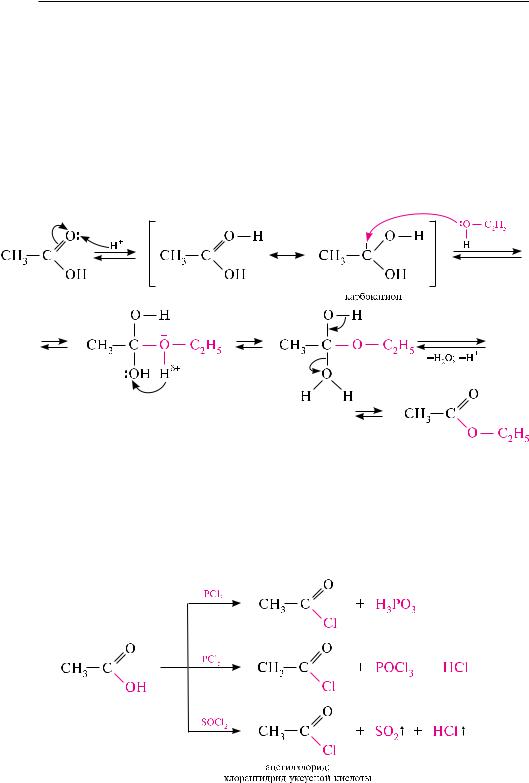
вначале карбоновая кислота протонируется по атому кислорода карбонильной группы. затем образовавшийся карбокатион присоединяет молекулу спирта с образованием промежуточного продукта, который отщепляет молекулу воды и протон (возврат катализатора), превращаясь при этом в сложный эфир.
Взаимодействие с галогенирующими реагентами (PCl3, PCl5, PBr3, PBr5, SOCl2).
При действии на карбоновые кислоты фосфора (III), фосфора (V) галогенидов, тионилхлорида или других галогенирующих реагентов образуются галогенангидриды карбоновых кислот:

КаРБОНОВЫЕ КИСЛОТЫ. мОНОКаРБОНОВЫЕ КИСЛОТЫ
433
Для получения хлорангидридов чаще используют тионилхлорид, так как в этом случае образуются газообразные побочные продукты.
Галогенангидриды карбоновых кислот — весьма реакционноспособные вещества, широко применяемые в органическом синтезе.
Образование ангидридов кислот. Карбоновые кислоты при нагревании в присутствии водоотнимающих средств фосфора (V) оксида Р2О5 или трифторуксусного ангидрида (CF3CO)2O подвергаются межмолекулярной дегидратации с образованием ангидридов:
Взаимодействие с аммиаком и аминами. При обработке карбоновых кислот аммиаком, первичными или вторичными аминами образуются аммониевые соли, которые при нагревании в сухом виде (пиролиз) отщепляют воду и превращаются в амиды:
Из-за жестких условий протекания реакции этот метод образования амидов редко используют в препаративных целях.
ЗамЕщЕНИЕ аТОмОВ ВОДОРОДа У -УГЛЕРОДНОГО аТОма
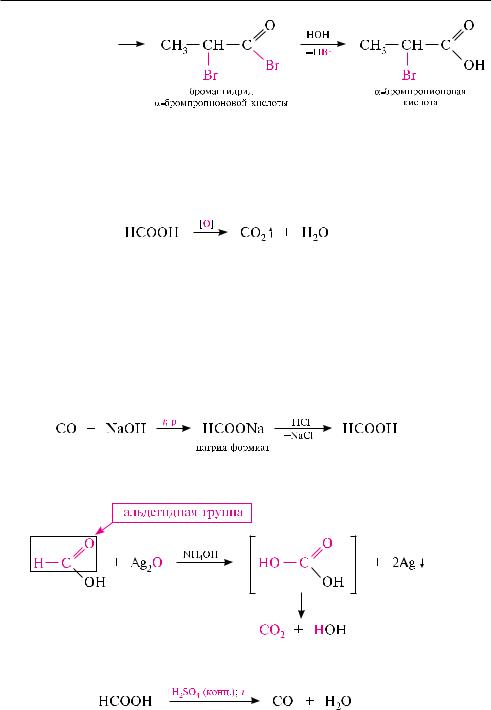
Вследствие электроноакцепторных свойств карбоксильной группы (–I-эф- фект) атомы водорода у -углеродного атома приобретают подвижность. Так, при обработке карбоновых кислот хлором или бромом в присутствии катализатора PCl3 или PBr3 атомы водорода у -углеродного атома замещаются на атом галогена:
Эта реакция известна как реакция Гелля — Фольгарда — Зелинского. При нали-
чии в -положении двух атомов водорода замещению может подвергаться один или оба атома водорода. Реакция протекает через стадию образования галогенангидридов кислот, которые галогенируются значительно легче, чем сами кислоты:
Глава 24
434
ОКИСленИе И ВОССТанОВленИе
Монокарбоновые кислоты, за исключением муравьиной, довольно устойчивы к действию окислителей. Муравьиная кислота легко окисляется KMnO4 и другими окислителями с образованием угольной кислоты, которая разлагается на углерода (IV) оксид и воду:
Монокарбоновые кислоты, в зависимости от условий, восстанавливаются до альдегидов или первичных спиртов.
24.1.5. ОТДелЬнЫе ПреДСТаВИТелИ. ПрИмененИе
муравьиная кислота (метановая кислота) HCOOH. бесцветная жидкость с резким запахом (т. пл. 8,4 °с, т. кип. 100,8 °с); растворима в воде, этаноле, эфире. в свободном состоянии содержится в выделениях желез муравьев, в крапиве.
Промышленный способ получения основан на взаимодействии углерода (II) оксида с натронной известью:
в связи с особенностью строения (наличие альдегидной группы) муравьиная кислота дает положительную реакцию «серебряного зеркала»:
При нагревании с концентрированной серной кислотой муравьиная кислота разлагается с образованием углерода (II) оксида и воды:
Реакции с аммиачным раствором серебра оксида и концентрированной серной кислотой являются качественными на муравьиную кислоту.
Муравьиная кислота широко используется в органическом синтезе, как протрава при крашении текстиля, в пчеловодстве против варроатоза, для получения

КарБОнОВЫе КИСлОТЫ. мОнОКарБОнОВЫе КИСлОТЫ
435
пестицидов и др. в медицине муравьиную кислоту применяют в виде 1 %-но- го спиртового раствора (муравьиный спирт) как растирку при невралгиях, миозитах и др.
Уксусная кислота (этановая кислота) CH3COOH. бесцветная жидкость с резким запахом, смешивается с водой, этанолом, эфиром. безводная («ледяная») уксусная кислота имеет т. пл. 16 °с, т. кип. 118 °с.
уксусная кислота нашла широкое применение как реагент и растворитель
ворганическом синтезе, 3—6 %-ные растворы применяют в качестве вкусовой приправы и консерванта. в больших количествах уксусная кислота используется
впроизводстве искусственных волокон на основе целлюлозы, а также в синтезе лекарственных препаратов (свинца ацетат, ацетилсалициловая кислота (с. 498), фенацетин (с. 384), парацетамол (с. 384) и др.).
Пропионовая кислота (пропановая кислота) CH3CH2COOн. бесцветная жидкость (т. кип. 141,1 °C), смешивающаяся с водой и органическими растворителями.
Получают окислением пропионового альдегида. используется в производстве витаминов, душистых веществ, гербицидов и др.
масляная кислота (бутановая кислота) CH3CH2CH2COOн. бесцветная вязкая жидкость с неприятным запахом (т. кип. 163,5 °с), растворимая в воде и спирте.
всвободном виде содержится в животных жирах, прогоркшем масле, в поте. Получают окислением 1-бутанола или масляного альдегида.
используется в синтезе душистых веществ, лекарственных средств, эмульгато-
ров и др. в виде сложного эфира с глицерином входит в состав коровьего масла. Валериановая кислота (пентановая кислота) CH3сн2CH2CH2COOн. Жидкость
(т. кип. 185,4 °с), растворима в воде. содержится в корне валерианы. Получают окислением амилового спирта.
Применяют для получения ароматизирующих веществ, в производстве лекарственных средств. 2-Пропилпентановая, или вальпроевая, кислота является противосудорожным средством (понижает возбудимость моторных центров мозга).
валериановой кислоте изомерна изовалериановая кислота (сн3)2снсн2соон, содержащаяся в свободном состоянии и в виде эфира в корнях валерианы. является исходным веществом в промышленном синтезе незаменимой -амино- кислоты L-валина. используют для получения ряда лекарственных препаратов
(бромизовал, валидол, карвалол, валокардин и др.).
24.2. ненасыЩенные МОнОКарБОнОвые КислОТы
Ненасыщенными монокарбоновыми кислотами называют монокарбоновые кисло-
ты, содержащие в углеводородном радикале кратную связь.
24.2.1. нОменКлаТУра. ИЗОмерИя
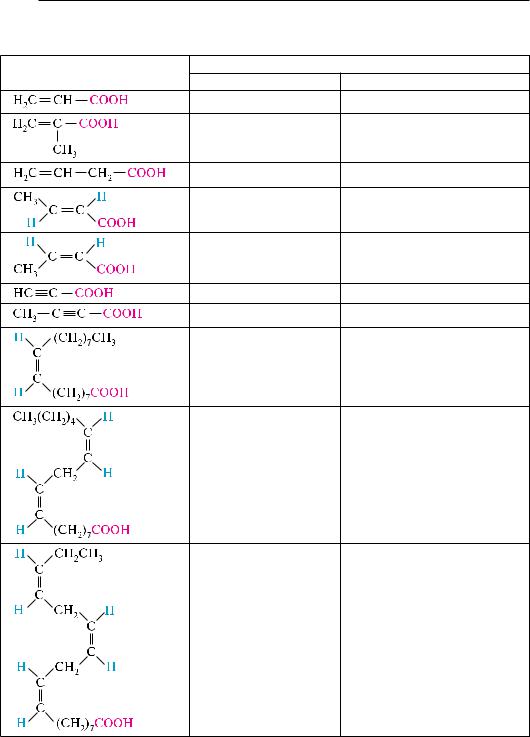
в номенклатуре ненасыщенных кислот широко применяются тривиальные названия. По заместительной номенклатуре IUPAC названия ненасыщенных кислот образуют аналогично насыщенным, используя суффикс -ен для обозначения двойной и суффикс -ин для обозначения тройной связи, с указанием положения кратной связи в углеродной цепи. названия некоторых ненасыщенных монокарбоновых кислот приведены в табл. 24.4.
43 |
|
Глава 24 |
|
|
|
||
|
|
Таблица 24.4 |
|
|
названия ненасыщенных монокарбоновых кислот |
||
соединение |
название кислоты по номенклатуре |
||
тривиальной |
заместительной |
||
|
|||
|
акриловая |
Пропеновая |
|
|
Метакриловая |
2-Метилпропеновая |
|
|
винилуксусная |
3-бутеновая |
|
|
кротоновая |
транс-2-бутеновая |
|
|
изокротоновая |
цис-2-бутеновая |
|
|
Пропиоловая |
Пропионовая |
|
|
тетроловая |
2-бутиновая |
|
|
олеиновая |
цис-9-октадеценовая |
|
|
линолевая |
цис-9-цис-12-октадека- |
|
|
диеновая |
||
|
|
||
|
линоленовая |
цис-9-цис-12-цис-15-окта- |
|
|
декатриеновая |
||
|
|
||
в зависимости от положения кратной связи по отношению к карбоксильной |
|||
группе различают - - - и другие ненасыщенные кислоты: |
|||
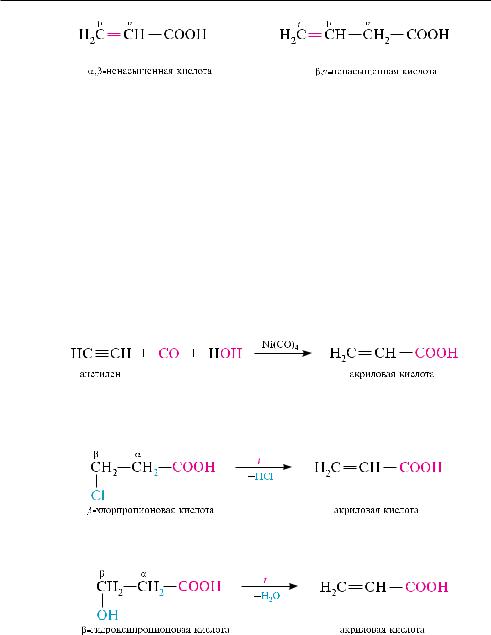
КарБОнОВЫе КИСлОТЫ. мОнОКарБОнОВЫе КИСлОТЫ
437
для ненасыщенных монокарбоновых кислот характерна структурная изомерия, обусловленная разной структурой углеводородного радикала и положением кратной связи, а также геометрическая изомерия, связанная с разным расположением заместителей относительно плоскости двойной связи.
24.2.2. СПОСОБЫ ПОлУЧенИя
для получения ненасыщенных монокарбоновых кислот можно использовать многие из методов синтеза насыщенных карбоновых кислот, применяя в качестве исходных веществ ненасыщенные соединения: окисление в мягких условиях ненасыщенных первичных спиртов и альдегидов, гидролиз нитрилов и др. кроме того, существуют специфические методы получения:
Гидрокарбонилирование алкинов (реакция Реппе). в присутствии карбонилов металлов алкины взаимодействуют с углерода (II) оксидом в водной среде с образованием -ненасыщенных монокарбоновых кислот:
Элиминирование -галогено- и -гидроксикарбоновых кислот. -Галогенокарбо-
новые кислоты при нагревании с водой отщепляют галогеноводород и превращаются в -ненасыщенные кислоты:
-Гидроксикарбоновые кислоты при нагревании отщепляют молекулу воды и превращаются в -ненасыщенные кислоты:
24.2.3. ФИЗИЧеСКИе СВОЙСТВа
в обычных условиях ненасыщенные монокарбоновые кислоты являются бесцветными жидкостями или кристаллическими веществами. низшие представители хорошо растворимы в воде, обладают резким раздражающим запахом. с увеличением молекулярной массы кислоты растворимость в воде снижается. высшие ненасыщенные кислоты не растворимы в воде и хорошо растворяются в органических растворителях.
Глава 24
438
24.2.4. хИмИЧеСКИе СВОЙСТВа
реакционная способность ненасыщенных монокарбоновых кислот обусловлена наличием в их структуре карбоксильной группы и кратной связи.
за счет карбоксильной группы ненасыщенные кислоты вступают в реакции, характерные для насыщенных кислот, в частности они образуют соли, галогенангидриды, ангидриды, сложные эфиры, амиды (см. с. 429—433). По кратной связи в углеводородном радикале ненасыщенные кислоты проявляют свойства алкенов (алкинов). так, для них характерны реакции присоединения, окисления и полимеризации (см. подразд. 10.5 и 12.4).
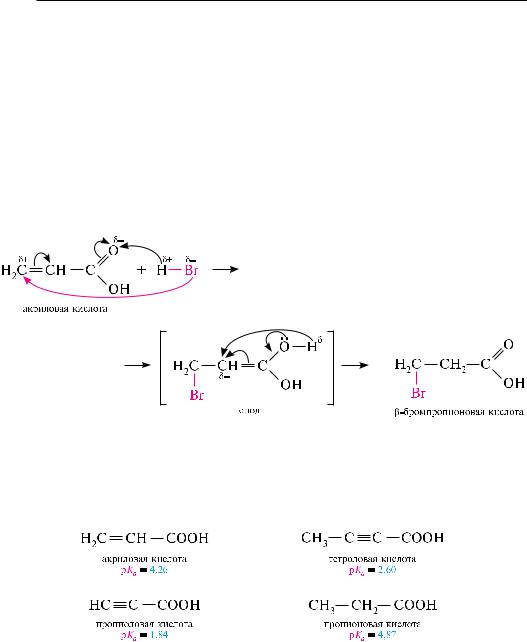
однако присоединение галогеноводородов к -ненасыщенным кислотам протекает против правила Марковникова, что объясняется электроноакцепторным влиянием карбоксильной группы (–I- и –M-эффекты):
-ненасыщенные кислоты, особенно с тройной связью, являются более сильными кислотами по сравнению с соответствующими насыщенными. Это объясняется повышением устойчивости образующегося аниона за счет делокализации заряда по сопряженной системе. ниже приведены значения ркa в воде (при 25 °с) некоторых ненасыщенных карбоновых кислот и пропионовой кислоты:
24.2.5. ОТДелЬнЫе ПреДСТаВИТелИ. ПрИмененИе
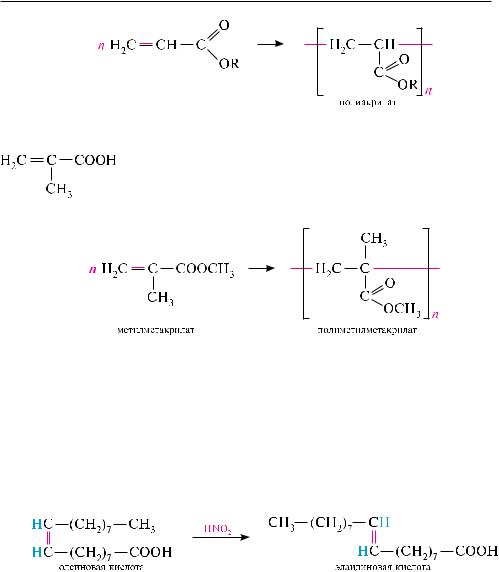
акриловая кислота н2с=сн—соон. бесцветная жидкость с резким запахом (т. пл. 13 °с, т. кип. 141 °с), хорошо растворяется в воде. акриловая кислота легко полимеризуется с образованием полиакриловой кислоты. важное практическое значение имеют полимеры на основе сложных эфиров акриловой кислоты
(полиакрилаты):
КарБОнОВЫе КИСлОТЫ. мОнОКарБОнОВЫе КИСлОТЫ
43
в медицине полиакрилаты находят применение при изготовлении зубных протезов.
метакриловая кислота (2-метилпропеновая кислота). бесцветная жидкость (т. кип. 160,5 °с). Метакриловая кислота легко полимеризуется. важное значение имеет метиловый эфир метакриловой кислоты, полимеризацией которого по-
лучают полиметилметакрилат — органическое стекло (плексиглас):
10-Ундеценовая кислота (ундециленовая кисло-
та). является противогрибковым средством. кислота и ее цинковая соль входят в состав антимикотических препаратов (микосептин, ундецин и др.).
Олеиновая кислота (цис-9-октадеценовая кислота). бесцветная маслянистая жидкость без вкуса и запаха. в виде сложных эфиров глицерина входит в состав расти-
тельных масел, особенно в оливковом, миндальном и подсолнечном маслах. олеиновая кислота является цис-изомером. При действии азотистой кислоты или уф-облучении олеиновая кислота изомеризуется в элаидиновую кислоту, являющуюся транс-изомером:
смесь этиловых эфиров олеиновой (~15 %), линолевой (~15 %) и линоленовой (~57 %) кислот входит в состав лекарственного препарата «линетол», который применяется в медицине для профилактики и лечения гипертонии и атеросклероза, а также при ожогах и лучевой болезни.
24.3. арОМаТиЧесКие МОнОКарБОнОвые КислОТы
Ароматическими карбоновыми (аренкарбоновыми) кислотами называют орга-
нические кислоты, в которых карбоксильная группа непосредственно связана с ароматическим ядром.
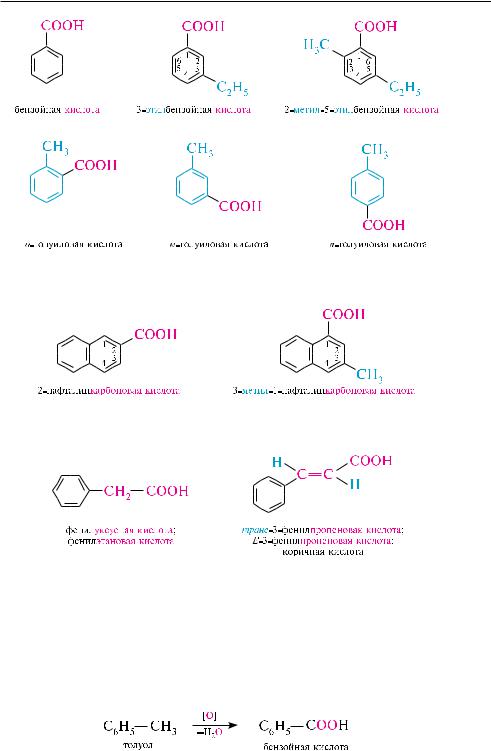
Простейшим представителем аренкарбоновых кислот является бензойная кислота. в соответствии с номенклатурными правилами IUPAC гомологи этого ряда рассматриваются как производные бензойной кислоты:
Глава 24
440
Метилбензойные кислоты имеют тривиальное название «толуиловые кислоты»:
названия карбоновых кислот нафталинового, антраценового, фенантренового и других рядов образуются из названия соответствующего углеводорода и суф-
фикса -карбоновая кислота.
карбоновые кислоты, в которых карбоксильная группа расположена в боковой углеродной цепи ароматического углеводорода, рассматривают как производные кислот алифатического ряда:
24.3.1. СПОСОБЫ ПОлУЧенИя
ароматические карбоновые кислоты могут быть получены теми же способами, что и алифатические кислоты.
Окисление алкиларенов. Этот метод является одним из наиболее часто применяемых для получения аренкарбоновых кислот. окислению подвергают главным образом метиларены. в качестве окислителей обычно используют KMnO4, CrO3 или кислород в присутствии солей кобальта и марганца:
Гидролиз тригалогенопроизводных ароматических углеводородов. ароматические тригалогеноуглеводороды, содержащие атомы галогена у одного атома углерода,
