
304- Органическая химия_Черных В.П. и др_Х., 2007 -776с
.pdf

Глава 25
452
в промышленности янтарную кислоту получают каталитическим гидрированием малеиновой кислоты:
соли и сложные эфиры янтарной кислоты называют сукцинатами. янтарная кислота, ее сложные эфиры и имид широко используются в орга-
ническом синтезе.
адипиновая кислота HOOC(CH2)4COOH. белое кристаллическое вещество (т. пл. 152 °с), малорастворимое в воде. соли и сложные эфиры адипиновой кислоты называют адипинатами. Применяется главным образом в производстве синтетического волокна — найлона. входит в состав противоглистного средства — пиперазина адипината (см. пиразин, подразд. 32.8.1). используется также в пищевой промышленности и органическом синтезе.
25.2. ненасыЩенные диКарБОнОвые КислОТы
Ненасыщенными дикарбоновыми кислотами называют соединения, содержащие в своем соcтаве две карбоксильные группы и кратную углерод-углеродную связь.
Простейшими представителями ненасыщенных дикарбоновых кислот являются малеиновая и фумаровая кислоты, которые представляют собой геометрические изомеры бутендиовой кислоты HOOC–CH=CH–COOH. Малеиновая кислота является цис-, а фумаровая — транс-изомером:
25.2.1. СПОСОБЫ ПОлУЧенИя
Малеиновую кислоту получают путем дегидратации яблочной кислоты при температуре 250 °с. Первоначально в этих условиях образуется малеиновый ангидрид, который в ходе последующей гидратации превращается в малеиновую кислоту:

ДИКарБОнОВЫе КИСлОТЫ
453
в промышленности малеиновую кислоту получают гидратацией малеинового ангидрида — продукта каталитического окисления бензола или 2-бутена кислородом воздуха:
фумаровая кислота, в отличие от малеиновой, встречается во многих растениях. синтетически может быть получена конденсацией глиоксиловой и малоновой кислот по кнёвенагелю:
в промышленности фумаровую кислоту получают термической изомеризацией малеиновой кислоты:
25.2.2. ФИЗИЧеСКИе СВОЙСТВа
малеиновая кислота представляет собой белое кристаллическое вещество (т. пл. 131 °с), легко растворяется в воде и спиртах. Фумаровая кислота — белое кристаллическое вещество, обычно возгоняется без плавления в запаянном капилляре (т. пл. 287 °с). фумаровая кислота в отличие от малеиновой трудно растворима в воде.
25.2.3. хИмИЧеСКИе СВОЙСТВа
ненасыщенные дикарбоновые кислоты проявляют более выраженные кислотные свойства по сравнению с насыщенными, поскольку взаимное влияние двух карбоксильных групп передается по сопряженной системе -связей эффективнее. Малеиновая кислота значительно сильнее фумаровой: значения pкa в воде для малеиновой кислоты равны pка1 = 1,92; pкa2 = 6,23, для фумаровой — соответ-

Глава 25
454
ственно pкa1 = 3,02; pкa2 = 4,32. Повышенная кислотность малеиновой кислоты по первой ступени и низкая кислотность по второй — обусловлены внутримолекулярным взаимодействием ионизированной и неионизированной карбоксильных групп (образование внутримолекулярной водородной связи).
за счет образования водородной связи, с одной стороны, повышается устойчивость аниона, а с другой — затрудняется отщепление протона от второй карбоксильной группы.
реакционная способность ненасыщенных дикарбоновых кислот обусловлена наличием в их структуре двух карбоксильных групп и кратной связи. с участием кратной связи возможны реакции присоединения. так, при гидрировании малеиновой и фумаровой кислот образуется янтарная кислота, при галогенировании — дигалогенянтарная кислота, присоединение галогеноводородов приводит к образованию моногалогенянтарных кислот, присоединение воды в присутствии минеральных кислот дает гидроксиянтарную (яблочную) кислоту. При окислении калия перманганатом образуется виноградная (мезовинная) кислота:

ДИКарБОнОВЫе КИСлОТЫ
455
ненасыщенные дикарбоновые кислоты по карбоксильным группам образуют кислые и средние соли, неполные и полные сложные эфиры, неполные и полные амиды.
Малеиновая кислота при нагревании легко подвергается внутримолекулярной дегидратации и образует циклический ангидрид:
фумаровая кислота из-за удаленности карбоксильных групп в пространстве ангидрида не образует.
Малеиновая кислота, являясь цис-изомером, более лабильна, чем фумаровая. Под действием брома, йода, галогеноводородов, азотистой кислоты она легко изомеризуется в более устойчивую форму — фумаровую кислоту. При облучении растворов фумаровой и малеиновой кислот уф-излучением образуется равновесная смесь, состоящая из 75 % малеиновой и 25 % фумаровой кислот.
25.3. арОМаТиЧесКие диКарБОнОвые КислОТы
Ароматическими дикарбоновыми (арендикарбоновыми) кислотами называют производные ароматических углеводородов, содержащие две карбоксильные группы, непосредственно связанные с ароматическим ядром.
наиболее важными представителями арендикарбоновых кислот являются
фталевая, изофталевая и терефталевая кислоты:
25.3.1. СПОСОБЫ ПОлУЧенИя
основным способом получения арендикарбоновых кислот является каталитическое окисление ксилолов кислородом воздуха. При окислении п-ксилола образуется терефталевая кислота:

Глава 25
45
При окислении о-ксилола сначала образуется фталевый ангидрид, который
вприсутствии воды превращается во фталевую кислоту:
впромышленности фталевую кислоту получают окислением нафталина кислородом воздуха в присутствии катализатора. образующийся в процессе окисления фталевый ангидрид гидролизуют:
25.3.2. ФИЗИЧеСКИе И хИмИЧеСКИе СВОЙСТВа
фталевые кислоты являются белыми кристаллическими веществами с высокими температурами плавления. фталевая и терефталевая кислоты малорастворимы в воде, изофталевая кислота — легкорастворима в воде.
фталевые кислоты, по сравнению с бензойной кислотой, проявляют более кислотный характер.
По химическим свойствам арендикарбоновые кислоты в целом не отличаются от ароматических монокарбоновых кислот. с участием одной или двух карбоксильных групп они образуют соли, сложные эфиры и амиды. Галогенангидриды образуются только по двум карбоксильным группам. Моногалогенангидриды

ДИКарБОнОВЫе КИСлОТЫ
457
фталевых кислот в момент образования внутримолекулярно реагируют с карбоксильной группой, образуя ангидриды или полимерные вещества.
фталевая кислота отличается от других изомеров способностью легко превращаться при нагревании в ангидрид:
фталевый ангидрид в больших количествах используется для получения эфиров — диметил- и диэтилфталата, применяемых в качестве пластификаторов; дибутилфталат используют как репеллент (отпугивающее средство против насекомых). При нагревании фталевого ангидрида с аммиаком образуется фталимид, нашедший широкое применение в органическом синтезе:
При конденсации фталевого ангидрида с фенолом образуется фенолфталеин. реакция протекает при нагревании в присутствии водоотнимающих средств
(H2SO4, ZnCl2):
фенолфталеин применяется в аналитической практике в качестве кислотноосновного индикатора (см. с. 245).
25.4. иденТиФиКациЯ диКарБОнОвыХ КислОТ
При идентификации дикарбоновых кислот принимаются во внимание их фи- зико-химические свойства. в основном это твердые кристаллические вещества с определенными температурами плавления, растворимые в воде. как и моно-

Глава 25
458
карбоновые кислоты, они образуют соли, сложные эфиры, амиды. вместе с тем некоторые из них образуют циклические ангидриды и имиды, а также способны декарбоксилироваться.
для определения некоторых дикарбоновых кислот существует и ряд специфических методов. так, сплав щавелевой кислоты и дифениламина окрашивает каплю спирта в синий цвет за счет образования красителя — анилинового синего.
уф-спектры дикарбоновых кислот, как и монокарбоновых, малопоказательны.
некоторые дикарбоновые кислоты в ик-спектре имеют две полосы поглощения, соответствующие валентным колебаниям карбонильной группы: щавелевая кислота — при 1710 и 1650 см–1, малоновая — при 1740 и 1710 см–1, янтарная — при 1780 и 1700 см–1. высшие члены гомологического ряда имеют лишь одну полосу поглощения карбонильной группы около 1700 см–1.
яМр-спектры дикарбоновых и монокарбоновых кислот аналогичны.

глава 26
ФунКциОналЬные ПрОиЗвОдные КарБОнОвыХ КислОТ
к важнейшим функциональным производным карбоновых кислот относятся
галогенангидриды, ангидриды, сложные эфиры, амиды, гидразиды, гидроксамовые кислоты, нитрилы и др.:
26.1. галОгенангидриды КарБОнОвыХ КислОТ (ацилгалОгениды)
Галогенангидридами карбоновых кислот называют производные карбоновых кис-
лот, в которых гидроксильная группа, входящая в состав карбоксильной группы, замещена на атом галогена (хлор, бром, реже — фтор и йод).
2 .1.1. нОменКлаТУра
названия галогенангидридов образуют из названий соответствующих кислот или ацильных групп и названия галогена:
Глава 26
4 0
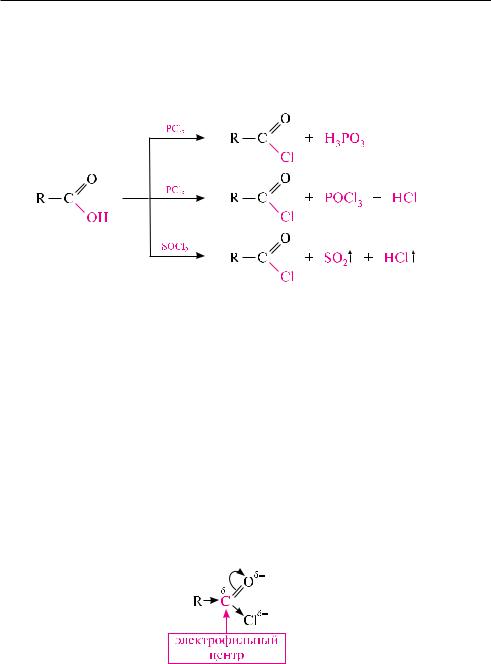
2 .1.2. СПОСОБЫ ПОлУЧенИя
хлорангидриды и бромангидриды получают взаимодействием карбоновых кислот с фосфора галогенидами (PCl3, PCl5, PBr3, PBr5) или тионилхлоридом
SOCl2 (см. c. 432):
2 .1.3. ФИЗИЧеСКИе СВОЙСТВа
Галогенангидриды карбоновых кислот представляют собой бесцветные жидкости или кристаллическкие вещества с резким запахом, легколетучие, раздражают слизистые оболочки и кожу.
2 .1.4. хИмИЧеСКИе СВОЙСТВа
Галогенангидриды являются весьма активными электрофильными реагентами. их электрофильные свойства обусловлены наличием дробного положительного заряда на атоме углерода карбонильной группы. в результате электроноакцепторных свойств атома галогена (–I-эффект) на атоме углерода карбонильной группы электронная плотность значительно снижается, поэтому галогенангидриды являются более сильными электрофильными реагентами, чем карбоновые кислоты.
ацилгалогениды легко вступают в различные реакции нуклеофильного замещания. так, под действием воды они гидролизуются до карбоновых кислот; со спиртами, алкоголятами и фенолятами образуют сложные эфиры; с аммиаком, первичными и вторичными аминами дают амиды; с гидразином, алкил- и арилгидразинами образуют гидразиды кислот; с гидроксиламином — гидроксамовые кислоты, с солями карбоновых кислот — ангидриды кислот:
