304- Органическая химия_Черных В.П. и др_Х., 2007 -776с
.pdf
ФУнКЦИОналЬнЫе ПрОИЗВОДнЫе КарБОнОВЫх КИСлОТ
4 1
Поскольку в процессе реакций нуклеофильного замещения в молекулу нуклеофильного реагента вводится ацильная группа, галогенангидриды являются
ацилирующими реагентами, а реакции называют реакциями ацилирования.
со слабыми нуклеофильными реагентами, такими, как арены, галогенангидриды реагируют в присутствии кислот льюиса (AlCl3, FeBr3, SnCl2 и др.). кислоты льюиса активируют молекулу ацилгалогенида за счет образования донорноакцепторного комплекса (n-комплекса) или иона ацилия:
ацилирование ароматических углеводородов по фриделю—крафтсу описано на с. 212.
ацилгалогениды, содержащие атомы водорода при -углеродном атоме, в присутствии сильных оснований (третичных аминов) отщепляют молекулу галогеноводорода, образуя кетены:
2 .1.5. ОТДелЬнЫе ПреДСТаВИТелИ. ПрИмененИе
ацетилхлорид CH3COCl. бесцветная жидкость с острым запахом (т. кип. 51,8 °с), быстро гидролизуется водой, растворяется в большинстве органических растворителей.
Глава 26
4 2
ацетилхлорид используют как ацилирующий реагент в производстве красителей и лекарственных средств.
Бензоилхлорид C6H5COCl. бесцветная жидкость с острым запахом (т. кип. 197,2 °с), раздражает слизистые оболочки дыхательных путей и глаз. бензоилхлорид хорошо растворим в эфире, бензоле, сероуглероде, гидролизуется водой.
Применяется для введения бензоильной группы в синтезе индигоидных красителей и лекарственных средств.
26.2. ангидриды КарБОнОвыХ КислОТ
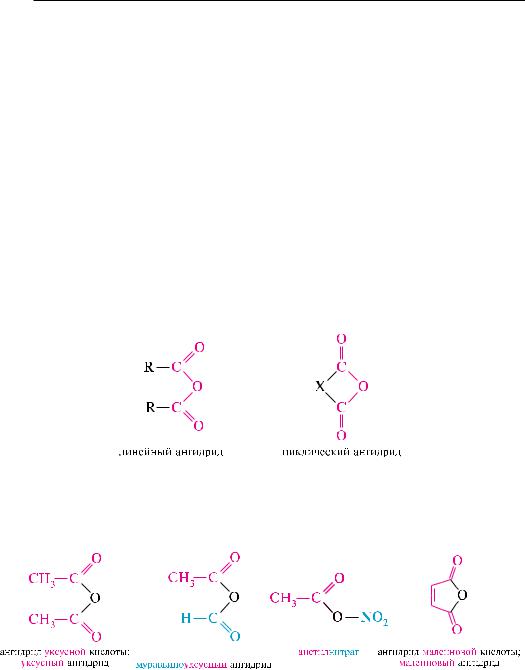
Ангидридами называют производные карбоновых кислот, у которых атом водорода карбоксильной группы замещен на ацильную группу.
2 .2.1. КлаССИФИКаЦИя. нОменКлаТУра
ангидриды являются продуктами дегидратации карбоновых кислот.
различают линейные и циклические ангидриды карбоновых кислот:
линейные ангидриды, в молекулу которых входят остатки разных кислот, в том числе и минеральных, называются смешанными ангидридами.
названия ангидридов образуют из тривиальных названий соответствующих кислот:
2 .2.2. СПОСОБЫ ПОлУЧенИя
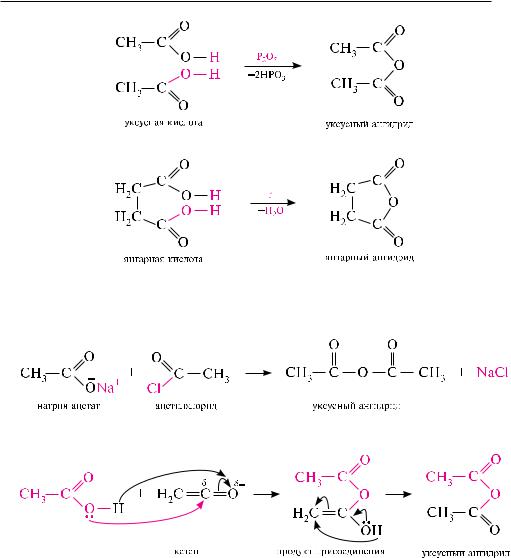
Дегидратация карбоновых кислот. Монокарбоновые кислоты при нагревании в присутствии сильных водоотнимающих средств (фосфора (V) оксид, трифторуксусный ангидрид и др.) подвергаются дегидратации с образованием ангидридов:
ФУНКЦИОНаЛЬНЫЕ ПРОИЗВОДНЫЕ КаРБОНОВЫХ КИСЛОТ
463
Многие дикарбоновые кислоты образуют циклические ангидриды при нагревании:
Взаимодействие галогенангидридов кислот с безводными солями карбоновых кислот. При обработке ацилгалогенидов натриевыми или калиевыми солями карбоновых кислот образуются ангидриды. Метод позволяет получить как простые, так и смешанные ангидриды:
Взаимодействие карбоновых кислот с кетенами. При взаимодействии карбоно-
вых кислот с кетенами образуются ангидриды:
Данный метод используется в промышленности для получения уксусного ангидрида.
26.2.3. ФИЗИчЕСКИЕ СВОйСТВа
Ангидриды карбоновых кислот представляют собой бесцветные жидкости или кристаллические вещества. Низшие представители гомологического ряда обладают раздражающим запахом. Ангидриды карбоновых кислот малорастворимы в воде и медленно с ней реагируют.
26.2.4. ХИмИчЕСКИЕ СВОйСТВа
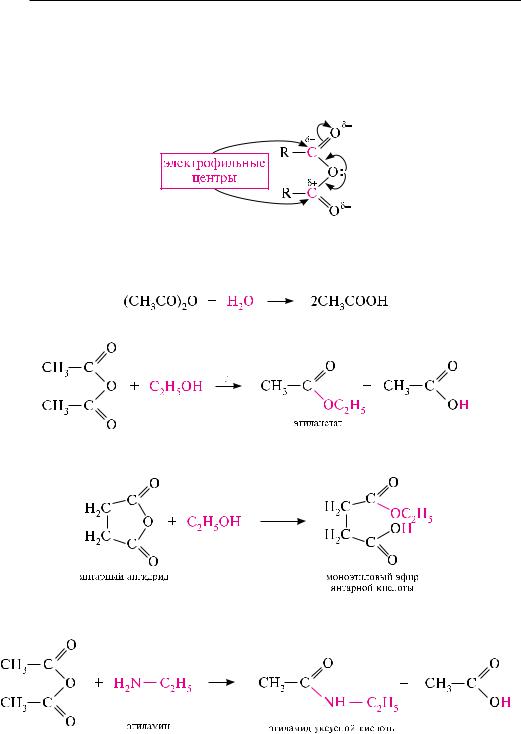
Ангидриды карбоновых кислот, подобно галогенангидридам, являются весьма активными электрофильными реагентами. Однако дробный положительный
ФУнКЦИОналЬнЫе ПрОИЗВОДнЫе КарБОнОВЫх КИСлОТ
4 5
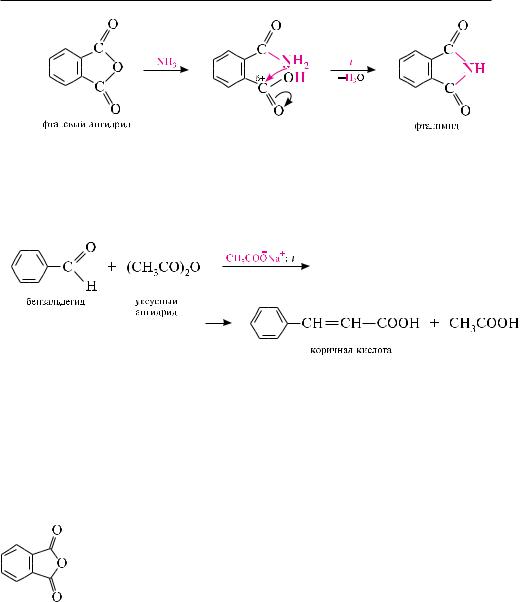
как и в случае карбоновых кислот, в молекулах ангидридов атомы водорода при -углеродных атомах подвижны. с участием связи с—н в -положении ангидриды карбоновых кислот в присутствии оснований (соли карбоновых кислот, третичные амины) вступают в реакцию конденсации с ароматическими альдегидами, образуя ненасыщенные аренкарбоновые кислоты (см. реакцию Перкина,
с. 418):
2 .2.5. ОТДелЬнЫе ПреДСТаВИТелИ. ПрИмененИе
Уксусный ангидрид (CH3CO)2O. бесцветная жидкость с резким запахом (т. кип. 140 °с), раздражает слизистые оболочки глаз и дыхательных путей, вызывает ожоги кожи. с водой медленно реагирует, образуя уксусную кислоту, растворяется в этаноле, эфире, бензоле, уксусной кислоте.
Применяется в качестве ацетилирующего реагента в производстве ацетилцеллюлозы, винилацетата, диметилацетамида, лекарственных средств (ацетилсалициловой кислоты и др.).
Фталевый ангидрид. белое кристаллическое вещество (т. пл. 130,8 °с), легко возгоняется, растворим в этаноле.
используют в синтезе лекарственных препаратов (фталазол, фтазин и др.), в производстве алкидных смол, пластификаторов, красителей.
26.3. слОжные эФиры КарБОнОвыХ КислОТ
Сложными эфирами называют функциональные производные карбоновых кислот, в которых гидроксильная группа, входящая в состав карбоксильной группы, замещена на остаток спирта или фенола —OR.
2 .3.1. нОменКлаТУра
обычно сложные эфиры называют по исходным кислоте и спирту или фенолу. По заместительной номенклатуре IUPAC их названия образуют из назва-

Глава 26
4
ния углеводородного радикала спирта или фенола и систематического названия карбоновой кислоты, в котором суффикс -овая кислота заменяется суффиксом
-оат:
2 .3.2. СПОСОБЫ ПОлУЧенИя
Взаимодействие карбоновых кислот со спиртами (см. с. 431):
фенолы из-за низкой нуклеофильности, связанной с сопряжением неподеленной пары электронов атома кислорода с -электронной системой ароматического ядра, в реакцию этерификации с карбоновыми кислотами не вступают
(см. с. 364).
Взаимодействие спиртов и фенолов с галогенангидридами и ангидридами кар-
боновых кислот. Галогенангидриды и ангидриды карбоновых кислот, являясь более активными электрофильными реагентами, чем карбоновые кислоты, легко реагируют со спиртами, фенолами или феноксидами щелочных металлов с образованием сложных эфиров:

ФУнКЦИОналЬнЫе ПрОИЗВОДнЫе КарБОнОВЫх КИСлОТ
4 7
реакция с феноксидами щелочных металлов идет значительно легче, чем с фенолами, поскольку феноксид-ион, за счет отрицательного заряда на атоме кислорода, обладает большей нуклеофильностью, чем неионизированный фенол:
алкилирование солей карбоновых кислот галогеналканами. При обработке со-
лей карбоновых кислот галогеналканами образуются сложные эфиры:
2 .3.3. ФИЗИЧеСКИе СВОЙСТВа
сложные эфиры карбоновых кислот являются бесцветными летучими жидкостями, реже — кристаллическими веществами с приятным запахом. они, как правило, малорастворимы в воде, хорошо растворяются в большинстве органических растворителей. температура кипения сложных эфиров обычно ниже температур кипения входящих в их состав карбоновых кислот, что связано с уменьшением межмолекулярного взаимодействия за счет отсутствия межмолекулярных водородных связей.
2 .3.4. хИмИЧеСКИе СВОЙСТВа
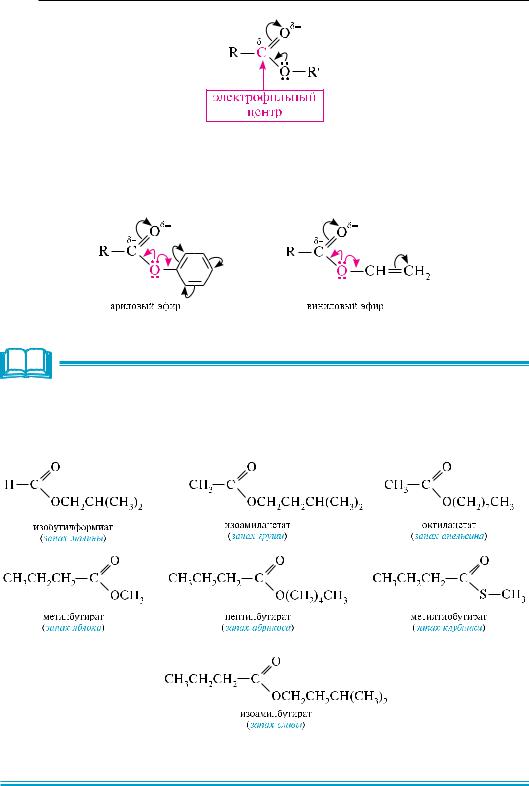
Подобно галогенангидридам и ангидридам карбоновых кислот, сложные эфиры являются электрофильными реагентами. Электрофильным центром служит атом углерода карбонильной группы. однако из-за + М-эффекта атома кислорода, связанного с углеводородным радикалом, сложные эфиры проявляют менее выраженный электрофильный характер по сравнению с галогенангидридами и ангидридами карбоновых кислот.

ФУнКЦИОналЬнЫе ПрОИЗВОДнЫе КарБОнОВЫх КИСлОТ
4
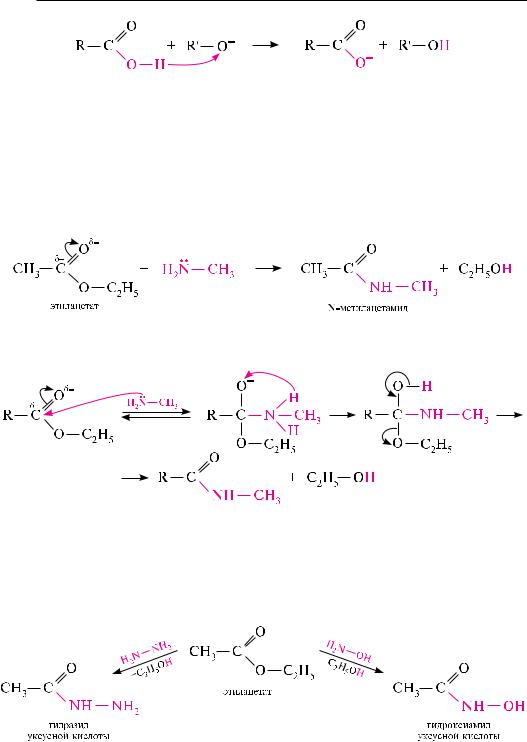
являясь электрофильными реагентами, сложные эфиры вступают в реакции нуклеофильного замещения. в частности, они реагируют с водой (гидролиз), спиртами (алкоголиз), гидразинами (гидразинолиз) и др.
Гидролиз сложных эфиров. сложные эфиры подвергаются гидролизу в кислой и щелочной среде.
кислотный гидролиз представляет собой последовательность обратимых превращений, противоположных реакции этерификации:
Механизм кислотного гидролиза включает протонирование атома кислорода карбонильной группы с последующим образованием карбокатиона, который затем реагирует с молекулой воды:
вприсутствии водных растворов щелочей сложные эфиры гидролизуются
собразованием соли карбоновой кислоты и спирта или фенола:
вотличие от кислотного гидролиза щелочной гидролиз сложных эфиров представляет собой необратимый процесс. его механизм заключается в нуклеофильной атаке гидроксид-ионом атома углерода карбонильной группы с образованием промежуточного аниона, который, отщепляя алкоксид-ион, превращается в мо-
лекулу карбоновой кислоты. на заключительной стадии реакции алкоксид-ион, обладая сильными основными свойствами, отрывает протон от образовавшейся молекулы кислоты и превращается в молекулу спирта: