
- •Глава 1. Введение
- •1.1. Термодинамика и ее метод
- •1.2. Параметры состояния
- •1.3. Понятие о термодинамическом процессе
- •1.4. Идеальный газ. Законы идеального газа
- •1.5. Понятие о смесях. Смеси идеальных газов
- •1.6. Понятие о теплоемкости
- •Глава 2. Первый закон термодинамики
- •2.1. Теплота. Опыт Джоуля. Эквивалентность теплоты и работы
- •2.2. Закон сохранения и превращения энергии
- •2.3. Внутренняя энергия и внешняя работа
- •2.4. Уравнение первого закона термодинамики
- •2.5. Энтальпия
- •2.6. Уравнение первого закона термодинамики для потока
- •Глава 3. Второй закон термодинамики
- •3.1. Циклы. Понятие термического КПД. Источники теплоты
- •3.2. Обратимые и необратимые процессы
- •3.3. Формулировки второго закона термодинамики
- •3.4. Цикл Карно. Теорема Карно
- •3.5. Термодинамическая шкала температур
- •3.6. Энтропия
- •3.7. Изменение энтропии в необратимых процессах
- •3.8. Объединенное уравнение первого и второго законов термодинамики
- •3.9. Энтропия и термодинамическая вероятность
- •3.10. Обратимость и производство работы
- •Глава 4. Дифференциальные уравнения термодинамики
- •4.1. Основные математические методы
- •4.2. Уравнения Максвелла
- •4.3. Частные производные внутренней энергии и энтальпии
- •4.4. Теплоемкости
- •Глава 5. Равновесие термодинамических систем и фазовые переходы
- •5.1. Гомогенные и гетерогенные термодинамические системы
- •5.2. Термодинамическое равновесие
- •5.3. Условия устойчивости и равновесия в изолированной однородной системе
- •5.4. Условия фазового равновесия
- •5.5. Фазовые переходы
- •5.7. Устойчивость фаз
- •5.8. Фазовые переходы при неодинаковых давлениях
- •Глава 6. Термодинамические свойства веществ
- •6.1. Термические и калорические свойства твердых тел
- •6.2. Термические и калорические свойства жидкостей
- •6.3. Опыт Эндрюса. Критическая точка. Уравнение Ван-дер-Ваальса
- •6.4. Термические и калорические свойства реальных газов. Уравнения состояния реальных газов
- •6.5. Термодинамические свойства веществ на линии фазовых переходов. Двухфазные системы
- •6.6. Свойства вещества в критической точке
- •6.7. Методы расчета энтропии вещества
- •6.8. Термодинамические диаграммы состояния вещества
- •6.9. Термодинамические свойства вещества в метастабильном состоянии
- •Глава 7. Основные термодинамические процессы
- •7.1. Изохорный процесс
- •7.2. Изобарный процесс
- •7.3. Изотермический процесс
- •7.4. Адиабатный процесс
- •7.5. Политропные процессы
- •7.7. Адиабатное расширение реального газа в вакуум (процесс Джоуля)
- •7.8. Процессы смешения
- •7.9. Процессы сжатия в компрессоре
- •Глава 8. Процессы течения газов и жидкостей
- •8.1. Основные уравнения процессов течения
- •8.2. Скорость звука
- •8.3. Истечение из суживающихся сопл
- •8.4. Переход через скорость звука. Сопло Лаваля
- •8.5. Адиабатное течение с трением
- •8.6. Общие закономерности течения. Закон обращения воздействий
- •8.7. Температура адиабатного торможения
- •9.1. О методах анализа эффективности циклов
- •9.2. Методы сравнения термических КПД обратимых циклов
- •9.3. Метод коэффициентов полезного действия в анализе необратимых циклов
- •Глава 10. Теплосиловые газовые циклы
- •10.1. Циклы поршневых двигателей внутреннего сгорания
- •10.2. Циклы газотурбинных установок
- •10.3. Циклы реактивных двигателей
- •Глава 11. Теплосиловые паровые циклы
- •11.1. Цикл Карно
- •11.2. Цикл Ренкина
- •11.3. Анализ цикла Ренкина с учетом потерь от необратимости
- •11.4. Цикл с промежуточным перегревом пара
- •11.5. Регенеративный цикл
- •11.6. Бинарные циклы
- •11.7. Циклы парогазовых установок
- •11.8. Теплофикационные циклы
- •Глава 12. Теплосиловые циклы прямого преобразования теплоты в электроэнергию
- •12.1. Цикл термоэлектрической установки
- •12.2. Цикл термоэлектронного преобразователя
- •12.3. Цикл МГД-установки
- •Глава 13. Холодильные циклы
- •13.1. Обратные тепловые циклы и процессы. Холодильные установки
- •13.2. Цикл воздушной холодильной установки
- •13.3. Цикл парокомпрессионной холодильной установки
- •13.4. Цикл пароэжекторной холодильной установки
- •13.5. Понятие о цикле абсорбционной холодильной установки
- •13.6. Цикл термоэлектрической холодильной установки
- •13.7. Принцип работы теплового насоса
- •13.8. Методы сжижения газов
- •Глава 14. Влажный воздух
- •14.1. Основные понятия
- •14.2. Н, d-диаграмма влажного воздуха
- •Глава 15. Основы химической термодинамики
- •15.1. Термохимия. Закон Гесса. Уравнение Кирхгофа
- •15.2. Химическое равновесие и второй закон термодинамики
- •15.3. Константа равновесия и степень диссоциации
- •15.4. Тепловой закон Нернста

Г л а в а 7. ОСНОВНЫЕ ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ
Так как для идеального газа внутренняя энергия зависит только от температуры и не зависит от объема, то в соответствии с уравнением (2.50)
du = cvdT
и, следовательно,
T1 |
|
u1(s, T1 ) – u2(s, T2 ) = ∫ cv dT . |
(7.73) |
T2 |
|
Таким образом, в соответствии с уравнением (7.63) |
|
T1 |
|
l1-2 = ∫ cv dT . |
(7.74) |
T2 |
|
Если пренебречь зависимостью теплоемкости cv идеального газа от темпера-
туры или воспользоваться понятием средней в данном интервале температур теплоемкости cv, то уравнение (7.74) может быть представлено в следующем виде:
l1-2 = cv(T1 – T2). |
(7.75) |
Подчеркнем еще раз, что уравнения (7.63), (7.66) и (7.67) применимы и для реальных веществ, и для идеальных газов, тогда как уравнения (7.68)—(7.75) справедливы только для идеальных газов.
К о л и ч е с т в о т е п л о т ы , подводимой к системе в изоэнтропном процессе,
равно нулю: |
|
q1-2 = 0; dq = 0. |
(7.76) |
И з м е н е н и е э н т р о п и и в изоэнтропном процессе также равно |
нулю. |
Естественно, что т е п л о е м к о с т ь изоэнтропного процесса равна нулю: |
|
cs = const = 0. |
(7.77) |
Этот вывод очевиден — если в системе осуществляется адиабатный процесс, то температура в системе изменяется, хотя теплота к системе и не подводится.
7.5. Политропные процессы
Политропными называют термодинамические процессы, удовлетворяющие
уравнению |
|
pvn = const |
(7.78) |
при произвольном, постоянном для данного политропного процесса значении п. Величину п называют п о к а з а т е л е м п о л и т р о п ы . Показатель политропы п для различных политропных процессов может принимать любые значения от +×
до –×.
Кривую политропного процесса в диаграмме состояния называют п о л и - т р о п о й .
Понятие о политропных процессах было введено в термодинамике по аналогии с понятием об адиабатных процессах. Уравнение политропного процесса (7.78) по внешнему виду сходно с уравнением адиабаты (7.51); однако существенная разница между этими уравнениями состоит в том, что если показатель изоэнтропы (адиабаты) k является в общем случае величиной переменной, то уже само понятие политропного процесса основано на предположении о том, что показатель политропы n является постоянной величиной. В политропном процессе к системе может подводиться (или отводиться от нее) теплота.
230

7.5. Политропные процессы
Понятие о политропных процессах широко используется главным образом при изучении процессов сжатия и расширения в газовых двигателях; зачастую политропные процессы оказываются удобными для аппроксимации действительных газовых процессов в двигателях. Реальные процессы сжатия в газовых двигателях и компрессорах часто не являются ни адиабатными, ни изотермическими, а занимают промежуточное положение между этими двумя видами процессов. Поэтому обычно встречаемые на практике значения показателя п политропного процесса лежат в интервале от 11) до k.
Для любых точек на политропе уравнение (7.78) можно записать в виде
p1vn1 = p2 vn2 .
Если политропный процесс осуществляется в идеальном газе, то из уравнения (7.78) и уравнения Клапейрона нетрудно получить:
T2 |
v1 |
n – 1 |
(7.79) |
|
----- |
= ------ |
|
; |
|
T1 |
v2 |
|
|
|
|
|
|
n – 1 |
|
T2 |
p2 |
|
----------- |
|
n |
(7.80) |
|||
----- |
= ------ |
|
. |
|
T1 |
p1 |
|
|
|
Эти уравнения, так же как и уравнение (7.78), устанавливают связь между р, v и Т в любых двух точках на политропе; уравнение (7.78) справедливо и для реального, и для идеального газов, тогда как уравнения (7.79) и (7.80) — только для идеального газа.
Помимо уже отмеченной нами технической целесообразности введение понятия политропного процесса представляет большую ценность и в методическом отношении. Понятие политропного процесса обобщает все остальные известные нам термодинамические процессы; нетрудно убедиться в том, что изохорный, изобарный, изотермический и адиабатный процессы представляют собой частные случаи политропных процессов.
В самом деле, из уравнения политропного процесса (7.78) очевидно, что политропный процесс с показателем n = 0 представляет собой обычный изобарный процесс
р = const.
Из уравнения (7.78), переписанного в виде p1/nv = const,
очевидно, что политропный процесс с показателем n = ±× — это изохорный процесс:
v = const.
Уравнение политропы с показателем n = k превращается в уравнение адиабаты Пуассона
pvk = const.
Наконец, уравнение политропы с показателем n = 1 — это уравнение идеального газа
pv = const
p 
n ß 0 — изобара
n ß 1 — изотерма n ß ä× — идеального газа
изохора
n ß k —
изоэнтропа
v
Рис. 7.8
1) Из уравнения (7.78) следует, что при n = 1 это уравнение совпадает с уравнением Бойля—Мариотта для изотермического процесса в идеальном газе (pv = const).
231

Г л а в а 7. ОСНОВНЫЕ ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ
[подчеркнем, что это уравнение справедливо только для изотермического процесса в идеальном газе; получить из уравнения политропы (7.78) уравнение изотермы реального газа нельзя. Конечно, процесс n = 1 в реальном газе возможен, но этот процесс не является изотермическим].
На рис. 7.8 представлена р, v-диаграмма, в которой нанесены кривые различных политропных процессов.
Р а б о т а р а с ш и р е н и я системы в политропном процессе между точками 1 и 2 определяется с помощью уравнения (3.1)
2
l1-2 = ∫ p dv .
1
Так как для политропы в соответствии с (7.78)
|
|
p |
1v |
n |
|
|
|
|
1 |
|
|
||
p |
= |
----------- |
, |
(7.81) |
||
|
n |
|
||||
v
то, интегрируя выражение для l1-2 (при интегрировании учтем, что p1vn1 — постоянная величина), получаем для работы расширения в политропном процессе:
l1-2 |
p1v1 |
|
|
v |
1 |
n – 1 |
|
, |
(7.82) |
|||
|
|
|||||||||||
= ------------ |
|
1 – |
----- |
|
|
|
||||||
|
n – 1 |
|
|
v |
2 |
|
|
|
|
|
|
|
или, что то же самое, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n – 1 |
|
|||
|
p1v1 |
|
|
p |
2 |
------------ |
|
|
|
|
||
l1-2 |
|
|
n |
. |
(7.83) |
|||||||
= ------------ |
|
|
1 – |
---- |
|
|||||||
|
n – 1 |
|
|
|
p |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
В случае идеального газа уравнения (7.82) и (7.83) можно преобразовать следующим образом:
l1-2 =
l1-2 = l1-2
l1-2
l1-2 =
|
|
|
v1 |
n – 1 |
|
|
|||
RT1 |
|
|
|
|
; |
||||
------------ |
|
1 – ------ |
|
|
|||||
n – 1 |
|
|
|
v2 |
|
|
|
||
|
|
|
|
|
|
|
n – 1 |
|
|
RT1 |
|
|
|
p2 |
|
------------ |
|
|
|
|
|
|
n |
; |
|||||
------------ |
|
1 – ------ |
|
|
|||||
n – 1 |
|
|
|
p1 |
|
|
|
||
R |
|
(T1 – T2 ) ; |
|||||||
= ------------ |
|||||||||
n – 1 |
|
|
|
|
|
|
|
||
p1v1 |
|
T |
2 |
||||||
= ------------ |
|
1 – ----- ; |
|||||||
n – 1 |
|
T |
|
|
|||||
|
|
|
|
|
|
1 |
|
|
|
1 |
|
(p1 v1 – p2v2 ) . |
|||||||
------------ |
|
||||||||
n – 1 |
|
|
|
|
|
|
|
|
|
(7.84)
(7.85)
(7.86)
(7.87)
(7.88)
Уравнения (7.82) и (7.83) справедливы для политропных процессов и в реальных, и в идеальных газах, а уравнения (7.84)—(7.88) — только для процессов
видеальных газах.
Ко л и ч е с т в о т е п л о т ы , подводимой к системе (или отводимой от нее) в политропном процессе, определяется следующим образом. Величину q можно определить с помощью уравнения первого закона термодинамики
q1-2 = (u2 – u1) + l1-2,
232

7.5. Политропные процессы
вычислив работу расширения системы [с помощью уравнений (7.82) и (7.83)] и рассчитав изменение внутренней энергии системы в политропном процессе между точками 1 и 2.
Разность внутренних энергий системы в точках 1 и 2 определяется обычным путем. Интегрируя соотношение (2.42)
du = |
∂u |
|
dT + |
∂u |
|
dv |
------ |
|
------ |
|
|||
|
∂T |
|
∂v |
|
||
|
|
v |
|
|
T |
|
в интервале состояний на политропе от точки 1 до точки 2 и учитывая при этом, что в соответствии с (4.25) и (2.44)
|
|
∂u |
|
|
|
|
∂u |
|
|
∂p |
|
|
|
|
|
|
|
||
|
|
------ |
|
= cv ; |
----- |
|
= T |
------ |
– p , |
|
|
|
|||||||
|
|
∂T |
∂v |
∂T |
|
|
|
||||||||||||
|
|
|
v |
|
|
|
|
T |
|
|
|
|
v |
|
|
|
|
|
|
получаем: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T2 |
|
v2 |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
u2(T2, |
v |
2 ) – u1 |
(T1, |
v |
1 ) = ∫ cv dT + ∫ |
|
|
∂p |
|
|
|
v |
|
|
|||||
|
|
|
|
|
|||||||||||||||
|
|
------ |
|
|
|
. |
(7.89) |
||||||||||||
|
|
|
T ∂T |
– p |
|
d |
|
||||||||||||
|
|
|
|
|
|
|
T1 |
|
|
|
|
|
|
v |
|
|
|
||
|
|
|
|
|
|
|
|
v1 |
|
|
|
|
|
|
|
||||
Для расчетов с помощью этого уравнения нужно знать параметры обеих точек на политропе: T1 и v1, T2 и v2.
Если мы имеем дело с политропным процессом в идеальном газе (следует заметить, что при расчете ряда политропных процессов в газовых двигателях и компрессорах идеально-газовое приближение оказывается вполне достаточным для технических расчетов), то уравнения для расчетов q1-2 могут быть при-
ведены к более простому виду. В самом деле, поскольку для идеального газа (∂u/∂v)T = 0, то
T2 |
|
u2 – u1 = ∫ cv dT ; |
(7.90) |
T1 |
|
если температурной зависимостью сv идеального газа можно пренебречь, то
и2 – и1 = сv(Т2 – Т1). |
(7.91) |
Воспользуемся теперь для подсчета q1-2 уравнением (2.31). Подставляя в него значение и2 – u1 из уравнения (7.91) и значение l1-2 из уравнения (7.86), получаем:
q |
|
|
= |
|
|
R |
(T |
|
– T |
|
) . |
(7.92) |
||
|
|
------------ – c |
|
|
||||||||||
|
1-2 |
|
n – 1 |
v |
|
1 |
|
|
2 |
|
|
|||
Поскольку в соответствии с уравнением Майера |
|
|
|
|
||||||||||
|
|
|
|
|
ср – cv = R, |
|
|
|
|
|
|
|
||
из (7.92) находим: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
cp |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
------------- |
|
|
|
|
|
|
|
|
q |
|
= c |
|
cv – n |
|
|
– T |
|
) . |
(7.93) |
||||
1-2 |
v |
------------------- (T |
1 |
2 |
||||||||||
|
|
|
|
n – 1 |
|
|
|
|
|
|
||||
Как показано в § 7.4, для идеального газа отношение теплоемкости ср к cv
представляет собой показатель изоэнтропы идеального газа |
|
kид = cp / cv. |
(7.55) |
233

Гл а в а 7. ОСНОВНЫЕ ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ
Сучетом этого уравнения выражение (7.93) преобразуется к виду
q |
|
= c |
k – n |
(T |
|
– T |
|
) . |
(7.94) |
1-2 |
------------ |
1 |
2 |
||||||
|
|
v n – 1 |
|
|
|
|
Это соотношение определяет количество теплоты, подводимой к идеальному газу (или отводимой от него) в политропном процессе.
Так как в соответствии с общим определением теплоемкости (1.69)
cx = |
dqx |
|
|
-------- |
, |
|
|
|
dT |
|
|
теплоемкость политропного процесса можно определить как |
|
||
сn = |
dqn |
, |
(7.95) |
-------- |
|||
|
dT |
|
|
очевидно, что |
|
|
|
dq = cndT |
(7.96) |
||
и |
|
|
|
|
2 |
|
|
q1-2 = ∫cn dT . |
(7.97) |
||
|
1 |
|
|
Если теплоемкость сn в рассматриваемом интервале параметров между точ-
ками 1 и 2 сохраняется постоянной, то из (7.97) получаем следующее уравнение для расчета количества теплоты, подводимой к системе в политропном процессе:
q1-2 = cn(T2 – T1). |
(7.98) |
Интересно отметить, что, поскольку для идеального газа в случае, когда его теплоемкость не меняется с температурой,
u2 – u1 = cn(T2 – T1)
[см. уравнение (7.91)], из этого соотношения и уравнения (7.98) можно получить:
u2 |
– u1 |
= |
cv |
. |
(7.99) |
|
----------------q1-2 |
----cn |
|||||
|
|
|
||||
Врассматриваемом нами случае, когда теплоемкость идеального газа не меняется
стемпературой, отношение cv /cn в данном политропном процессе остается постоян-
ным; следовательно, в соответствии с (7.99) в этом процессе
u |
(7.100) |
-------- = const. |
|
q1-2 |
|
Сравнивая уравнения (7.94) и (7.98), приходим к выводу о том, что фигури-
n – k |
|
------------ |
представляет собой |
рующий в правой части уравнения (7.94) комплекс cv n – 1 |
не что иное, как теплоемкость идеального газа в политропном процессе:
n – k |
|
------------ |
(7.101) |
cn = cv n – 1 . |
Проанализируем полученное соотношение для расчета политропной теплоемкости идеального газа.
При n = 0 получаем из (7.101):
cn = cv k,
или с учетом (7.55)
cn = cp;
полученный результат понятен: как показано выше, политропа с показателем n = 0 — это изобара.
234

7.5. Политропные процессы
При n = × из уравнения (7.101), представив его в виде
1 |
k |
– -- |
|
|
n |
cn = cv ------------ , |
|
1 |
1 |
– -- |
|
n
получим:
cn = cv;
это тоже очевидно, ибо политропа с показателем n = × представляет собой изохору.
При n = 1 в знаменателе правой части соотношения (7.101) появляется нуль и, следовательно,
сn = ±×;
напомним, что бесконечно большое значение имеет теплоемкость изотермического процесса.
Наконец, при n = k получаем:
сn = 0
—теплоемкость адиабатного процесса.
Интересно отметить, что, как видно из (7.101), при 1 < n < k теплоемкость сn
отрицательна. В этих процессах при расширении газ производит работу, значительно превышающую то количество теплоты, которое подводится к газу в процессе расширения. В этом случае на производство работы помимо тепла, подведенного к газу, расходуется и некоторое количество его внутренней энергии. Хотя к газу и подводится тепло, но оно целиком превращается в работу, а убыль внутренней энергии газа ведет к снижению его температуры. Таким образом, в данном случае мы имеем дело с весьма своеобразным процессом: тепло к системе подводится, но температура системы уменьшается. В соответствии с общим определением теплоемкости
dqn c = --------
n dT
мы приходим к выводу, что теплоемкость такого политропного процесса отрицательна.
На рис. 7.9 изображена зависимость теплоемкости политропного процесса сn от показателя политропы n.
И з м е н е н и е э н т р о п и и системы в политропном процессе, т.е. разность энтропий, соответствующих точкам 1 и 2 на политропе, определяется из соотношения
|
|
T2 |
|
|
|
|
|
|
|
||
s2 – s1 |
= |
|
|
|
|
∂s |
|
|
dT ; |
(7.102) |
|
∫ |
------ |
|
|
||||||||
|
|
∂T |
n |
|
|
||||||
|
|
T1 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||
поскольку очевидно, что |
|
|
|
|
|
|
|
|
|
|
|
|
∂s |
|
|
|
|
cn |
|
|
|
|
|
|
------ |
|
|
= |
---- |
, |
|
(7.103) |
|||
∂T |
n |
T |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
уравнение (7.102) приобретает следующий вид: |
|
||||||||||
|
|
|
|
T2 |
T |
|
|
|
|
|
|
|
|
|
|
∫ |
|
|
|
|
|
|
|
s2 – s1 |
|
|
|
|
cn |
|
|
|
|
|
|
= |
|
|
---- |
|
dT . |
(7.104) |
|||||
|
|
|
|
T1 |
|
|
|
|
|
|
|
235
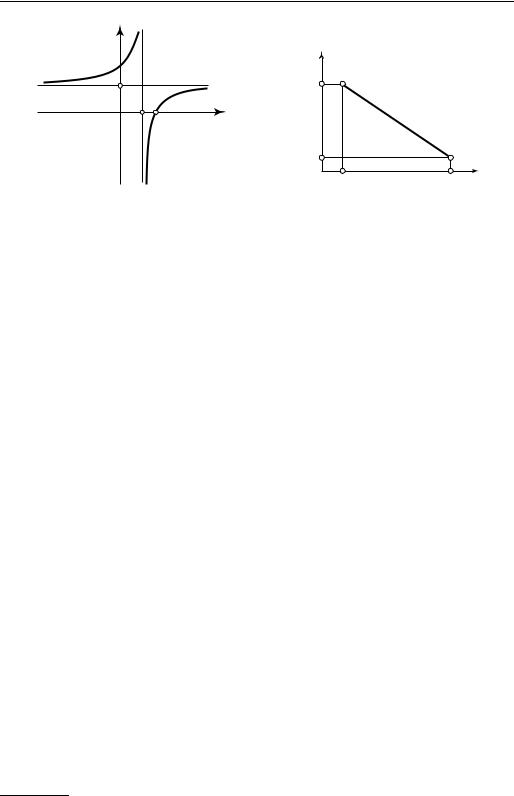
Г л а в а 7. ОСНОВНЫЕ ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ
cn
cp
cv
0 |
1 |
k |
n |
Рис. 7.9
lg p |
|
1 |
|
lg p1 |
|
lg p2 |
2 |
|
|
lg v1 |
lg v2 lg v |
|
Рис. 7.10 |
Если теплоемкость политропного процесса сn постоянна в данном интервале
параметров состояния, то уравнение (7.104) может быть записано следующим образом:
s2 – s1 |
T2 |
(7.105) |
= cn ln ----- . |
||
|
T1 |
|
Таким образом, температурная зависимость энтропии в политропном процессе имеет логарифмический характер1).
Для того чтобы определить значение показателя политропы для того или иного конкретного газового процесса, надо располагать экспериментальными данными для этого процесса. Удобнее всего использовать кривую процесса в р, v-диаграмме. Логарифмируя уравнение политропы
p1 vn1 = p2vn2 ,
получаем:
|
lg p |
1 |
– lg p2 |
|
n = |
------------------------------- |
|
||
lg v |
2 |
– lg v1 . |
(7.106) |
|
Нанеся кривую процесса на логарифмическую р, v-диаграмму (рис. 7.10), где эта кривая спрямляется, легко можно найти величину n для данной кривой процесса: как видно из (7.106), n представляет собой тангенс угла наклона этой линии в логарифмической р, v-диаграмме. Если в логарифмической р, v-диа- грамме кривая процесса не спрямляется полностью, а имеет некоторую кривизну, то эту линию в диаграмме lg p, lg v следует разбить на несколько прямолинейных участков, найти значение n для каждого из этих участков и затем вычислить среднее для всей линии значение n. Определив для данного реального процесса величину n, мы сможем воспользоваться полученными выше уравнениями для расчета работы расширения процесса l1-2, теплоты процесса q2-1, рассчитать температуру в любой точке процесса и т.д.
7.6. Дросселирование. Эффект Джоуля—Томсона
Из опыта известно, что если на пути струи газа или жидкости, протекающей по трубе или какому-либо другому каналу, встречается препятствие, приводящее к внезапному резкому сужению поперечного сечения струи, а затем сечение
1) Использованный способ вывода и полученное в результате уравнение (7.105) не применимы к процессу с n = 1 (изотермическому процессу); в этом случае в правой части уравнения (7.105) появляется неопределенность вида ×æ0.
236

7.6. Дросселирование. Эффект Джоуля—Томсона
струи увеличивается, то давление протекающего газа (жидкости) за препятствием всегда оказывается меньшим, чем перед ним. Такое препятствие называют местным сопротивлением.
Эффект падения давления струи рабочего тела в процессе протекания через сужения в канале называется д р о с с е л и р о в а н и е м , или мятием.
С процессом дросселирования приходится часто сталкиваться на практике, например при движении воды через неполностью открытый водопроводный кран или при движении воздуха через неполностью открытый воздушный шибер. В обоих случаях вследствие сопротивления дроссельного органа (крана или шибера) давление за ним уменьшается.
Выясним основные закономерности процесса дросселирования.
В процессе дросселирования к рабочему телу может подводиться теплота. Физически падение давления за местным сопротивлением обусловлено дис-
сипацией энергии потока, расходуемой на преодоление этого местного сопротивления.
Рассмотрим процесс течения газа (жидкости) через трубу, имеющую местное сопротивление, например диафрагму (рис. 7.11).
Сечение трубы до и после диафрагмы считаем одинаковым. Скорость потока до и после диафрагмы считаем пренебрежимо малой; это позволяет пренебречь значением кинетической энергии потока по сравнению с его энтальпией.
Адиабатное дросселирование. Рассмотрим в первую очередь такой процесс дросселирования, в котором к газу (жидкости) не подводится и от него не отводится теплота — так называемое адиабатное дросселирование. Считаем, что стенки трубы окружены идеальной теплоизоляцией, исключающей теплообмен с окружающей средой.
Рассмотрим массу газа, заключенного в данный момент между сечениями I (до местного сопротивления) и II (за сопротивлением) (рис. 7.11, а). Поскольку газ движется, то, естественно, зафиксированные нами сечения газа (или невесомые поршни) I и II перемещаются вдоль трубы. Площадь сечения трубы, т.е. площадь сечения этих условных поршней, обозначим Σ. Давление, удельный объем и температуру газа до диафрагмы обозначим p1, v1 и T1, после диа-
фрагмы — p2, v2, T2.
За некоторый промежуток времени поршень I переместится вдоль трубы на расстояние l1, поршень II — на расстояние l2; поскольку давление и плотность
газа за диафрагмой меньше, чем перед диафрагмой, очевидно, l2 > l1. Для того чтобы переместить поршень I на расстояние l1, нужно совершить работу, равную:
LI = p1l1Σ. |
(7.107) |
|
|
|
|
|
h |
|
p1 |
h |
p |
1 p2 p |
|
|
|
|
|
|
|
|
|
3 |
|||
I |
|
|
|
II |
|
1 |
2 |
T2 |
|
|
pn |
|
|
|
|
|
|
T1 |
|
|
|
|
h=const |
|
|
|
|
|
|
|
|
|
|
|
|
|
p1 |
v1 |
p2 |
v2 |
|
|
p2 |
|
|
|
|
|
T1 |
T2 |
|
|
|
|
|
|
|
||
l |
1 |
|
|
l |
2 |
2 ′ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
s |
|
|
s |
|
|
|
а) |
|
|
|
б) |
|
|
в) |
|
|
|
|
|
|
|
Рис. 7.11 |
|
|
|
|
|
237

Г л а в а 7. ОСНОВНЫЕ ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ
Обозначим:
V1 = l1Σ; |
(7.108) |
здесь V1 — объем газа, вытесненный поршнем I за рассматриваемый промежуток времени через диафрагму. Так как
V1 = v1G, |
(7.109) |
где G — масса газа, прошедшего через дроссель, a v1 —удельный объем газа до дросселирования, то
LI = p1v1G. |
(7.110) |
Аналогичным образом подсчитывается работа, которую производит, перемещаясь, поршень II против давления p2:
LII = p2v2G. |
(7.111) |
При перемещении рассматриваемой нами фиксированной массы газа за определенный промежуток времени совершается работа, равная разности работы LII, кото-
рую производит поршень II, и работы LI, которая производится над поршнем I:
L = LII – LI, |
(7.112) |
или в соответствии с (7.110) и (7.111): |
|
L = (p2v2 – p1v1)G. |
(7.113) |
Эта работа затрачивается на преодоление местного сопротивления, превращаясь в теплоту. Напомним, что величину (p2v2 – p1v1) принято называть
р а б о т о й п р о т а л к и в а н и я .
Мы рассматриваем адиабатное дросселирование, а в соответствии с уравнением (7.63) работа в адиабатном процессе может быть произведена только за счет уменьшения внутренней энергии системы. Следовательно,
L = (u1 – u2)G, |
(7.114) |
где u1 и u2 — внутренняя энергия единицы массы газа соответственно до диа-
фрагмы и после нее.
Приравнивая между собой правые части уравнений (7.113) и (7.114), получаем:
u1 + p1v1 |
= u2 + p2v2, |
(7.115) |
или, что то же самое, |
|
|
h1 |
= h2. |
(7.116) |
Мы получили важный вывод — уравнение (7.116) показывает, что в результате адиабатного дросселирования значения энтальпий рабочего тела до местного сопротивления и после него одинаковы.
Мы рассматриваем здесь состояния дросселируемого вещества до дросселя и за дросселем. Следует заметить, что при течении газа (жидкости) внутри дросселя энтальпия газа (жидкости) может изменяться; в самом деле, поскольку дроссель или другое местное сопротивление представляет собой сужение проходного сечения трубы, при протекании через дроссель газ (жидкость) ускоряется, его кинетическая энергия возрастает и, следовательно, энтальпия уменьшается. После того как за дросселем сечение потока газа (жидкости) снова возрастает, поток замедляется (тормозится), его кинетическая энергия уменьшается и энтальпия увеличивается до прежнего значения.
Для лучшего понимания физики процессов, происходящих в потоке при его дросселировании, следует обратиться к полученным ранее уравнениям первого закона термодинамики для потока.
238

7.6. Дросселирование. Эффект Джоуля—Томсона
Как показано в § 2.6, уравнение первого закона термодинамики для любого потока (и при отсутствии трения и при наличии его) имеет следующий вид [см. уравнение (2.81б)]:
d qвнеш = d h + wd w + gdz + dlтехн,
или в интегральной форме
qвнеш = (h2 – h1) + |
w22 – w12 |
|
------------------ + g(z2 – z1) + lтехн . |
(7.117) |
|
|
2 |
|
Очевидно, что в случае адиабатного (qвнеш = 0) горизонтального (z1 = z2) потока, скорость которого в рассматриваемых точках относительно мала (w1 ≈ w2 ≈ 0), при отсутствии технической работы (lтехн = 0), а именно такой поток рассматривается нами при анализе процесса дросселирования, уравнение (7.117) приобретает следующий вид:
h1 = h2,
что совпадает с выводом о неизменности энтальпии в результате адиабатного дросселирования, полученным нами ранее несколько иным путем.
Отсюда следует, что постоянство энтальпии является свойством любого — и обратимого, и необратимого — горизонтального адиабатного потока малой скорости, не совершающего технической работы, и, таким образом, вовсе не является «привилегией» дросселируемого потока. Следовательно, условие постоянства энтальпии само по себе не вскрывает особенностей, характерных только для процесса дросселирования.
Обратимся теперь к полученному в § 2.6 уравнению (2.85) для горизонтального потока с трением, не совершающего технической работы:
wdw = –vdp – dlтр.
Если скорость этого потока относительно мала, w ≈ 0 (а именно этот случай имеет место при дросселировании), получаем:
dlтр = –vdp, |
(7.118) |
т.е. давление вдоль потока падает (dp < 0) вследствие затраты потоком работы на преодоление трения (dlтр > 0 — работа, производимая потоком, положительна). Если бы трение отсутствовало, то давление вдоль потока оставалось бы постоянным.
Отсюда очевидно определенное сходство между процессами дросселирования и трения, хотя первый (в отличие от второго) характеризуется увеличением кинетической энергии потока за счет убыли энтальпии с последующим торможением и обратным переходом кинетической энергии потока в потенциальную, характеризуемую возрастанием энтальпии до ее первоначального значения; указанный процесс четко иллюстрируется h, s-диаграммой (рис. 7.11, б). Здесь 1—2′ отражает процесс уменьшения энтальпии в дросселе при падении давления от p1 до p2; 2′—2 — процесс торможения потока за дросселем, в результате которого кинетическая энергия потока уменьшается, а энтальпия восстанавливается до первоначального значения. В адиабатном потоке теплота, выделяющаяся при торможении потока, целиком усваивается рабочим телом. Таким образом, в рассмотренном типично необратимом процессе h1 = = h2, но dh ≠ 0. При дросселировании через пористую пробку имеет место каскад элементарных рассмотренных процессов (рис. 7.11, в), приближающийся к пределу dh = 0 при увеличении числа пор.
Закономерности, которые будут сформулированы ниже для процесса дросселирования при протекании газа (жидкости) через местное сопротивление, также справедливы и для обычного течения с трением, которое в свете сказанного можно рассматривать как дросселирование, «растянутое» по длине канала.
Может возникнуть вопрос: если адиабатный поток, как показано выше, совершает работу против сил трения или на преодоление местного сопротивления, то почему же его энтальпия сохраняется постоянной? Ведь, казалось бы, она должна уменьшаться, раз энергия потока затрачивается на совершение работы. Энтальпия этого адиабатного потока сохраняется постоянной потому, что работа, совершаемая потоком
239

Г л а в а 7. ОСНОВНЫЕ ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ
(за счет его внутренней энергии) против сил трения, lтр превращается, как было отмечено в § 2.6, в теплоту трения qтр , которая усваивается потоком. Это видно из уравнения первого закона термодинамики, записанного в виде (2.57):
dq = dh – vdp.
В самом деле, поскольку при течении с трением величина q, фигурирующая в этом соотношении, представляет собой сумму теплоты, подводимой к потоку извне, qвнеш и теплоты трения qтр
q = qвнеш + qтр ,
уравнение (2.57) приобретает вид: |
|
dqвнеш + dqтр = dh – vdp, |
(7.119) |
откуда для адиабатно изолированного потока (dqвнеш = 0) получаем: |
|
dqтр = dh – vdp. |
(7.120) |
Поскольку теплота трения, разумеется, эквивалентна работе трения, т.е.
qтр = lтр ,
с учетом (7.118) имеем из (7.120)
dh = 0,
т.е. полученное нами ранее условие неизменности энтальпии.
Выясним теперь, как изменяются в процессе адиабатного дросселирования остальные параметры газа (энтропия, температура и др.).
Как было отмечено, дросселирование представляет собой существенно необратимый процесс. В самом деле, если представить себе процесс дросселирования идущим в обратном направлении (например, в трубе, изображенной на рис. 7.11, а, изменить направление течения газа на обратное), то он по-преж- нему будет сопровождаться падением давления при протекании газа через местное сопротивление (дроссель). Это естественно — ведь расход энергии потока на преодоление местного сопротивления будет иметь место независимо от направления течения газа. Поскольку процесс дросселирования явно необратим, энтропия газа (жидкости) в процессе дросселирования возрастает (ds > 0). Разумеется, в различных видах процесса дросселирования, отличающихся друг от друга различными количествами теплоты, подводимой к газу в процессе дросселирования, прирост энтропии различен. Рассчитаем прирост энтропии для рассматриваемого нами частного случая дросселирования — адиабатного дросселирования.
Приступая к вычислению изменения энтропии в процессе дросселирования, следует сделать одно существенное замечание. Дифференциальные уравнения термодинамики, которые мы будем использовать для вычисления изменения энтропии, температуры и других параметров вещества при адиабатном дросселировании, применимы, как отмечалось в гл. 3 и 4, только для обратимых процессов. Поэтому для того чтобы иметь возможность воспользоваться этими уравнениями для расчета изменения состояния газа (жидкости) в необратимом процессе адиабатного дросселирования от состояния 1 до состояния 2, мы должны предварительно подобрать схему обратимого процесса, переводящего рассматриваемый газ (жидкость) из того же исходного состояния 1 (перед дросселем) в то же конечное состояние 2 (за дросселем). Изменение энтропии будет подсчитано для этого обратимого процесса, но, поскольку энтропия является функцией состояния, разность энтропий газа (жидкости) в состояниях 1 и 2 будет такой же и для интересующего нас процесса дросселирования. Примером условного обратимого процесса может служить обратимый процесс расширения
240

7.6. Дросселирование. Эффект Джоуля—Томсона
газа с подводом (отводом) теплоты, осуществляемый таким образом, чтобы энтальпия газа оставалась постоянной1).
Изменение энтропии газа в результате осуществления этого обратимого процесса (равное изменению энтропии при дросселировании газа от состояния 1 до состояния 2) определяется следующим соотношением:
|
|
|
|
|
|
|
|
|
|
|
|
|
p2 |
|
|
|
|
||
s2(h, p2 ) |
– s1(h, p1 ) |
= |
|
|
|
∂s |
|
dp , |
(7.121) |
||||||||||
∫ |
----- |
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
∂p |
h |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
p1 |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
которое с учетом уравнения (4.43) можно записать в виде |
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
∫ |
T |
|
|
|
s |
|
(h, p |
|
) – s |
|
(h, p |
|
) |
= – |
|
v |
|
|
(7.122) |
|||||
2 |
2 |
1 |
1 |
|
----- dp , |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p1 |
|
|
|
|
или, что то же самое, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p1 |
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
∫ |
|
|
|
||
|
s |
|
(h, p |
|
) – s |
|
(h, p |
|
) = |
|
|
v |
|
dp |
(7.122а) |
||||
|
2 |
2 |
1 |
1 |
|
|
----- |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p2 |
|
|
|
|
|
(такая запись является более удобной, так как p2 < p1). Из уравнения (7.122а) следует, что всегда s2 > s1.
Перейдем теперь к вопросу о том, как меняется температура газа или жидкости в процессе адиабатного дросселирования. Поскольку процесс характеризуется условием h = const, для решения этого вопроса нужно знать значение производной (∂Т / ∂р)h.
Из очевидного соотношения
∂T |
|
∂p |
∂h |
|
|
|
|
|
||||||
------ |
|
|
|
----- |
|
|
------ |
|
|
|
= –1 |
(7.123) |
||
∂p |
h |
∂h |
T |
∂T |
p |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
с учетом уравнений (2.59) и (4.31) получаем: |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
T |
∂v |
|
|
– v |
|
|||
∂T |
|
|
|
------ |
p |
|
||||||||
|
= |
|
|
∂T |
|
|
(7.124) |
|||||||
------ |
|
|
------------------------------- . |
|||||||||||
∂p |
h |
|
|
|
|
c |
p |
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Величину (∂Т / ∂р)h называют к о э ф ф и ц и е н т о м |
а д и а б а т н о г о д р о с с е - |
|||||||||||||
л и р о в а н и я и л и д и ф ф е р е н ц и а л ь н ы м |
д р о с с е л ь - э ф ф е к т о м ; его |
|||||||||||||
обозначают |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
αh = |
|
∂T |
|
|
. |
|
|
(7.125) |
||||
|
|
|
------ |
h |
|
|
||||||||
|
|
|
|
|
|
∂p |
|
|
|
|
||||
В общем случае величина αh отлична от нуля. Явление изменения температуры газов и жидкостей при адиабатном дросселировании называется э ф ф е к -
1) В отличие от необратимого процесса адиабатного дросселирования обратимый изоэнтальпийный процесс расширения (dp < 0) не может быть в то же самое время адиабатным: из уравнения (7.120)
dqтр = dh – vdp
очевидно, что при dqтр = 0 (трение в обратимом процессе отсутствует) и dp ≠ 0 энтальпия не может оставаться неизменной (dh = 0). Если же представить себе обратимый процесс при dq = 0 и dh = 0, то, как видно из уравнения (7.120), в этом случае газ просто не будет расширяться (dp = 0); иными словами, состояние газа не меняется и, следовательно, процесса как такового нет.
241

Гл а в а 7. ОСНОВНЫЕ ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ
то м Д ж о у л я — Т о м с о н а ; величину αh часто называют коэффициентом
Джоуля—Томсона. Измеряя дифференциальный дроссель-эффект (весьма малую конечную разность температур T при такого же порядка разности давлений по обе стороны дросселя р), можно по результатам этих измерений найти величину αh, а зная αh, построить h, T-диаграмму исследуемого вещества, определить теп-
лоемкость ср, другие калорические функции, удельный объем и т.д.
Изменение температуры газа (жидкости) в процессе адиабатного дросселирования при значительном перепаде давления на дросселе называют и н т е г - р а л ь н ы м д р о с с е л ь - э ф ф е к т о м ; он вычисляется из соотношения
p2 |
|
T2 – T1 = ∫ αh dp , |
(7.126) |
p1 |
|
где Т1 и Т2 — температуры дросселируемого вещества соответственно перед
дросселем и за ним.
Интегральный дроссель-эффект может достигать весьма большого значения. Например, при адиабатном дросселировании водяного пара от давления 29 400 кПа и температуры 450 °С до давления 98 кПа температура пара уменьшается до 180 °С (т.е. на 270 °С!).
Определение интегрального адиабатного дроссель-эффекта удобно выполнять с помощью h, T-диаграммы дросселируемого вещества (рис. 7.12). Если известно состояние газа (жидкости) перед дросселем, т.е. его давление р1 и тем-
пература Т1, и известно давление за дросселем p2, то, нанеся точку с параметрами p1 и Т1 в h, T-диаграмме (точка 1) и найдя точку пересечения изоэнтальпы h1 = const с изобарой p2 = const, получим температуру за дросселем Т2.
Следует помнить, что изображенная в h, T-диаграмме на рис. 7.12 изоэнтальпа 1-2 не есть линия процесса адиабатного дросселирования; в диаграммах состояния могут изображаться только обратимые процессы. Изоэнтальпа 1-2 — это линия обратимого процесса, осуществляемого между теми же состояниями, между которыми осуществляется необратимый процесс адиабатного дросселирования.
Какой же знак имеет адиабатный дроссель-эффект? Иными словами, всегда ли уменьшается температура газа (жидкости) при адиабатном дросселировании? Для ответа на этот вопрос проанализируем соотношение (7.124). Поскольку всегда cр > 0, знак коэффициента адиабатного дросселирования αh определяется
знаком стоящей в числителе правой части уравнения (7.124) величины
∂v |
|
|
v |
|
------ |
|
– |
. |
|
T ∂T |
|
|||
|
|
p |
|
|
h |
p2 ß const |
|
|
h ß const |
|
|
2 |
1 |
|
|
p1ß const |
T2 |
T1 |
T |
Рис. 7.12
Очевидно, что если |
|
|
|
|
∂v |
|
|
v |
(7.127) |
------ |
|
< ----- , |
||
∂T |
p |
T |
|
|
|
|
|
|
|
то |
|
|
|
|
αh < 0, |
|
(7.128) |
||
и тогда в процессе адиабатного дросселирования температура дросселируемого вещества возрастает.
Если
∂v |
|
|
v |
(7.129) |
------ |
|
|
> ----- , |
|
∂T |
p |
T |
|
|
|
|
|
|
242

7.6. Дросселирование. Эффект Джоуля—Томсона
то
αh > 0, |
(7.130) |
и тогда в процессе адиабатного дросселирования температура дросселируемого вещества уменьшается. Наконец, если
∂v |
|
= |
v |
(7.131) |
------ |
|
----- , |
||
∂T |
p |
T |
|
|
|
|
|
|
|
то |
|
|
|
|
αh = 0, |
|
(7.132) |
||
т.е. в процессе адиабатного дросселирования температура вещества не изменяется.
Поскольку для идеального газа |
|
|
|
∂v |
|
|
v |
------ |
|
|
= ----- , |
∂T |
p |
T |
|
|
|
|
то идеальный газ дросселируется без изменения температуры. Это один из характерных признаков идеального газа. Таким образом, эффект Джоуля—Том- сона имеет место только для реальных газов и жидкостей. Как показывают расчеты, для газа, подчиняющегося уравнению Ван-дер-Ваальса, эффект Джоуля— Томсона не равен нулю.
Из опыта известно, что для одного и того же вещества знак αh оказывается
различным в различных областях состояния. Состояние газа (жидкости), в котором αh равно нулю, называют т о ч к о й и н в е р с и и эффекта Джоуля—Томсона.
Геометрическое место точек инверсии на диаграмме состояния данного вещества называют к р и в о й и н в е р с и и .
Точки на кривой инверсии удовлетворяют уравнению (7.132). Пользуясь этим условием, можно найти кривую инверсии с помощью уравнения состояния вещества.
В качестве примера на рис. 7.13 приведена кривая инверсии азота в р, T-диа- грамме. Внутри области, ограниченной кривой инверсии, αh > 0, т.е. газ при
дросселировании охлаждается. Вне этой области αh < 0, т.е. температура газа
при дросселировании повышается. Аналогичный характер имеют кривые инверсии других веществ.
На рис. 7.14 изображена построенная в приведенных координатах π, τ обобщенная инверсионная кривая. Разумеется, как и всякая обобщенная зависимость, эта кривая имеет весьма приближенный характер — реальные инверсионные кривые различных веществ в ряде случаев заметно отклоняются от этой обобщенной зависимости; однако качественный характер кривой инверсии эта диаграмма передает верно. Как видно из этой диаграммы, в обширной области состояний величина αh имеет положительное значение (охлаждение газа при
дросселировании).
p, МПа |
|
|
|
|
|
|
|
|
|
|
π |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
α |
|
<0 |
|
8 |
|
αh<0 |
|
|
|
|
|
|
αh<0 |
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
35 |
|
|
|
|
|
|
|
|
h |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
—нагрев˜ |
|
7 |
|
|
|
|
|
|
|
|
|
|
||||
30 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
25 |
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
20 |
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15 |
|
|
αh> 0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
αh> |
0 |
|
||||
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
10 |
|
—охлаждение |
˜ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
-200-100 |
0 100 200 |
|
t,°C |
0 |
1 |
|
2 3 4 5 6 τ |
||||||||||||||||
|
|
Рис. 7.13 |
|
|
|
|
|
|
Рис. 7.14 |
||||||||||||||
243
Г л а в а 7. ОСНОВНЫЕ ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ
p |
|
|
|
|
p |
|
pи |
|
|
|
|
|
|
b |
|
a |
|
|
|
|
|
|
|
|
|
|
K |
B |
|
|
A |
|
C |
|
|
|
|
|
|
||
TВTb |
Tи |
Ta |
TА |
T |
Tc |
T |
|
Рис. 7.15 |
|
|
Рис. 7.16 |
|
|
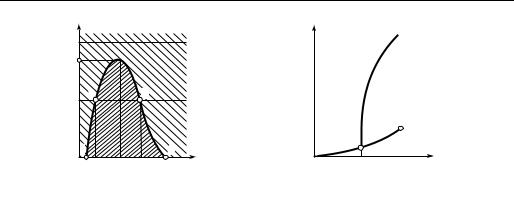
Как видно из рассмотрения кривой инверсии (рис. 7.15), изобары р < ри дважды пересекают кривую инверсии (точки b и а): перемещаясь по изобаре в область высоких температур, мы из области αh < 0 (нагрев газа при дросселировании) попадаем в область αh >0 (охлаждение газа при дросселировании), а затем при весьма высоких температурах, в несколько раз превышающих критическую, вновь попадаем в область αh < 0. При давлениях р > ри при любой температуре αh < 0. Точку максимума кривой инверсии называют критической точкой инверсии. Как показывают расчеты, для ван- дер-ваальсова газа параметры критической точки инверсии таковы:
pи = 9pкр; Tи = 3Tкр; vи = vкр. |
(7.133) |
Для ван-дер-ваальсова газа можно вычислить, при каких значениях температуры кривая инверсии пересекается с осью абсцисс на р, T-диаграмме (рис. 7.15). Как показывают эти расчеты,
TA = 6,75Tкр; |
(7.134) |
TB = 0,75Tкр. |
(7.135) |
Значение TA для реальных газов хорошо согласуется с величиной 6,75 Ткр. Что же касается величины ТB (не путать с температурой Бойля), то ее значение для ван-дер-вааль- сова газа не соответствует опытным данным.
Левая ветвь кривой инверсии не доходит до оси ординат в р, T-диаграмме, поскольку она пересекается с линией насыщения. Ход кривой инверсии вблизи линии насыщения схематически изображен на рис. 7.16. Как видно из р, T-диаграммы, в некоторой точке С кривая инверсии соприкасается с линией насыщения. Значения температур, при которых кривая инверсии подходит к линии насыщения, различны для разных веществ. Например, для воды TC = 235 °С.
Так как в р, T-диаграмме изоэнтальпы, изохоры, изоэнтропы и другие кривые для влажного пара сливаются с кривой насыщения и, следовательно,
∂T |
дф |
dT |
----- |
h |
= ----- , |
∂p |
dp |
то
дф |
dT |
(7.136) |
αh |
= ----- , |
|
|
dp |
|
т.е. для двухфазной смеси αдфh > 0; влажный пар при адиабатном дросселировании всегда охлаждается.
Адиабатное дросселирование может быть использовано в качестве эффективного способа охлаждения газов. Разумеется, газ будет охлаждаться только в том случае, когда его состояние находится в той области состояний, в которой αh > 0, т.е. в области под кривой инверсии.
244

7.6. Дросселирование. Эффект Джоуля—Томсона
Поскольку в § 7.4 упоминалось о том, что эффективным способом охлаждения газов является процесс обратимого адиабатного, т.е. изоэнтропного, расширения (с отдачей внешней работы), представляет интерес сравнение этих двух способов охлаждения газов. Выясним, какой из этих двух способов обеспечивает большее понижение температуры. Иными словами, нужно сравнить между
собой величины (∂T / ∂p)h и (∂T / ∂p)s. |
|
Производная |
(∂T / ∂p)s, которая может быть названа к о э ф ф и ц и е н т о м |
о б р а т и м о г о |
а д и а б а т н о г о ( и з о э н т р о п н о г о ) р а с ш и р е н и я и по ана- |
логии с αh обозначена αs, может быть представлена в следующем виде. Из соотношения
∂T |
∂p |
|
∂s |
|
|
|
||||
------ |
|
----- |
|
|
|
------ |
|
= –1 |
(7.137) |
|
∂p |
∂s |
T |
∂T |
|||||||
|
s |
|
|
|
|
|
|
p |
|
|
с учетом уравнения Максвелла (4.22) получаем: |
|
|||||||||
|
|
|
T |
-----∂v- |
|
|
|
|||
|
|
|
|
∂T |
p |
(7.138) |
||||
|
αs = ------------------------- . |
|||||||||
|
|
|
|
|
cp |
|
|
|
|
|
Коэффициент адиабатного дросселирования (т.е. необратимого адиабатного расширения) в соответствии с уравнением (7.124) равен:
|
∂v |
|
v |
T |
------ |
– |
|
∂T |
|
||
|
|
p |
|
αh = ------------------------------------- . |
|||
|
cp |
|
|
Из (7.138) и (7.124) получаем: |
|
|
|
αs – αh |
|
v |
(7.139) |
= ---- . |
|||
|
|
cp |
|
Поскольку v и cp всегда положительны, то |
|
||
αs > αh. |
(7.140) |
||
Таким образом, процесс обратимого адиабатного расширения (с отдачей внешней работы) обеспечивает более эффективное с точки зрения термодинамики охлаждение газа или жидкости, чем процесс адиабатного дросселирования, т.е. необратимого адиабатного расширения.
Как отмечено выше, адиабатное дросселирование является одним из частных случаев процессов дросселирования, которые различаются количеством теплоты, подводимой к веществу в процессе дросселирования. Понятно, что если имеет место подвод или отвод теплоты через стенки трубы в процессе дросселирования, то условие изоэнтальпийности, справедливое для адиабатного дросселирования, не выполняется и энтальпия газа (жидкости) изменяется. Интересным частным случаем процесса дросселирования является изотермическое дросселирование.
Изотермическое дросселирование. Изотермическим дросселированием называют такой процесс дросселирования, в котором к дросселируемому газу (жидкости) подводится такое количество теплоты, чтобы температура газа за дросселем оставалась равной температуре перед дросселем. Изотермическое дросселирование применяется главным образом в теплофизических экспери-
245

Г л а в а 7. ОСНОВНЫЕ ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ
ментах. Коэффициент изотермического дросселирования (и з о т е р м и ч е с к и й д р о с с е л ь - э ф ф е к т ), обозначенный αT , определяется следующим образом:
αT = – |
∂h |
|
. |
(7.141) |
----- |
T |
|||
|
∂p |
|
|
Величина αT характеризует изменение энтальпии вещества при уменьшении
давления в процессе изотермического дросселирования. В соответствии с уравнением (4.31) получаем
αT = T |
∂v |
|
– v . |
(7.142) |
------ |
p |
|||
|
∂T |
|
|
В заключение отметим, что удельный объем вещества в процессе дросселирования всегда увеличивается; в самом деле, как известно, величина (∂p/∂v)T
всегда отрицательна; нетрудно показать, что величина (∂p/∂v)h также всегда
отрицательна. Отрицательные значения этих производных свидетельствуют о том, что при снижении давления вещества при дросселировании (dp < 0) удельный объем возрастает (dv > 0).
Эффект Джоуля—Томсона может быть использован для приведения практических температурных шкал к термодинамической шкале, подобно тому, как это было сделано в § 5.6 на основе использования уравнения Клапейрона—Клаузиуса, т.е. для установления зависимости T = f (T * ), где Т и T * — температуры соответственно по термодинамической и практической шкалам.
Очевидно, что выражение (7.125) для коэффициента Джоуля—Томсона может быть представлено в виде
α |
|
= |
∂T |
|
= |
|
∂T * |
|
dT |
(7.143) |
h |
----- |
|
|
--------- |
|
--------- . |
||||
|
|
∂p |
h |
|
∂p |
h dT * |
|
|||
|
|
|
|
|
||||||
Это соотношение связывает истинное значение производной (∂T / ∂p)h , где Т — температура по термодинамической шкале, с экспериментально измеренным дрос- сель-эффектом α*h = (∂T*/∂p)h; понятно, что в этих экспериментах температура изме-
ряется с помощью термометров, градуированных по практической шкале.
Вместе с тем коэффициент Джоуля—Томсона αh может быть вычислен с помо-
щью уравнения (7.124), которое может быть записано в следующем виде: |
|
|||||
|
T |
∂v |
|
– v |
|
|
|
------ |
p |
|
|||
αh |
|
∂T |
|
(7.144) |
||
= ----------------------------- . |
||||||
|
|
∂h |
|
|
|
|
|
|
------ |
|
|
|
|
|
|
∂T |
|
|
||
|
|
|
|
p |
|
|
Для вычисления αh с помощью этого уравнения надо располагать помимо Т значениями (∂v /∂T )p, cp = (∂h / ∂T )p и v. Значение удельного объема v почти не изменяется с переходом от практической шкалы к термодинамической; что же касается (∂v / ∂T )p и ср , то на их значениях различие в температурных шкалах скажется гораздо сильнее.
Очевидно, что |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
∂v |
|
= |
|
∂v |
|
dT * |
и |
∂h |
|
= |
|
∂h |
dT * |
; |
(7.145) |
|||
|
|
----- |
p |
|
--------- |
|
--------- |
----- |
p |
|
--------- |
--------- |
|||||||
|
∂T |
|
|
∂T * |
p dT |
|
∂T |
|
|
∂T * |
p dT |
|
|
||||||
здесь (∂v / ∂T * ) |
p |
и c * |
= (∂h / ∂T |
* ) |
p |
— значения, полученные из эксперимента с приме- |
|||||||||||||
|
|
p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
нением термометров, градуированных по практической шкале. С учетом (7.145) уравнение (7.144) записывается следующим образом:
T |
|
∂v dT * |
– v |
|
|
|
-------- |
- --------- |
|
||
αh = |
|
∂T * p dT |
. |
(7.146) |
|
|
|
* dT * |
|||
|
|
c |
|
|
|
|
|
--------- |
|
|
|
p dT
246
