
- •Лабораторная работа № 1: ИдентификациЯ аминокислот методом распределительной хроматографии
- •Лабораторная работа № 2: анализ двухкомпонентных смесей
- •Лабораторная работа № 3: гель - хроматография
- •Определение параметров колонки
- •Лабораторная работа № 4. Углеводы
- •Моносахариды
- •Дисахариды
- •Полисахариды
- •Лабораторная работа № 5: определение неорганического фосфора в крови
- •Вопросы к коллоквиумам и примеры вариантов заданий Коллоквиум № 1. Аминокислоты, пептиды и белки
- •Коллоквиум № 2. Углеводы
- •Коллоквиум № 3. Карбоновые кислоты и их функциональные производные. Липиды.
- •Коллоквиум № 4. Гетероциклические соединения. Нуклеиновые кислоты
- •Список рекомендуемой литературы
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
ПЕТРОЗАВОДСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ЛАБОРАТОРНЫЙ ПРАКТИКУМ ПО ДИСЦИПЛИНЕ
«ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ»
для студентов II курса медицинского института
специальностей 31.05.01 «Лечебное дело» и 31.05.02 «Педиатрия»
Петрозаводск
Издательство ПетрГУ
2015
УДК
ББК
В___
Судакова Н.М.
К.б.н., доцент кафедры молекулярной биологии, биологической и органической химии
Галибина Н.А.,
к.б.н., зав. Лаборатории аналитической Института Леса КарНЦ РАН
Печатается по решению редакционно-издательского совета
Петрозаводского государственного университета
Настоящее учебное пособие содержит лабораторный практикум по методам выделения и разделения различных классов соединений, а также их количественному определению по курсу «Введение в лабораторную диагностику», рекомендуемые студентам для выработки практических навыков по установлению структуры основных классов низко- и высокомолекулярных соединений и формированию навыков планирования и выполнения лабораторного эксперимента.
Учебное пособие предназначено для студентов медицинских, биологических специальностей и направлений бакалавриата, магистрантов.
Лабораторная работа № 1: ИдентификациЯ аминокислот методом распределительной хроматографии
Распределительная или жидко-жидкостная хроматография используется для разделения в частности высокополярных соединений, к которым относятся, например, аминокислоты. Разделение в этом методе основано на различном коэффициенте распределения компонентов образца между стационарной и подвижной жидкими фазами. Процессы распределения между жидкими фазами по сравнению с адсорбционными являются более чувствительными к самым незначительным структурным изменениям; поэтому этот метод успешно используется для разделения соединений одного гомологического ряда.
В данной работе разделение смеси аминокислот осуществляется за счет различного распределения (растворимости) между двумя жидкими фазами: стационарной фазой - водой и подвижной фазой - н-бутанол, уксусная кислота, вода в соотношении 4:1:1. Носителем стационарной фазы является силикагель (готовые пластинки ² Silufol² ). Детекция аминокислот на пластинке производится с помощью нингидрина, который дает цветную реакцию с a-аминокислотами.
Для разделения используются водные растворы аминокислот (небольшое количество аминокислот растворяют в 0,5 - 1мл дистиллированной воды в микростаканчике). На пластинку ²Silufol², обработанную паром в точки тонким капилляром наносят приготовленные растворы исследуемого образца и свидетелей (стандарты аминокислот). Диаметр пятна не должен превышать 2мм. Точки нанесения должны отстоять от краев пластинки не менее чем на 1см.
После нанесения пробы пластинки помещают в камеру, в которую за 10 - 15мин до начала хроматографирования следует налить примерно 24 мл смеси н-бутанол - уксусная кислота - вода в сотношении 4:1:1. Для достижения лучшего разделения аминокислот в данной работе используется двухкратное хроматографирование. После того, как фронт подвижной фазы (системы растворителей) поднимется на 10 -12 см, пластинка вынимается из камеры, подсушивается в вытяжном шкафу и хроматографируется повторно в тех же условиях.
Пластинка, вынутая из камеры, вновь высушивается в вытяжном шкафу и опрыскивается 0,2% раствором нингидрина (из пульверизатора).
После опрыскивания пластинка помещается в сушильный шкаф при 110-120°С. Аминокислоты детектируются в виде розовато-лиловых пятен.
Совпадение значений Rf исследуемого образца и свидетеля говорит об их идентичности.
Зарисуйте расположение пятен аминокислот и запишите величины Rf аминокислот.
Какие виды хроматографии используются при выполнении данной работы? Нужные слова подчеркните.
а) жидко-жидкостная, твердо-жидкостная, газожидкостная.
б) адсорбционная , ионообменная, ситовая (гель-хроматография).
в) колоночная, в тонком слое, бумажная.
Лабораторная работа № 2: анализ двухкомпонентных смесей
(на примере аминокислот)
В основе количественного определения состава смесей спектрофотометрическими методами лежит правило аддитивности: поглощение света раствором любой смеси является суммой поглощений отдельных компонентов.
При условии выполнения закона Ламберта-Бугера-Бера
D = ε · c · l (1)
где D – оптическая плотность
ε - коэффициент экстинциии
c - концентрация соединения в растворе (моль/л)
l - толщина слоя (кюветы) раствора в сантиметрах
и известных коэффициентах экстинции для каждого вещества в отдельности измеряемая оптическая плотность смеси при любой длине волны может быть найдена по уравнению:
D = (ε1 · c1 + ε2 · c2 + ε3 · c3 + …) · l (2)
Если в смеси содержится n компонентов, то измерения оптической плотности должны быть проведены при n различных длинах волн и, соответственно, должны быть решены n уравнений. Этот метод особенно широко применяется для анализа двухкомпонентных систем. Две длины волны выбираются таким образом, чтобы при одной из них интенсивности поглощения соединений сильно различались, а при другой оба вещества имели бы достаточно сильное поглощение. Существенно также, чтобы выбранные длины волн находились на участках спектральных кривых с малым наклоном (обычно в точках, близких к максимумам и минимумам полос), поскольку, когда небольшие изменения длины волны сопровождаются большими изменениями оптической плотности, точность определения значительно снижается.
В данной работе предлагается проанализировать смесь двух аминокислот, входящих в состав белков – триптофана (α – амино - β-индолилпропионовая кислота) и тирозина ( α - амино-β-(пара-гидроксифенил) пропионовая кислота).
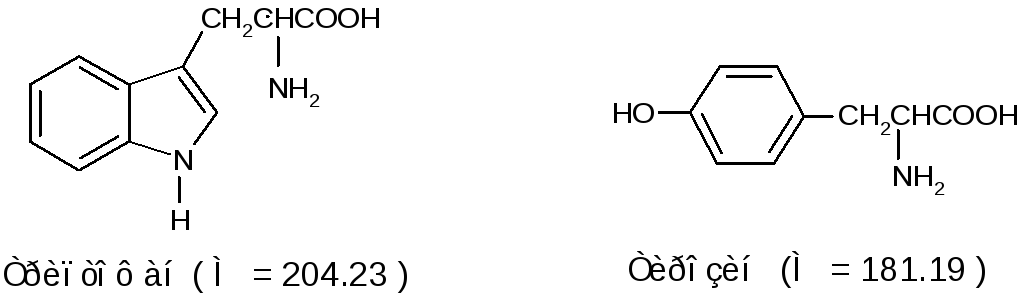
Эти аминокислоты имеют избирательное поглощение в области 220 – 350 нм.
Тирозин λ при 294 нм (ε294 = 2550 ) в 0.1 М растворе NaOH
Триптофан λ при 281 нм (ε281 = 5000 ) в 0.1 М растворе NaOH
Кривые поглощения этих аминокислот пересекаются в точках 294 и 257 нм (изобестические точки), в в которых εтир = εтри. Тогда из уравнения (2) можно легко определить сумму молярных концентраций:
с = с1 + с2 = D294 / ε294 = D257 / ε257 ( 3 )
Измерив интенсивность еще при одной длине волны λ, находят содержание каждой аминокислоты в смеси:
C1 = (Dλ – ε2λ · c ) / (ε1λ – ε2λ ) ( 4 )
Индекс 1 относится к тирозину, 2 – к триптофану.
Порядок выполнения работы
Приготовьте растворы аминокислот в 0.1 М растворе NaOH следующих концентраций: триптофан – 2·10-4 М, тирозин – 3·10-4 М.
Запишите на спектрофотометре индивидуальные спектры тирозина и триптофана в области 220 – 350 нм.
Рассчитайте с помощью формулы (1) коэффициент экстинции тирозина при 281 нм.
Смешайте исходные растворы триптофана и тирозина в отношении 3: 2, соответственно и запишите на спектрофотометре спектр их смеси.
Рассчитайте суммарную концентрацию аминокислот в их смеси по уравнению (3), используя значение оптической плотности раствора аминокислот при 294 нм.
Рассчитайте с помощью уравнения (4) концентрацию каждой аминокислоты, используя значение оптической плотности смеси при 281 нм.
Зная точное значение концентраций тирозина и триптофана, определите ошибку измерения.
