
Быков- гистология( общая)
.pdfСодержание лейкоцитов в рыхлой волокнистой соединительной ткани в норме незначительно. Выделяя цитокины, эти клетки могут оказывать регуляторное влияние друг на друга, на остальные виды клеток соединительной ткани и на клетки соседних тканей.
Локальное увеличение числа лейкоцитов в рыхлой волокнистой соединительной ткани, образующих в большей или меньшей степени очерченные скопления, выявляется при воспалении (см. гаже). В частности, при остром воспалении в таких скоплениях (инфильтратах) преобладают нейтрофильные гранулоциты, при хроническом - обнаруживаются преимущественно лимфоциты, плазматические клетки, моноциты и образующиеся из них макрофаги.
Пигментные клетки
Пигментные клетки человека имеют нейральное происхождение и являются потомками клеток, выселившихся в эмбриональном периоде из нервного гребня. Цитоплазма этих клеток содержит пигменты меланины (от греч. melanos - черный). Цвет пигментов варьирует от коричнево-черного (эумеланины, от греч. eu - истинный) до желто-коричневого (фео-меланины, от греч. pheo - светлый). Пигментные клетки имеют отростчатую форму и подразделяются на дна вида - меланоциты, которые вырабатывают пигмент, и меланофоры, способные лишь накапливать его в цитоплазме (см. главу 11). Пигментные клетки входят в состав рыхлой волокнистой соединительной ткани (см. рис. 10-1), хотя у человека и других млекопитающих они встречаются в ней сравнительно редко.
Повышенное содержание пигментных клеток характерно для соединительнотканной части кожи (дермы) некоторых участков тела (мошонки, сосков, перианальной области). У новорожденных детей, в особенности принадлежащих к монголоидной расе, пигментные клетки дермы часто образуют крупное скопление, располагающееся в области крестца и копчика, которое макроскопически выявляется как пигментированный участок кожи ("монгольское пятно"). Его окраска по интенсивности достигает максимума к 1- му году, а размеры - к 2 годам, после чего оно блекнет и постепенно исчезает (обычно к 6-7 годам). Микроскопически, однако, пигментные клетки в составе дермы определяются у людей любого возраста, более того, в среднем и пожилом возрасте они могут формировать крупные скопления (это нарушение называется меланоцитозом), образуя пигментные пятна - чаще всего в области лица и спины. Содержание пигментных клеток в соединительной ткани
- 301 -
дермы увеличено в области родимых пятен (невусов); оно резко повышено в ней при некоторых заболеваниях кожи, связанных с образованием очагов гиперпигментации.
Численное преобладание пигментных клеток над другими клеточными элементами соединительной ткани характерно для радужки и сосудистой оболочки глаза, где им принадлежит и функционально ведущая роль. Такую ткань называют пигментной и относят к одному из видов соединительных тканей со специальными свойствами (см. главу 11).
МЕЖКЛЕТОЧНОЕ ВЕЩЕСТВО РЫХЛОЙ ВОЛОКНИСТОЙ СОЕДИНИТЕЛЬНОЙ ТКАНИ
Межклеточное вещество рыхлой волокнистой соединительной ткани состоит из волокон и основного аморфного вещества. Оно является продуктом деятельности клеток этой ткани, в первую очередь, фибробластов.
Функции межклеточного вещества рыхлой волокнистой соединительной ткани:
1)обеспечение архитектоники, физико-химических и механических свойств ткани;
2)участие в создании оптимального микроокружения для деятельности
клеток;
3)объединение в единую систему всех клеток соединительной ткани и обеспечение передачи информации между ними;
4)воздействие на многочисленные функции различных клеток
(пролиферацию, дифференцировку, подвижность, экспрессию рецепторов, синтетическую и секреторную активность, чувствительность к действию различных стимулирующих, ингибирующих и повреждающих факторов и т.п.). Этот эффект может осуществляться путем контактного воздействия компонентов межклеточного вещества на клетки, а также благодаря его способности накапливать и выделять факторы роста.
ВОЛОКНА МЕЖКЛЕТОЧНОГО ВЕЩЕСТВА РЫХЛОЙ ВОЛОКНИСТОЙ СОЕДИНИТЕЛЬНОЙ ТКАНИ
Волокна, входящие в состав межклеточного вещества рыхлой волокнистой соединительной ткани, относятся к трем основным типам,
- 302 -
каждый из которых обладает особыми морфологическими, механическими и биохимическими свойствами и выполняет определенную функцию в ткани. Различают: (1) коллагеновые волокна, (2) ретикулярные волокна и (3) эластические волокна.
Коллагеновые волокна
Коллагеновые волокна образованы белками коллагенами, которые получили свое название из-за способности содержащих их тканей при длительном вываривании давать животный клей (от греч. kolla - клей и genes - рождающий).
Коллагены - семейство родственных белков, являющихся наиболее распространенными белками в межклеточном веществе соединительных тканей и во всем организме человека (составляют 25-30% их общего количества). Они придают тканям механическую прочность и выполняют морфогенетическую функцию, влияя на рост, миграцию, дифференцировку, секреторную и синтетическую активность различных клеток. Их молекулы способны собираться в филаменты, фибриллы или образовывать сети, взаимодействующие с другими белками межклеточного вещества.
Молекулы коллагенов состоят из трех скрученных спирально полипентидных нитей - α-цепей (рис. 10-6), в которых преобладают аминокислоты глицин, пролин, лизин, гидроксипролин и гидроксилизин (последние две образуются в грЭПС из пролина и лизина, соответственно, в ходе синтеза коллагена). Идентифицировано более 30 вариантов α-цепей коллагена, различных но химическому строению. Каждая из них кодируется отдельным геном, причем разные ткани характеризуются экспрессией тех или иных комбинаций этих генов. Хотя теоретически комбинации всех вариантов α- цепей могли бы дать более 1000 молекулярных форм коллагена, до настоящего времени обнаружено лишь 19 типов (обозначаемых римскими цифрами - I- XIX), из которых наибольшее значение имеют первые пять (см. ниже). Эти коллагены различаются аминокислотным составом их α-цепей, порядком чередования в них аминокислот, молекулярной массой, распределением в тканях.
Коллагены I, II, III и V типов называются фибриллярными, или интерстициальными, так как они образуют фибриллы, которые входят в состав соединительных тканей; коллаген IV типа относят к аморфным (образует плоские сети).
- 303 -
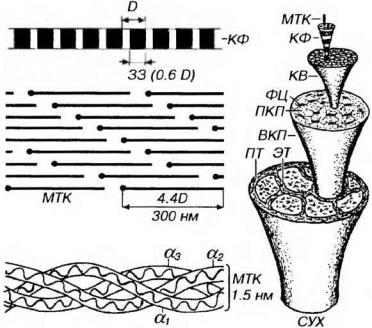
Рис. 10-6. Образование коллагеновой фибриллы и сборка фибрилл а коллагеновые структуры более высокого порядка. Молекула тропоколлагена (МТК) толщиной 1.5 нм и длиной около 280-300 нм образована тремя спирально скрученными полипептидными а-цепями. При упорядоченной внеклеточной агрегации, приводящей к образованию коллагеновых фибрилл (КФ) толщиной 20-120 нм, МТК связываются в продольные цепочки, которые располагаются параллельно друг другу. Внутри каждой цепочки МТК разделены промежутками - зонами зазора (33); в соседних цепочках МТК сдвинуты друг относительно друга на четверть своей длины. При негативном окрашивании наблюдается поперечная исчерченность КФ с периодичностью 6468 нм (D) вследствие отложения красителя в 33 (шириной 0.6 D). Пучки МТК формируют КФ, которые, в свою очередь, образуют коллагеновые волокна (КВ) диаметром 1-20 мкм. КВ образуют первичные коллагеновые пучки (ПКП), которые располагаются между рядами фиброцитов (ФЦ); группа ПКП, окруженная эндотендинием (ЭТ), формирует вторичный коллагеновый пучок (ВКП). Несколько ВКП, окруженных перитендинием (ПТ), составляют третичный коллагеновый пучок - сухожилие (СУХ).
Клетки, вырабатывающие коллагены, помимо фибробластов, включают остеобласты, хондробласты, одонтобласты, цементобласты, ретикулярные клетки, гладкие миоциты, клетки периневрия. Коллагены IV и V типов (как компоненты базальной мембраны) продуцируются также эпителиальными клетками, адипоцитами, гладкими миоцитами, кардиомиоцитами, волокнами склетной мышечной ткани, клетками нейроглии. Процессы биосинтеза коллагена наиболее подробно изучены применительно к фибробласгам, однако они происходят сходным образом и в указанных выше клетках.
- 304 -
Распределение основных типов коллагена в организме
Типы |
Основные участки распределения в организме |
|
|||
коллагена |
|
|
|
|
|
I |
Соединительнотканная |
часть |
кожи |
(дерма), |
кость, |
|
волокнистый хрящ, дентин, цемент, связки, сухожилия, |
||||
|
роговица глаза, рыхлая волокнистая соединительная ткань в |
||||
|
различных органах |
|
|
|
|
II |
Гиалиновый, эластический и (частично) волокнистый хрящ |
||||
|
стекловидное тело, хорда (эмбриона), nucleus pulposus |
||||
|
межпозвонкового диска |
|
|
|
|
III |
Ретикулярные волокна в кроветворных тканях, в стенке |
||||
|
крупных кровеносных сосудов, кишке, печени, легком, |
||||
|
клапанах сердца, гладкомышечной ткани, нервах |
|
|||
IV |
Базальные мембраны, капсула хрусталика |
|
|
||
V |
Базальные мембраны, стенка кровеносных сосудов, кожа, |
||||
|
связки, дентин, роговица, гладкая и поперечнополосатая |
||||
|
мышечные ткани |
|
|
|
|
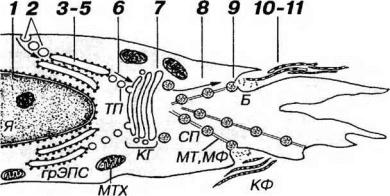
Биосинтез коллагеновых волокон. Образование коллагеновых волокон включает два этапа: (а) внутриклеточный и (б) внеклеточный (рис. 10-7).
Внутриклеточный этап:
(1) Образование иРНК, кодируюпщх синтез а-цепей коллагена, в результате транскрипции соответствующих генов (происходит в ядре фибробласта).
- 305 -
(2)Поглощение и транспорт аминокислот, необходимых для синтеза коллагена, механизмом эндоцитоза.
(3)Синтез полипептидных а-цепей из аминокислот на рибосомах грЭПС (трансляция) под контролем иРНК, поступивших в цитоплазму из ядра. Образуются молекулы с длинными краевыми ("регистрационными") пептидами, которые, как предполагают, необходимы дня (а) последующей правильной сборки трех а-цепей в молекулы проколлагена, (б) обеспечения его растворимости в воде и (в) предотвращения самопроизвольной сборки фибрилл внутри клетки. Синтезированные цепи накапливаются в просвете цистерн грЭПС.
(4)Пострансляционные изменения - ферментное гидроксилирование пролина и лизина (зависит от витамина С, играющего роль кофактора ферментов), гликозилировние гидроксилизина, а также образование дисульфидных мостиков - осуществляются в просвете цистерн грЭПС.
(5)Образование молекулы проколлагена в результате сборки (скручивания)
трех а-цепей - происходит в просвете грЭПС.
(6)Перенос молекул проколлагена из грЭПС в комплекс Гольджи -
осуществляется мембранными транспортными пузырьками.
(7)Терминальное гликозилирование и упаковка молекул проколлагена в секреторные пузырьки - происходят в комплексе Гольджи.
(8)Транспорт молекул проколлагена в секреторных пузырьках, отщепляющихся от комплекса Гольджи, к плазмолемме (обеспечивается элементами цитоскелета - микротрубочками и микрофиламентами).
(9)Экзоцитоз молекул проколлагена в участке инвагинации цитоплазмы фибробласта ("бухточки").
Внеклеточный этап (сборка фибрилл - фибриллогенез):
(10)Отщепление регистрационных пептидов проколлагена с помощью связанных с плазмолеммой специфических протеаз (проколлаген пептидаз) с образованием нерастворимого тропоколлагена, способного к самосборке в фибриллы.
(11)Полимеризация тропоколлагена с образованием коллагеновых фибрилл и волокон протекает самопроизвольно с участием протеогликанов и структурных гликопротеинов, секретируемых фибробластами. Структура фибрилл стабилизируется благодаря формированию ковалентных мостиков между молекулами тропоколлагена под действием фермента лизин оксидазы, секретируемого фибробластами.
Коллагеновые фибриллы толщиной 20-120 нм, обладающие типичной для коллагенов I, II и III типов поперечной исчерченностью (с периодичностью 6468 нм), образуются в результате упорядоченной
- 306 -
агрегации молекул троиоколлагеиа (диаметром 1.5 нм). Последние связываются в продольные цепочки, разделяясь небольшими промежутками (см. рис. 10-6). Располагаясь параллельно друг другу, такие цепочки образуют пучки, в которых каждая из молекул тропоколлагена сдвинута по отношению к таковой в соседней цепочке на четверть своей длины. Полагают, что при такой конфигурации молекулы оптимальным образом связывают и усиливают друг друга в пределах коллагеновой фибриллы. не создавая в ней "слабых точек", по которым мог бы происходить ее поперечный разрыв.
Рис. 10-7. Последовательные этапы синтеза коллагена и образования коллагеновых волокон фибробластом. Внутриклеточный этап: в ядре (Я) происходит образование иРНК, кодирующих синтез а-цепей коллагена (1); аминокислоты, необходимые для синтеза коллагена, поглощаются механизмом эндоцитоза и транспортируются к грЭПС (2); в грЭПС осуществляются процессы синтеза полипептидных а-цепей из аминокислот и их накопление в просвете цистерн (3), пострансляционные изменения а-цепей (4), образование молекулы проколлагена в результате сборки трех а-цепей (5). Молекулы проколлагена переносятся из грЭПС в комплекс Гольджи (КГ) посредством транспортных пузырьков (ТП) - (6); внутри КГ (7) происходит терминальное гликозилирование и упаковка молекул проколлагена в секреторные пузырьки (СП); молекулы проколлагена транспортируются в СП из КГ к плазмолемме (с помощью микротрубочек и микрофиламентов (МТ и МФ) - (8) и выделяются экзоцитозом в области ’’бухточки” (Б) - (9). Внеклеточный этап (фибриллогенез): отщепление регистрационных пептидов проколлагена с образованием нерастворимого тропоколлагена (10); полимеризация тропоколлагена с образованием коллагеновых фибрилл (КФ) и волокон (11). Процессы синтеза и секреции коллагена требуют большого количества энергии, продуцируемой митохондриями (МТХ).
Поперечная исчерченностъ коллагеновых фибрилл (см. рис. 10-6)
обусловлена тем, что при так называемом негативном окрашивании краситель заполняет промежутки (зазоры) между молекулами тропоколлагена, которые приобретают вид повторяющихся поперечных темных полос на фибриллах. Линейные участки фибрилл при этом не окраши-
- 307 -
ваются и имеют вид светлых полос, расположенных между темными. При позитивном окрашивании создается более сложный рисунок поперечной исчерченности коллагеновой фибриллы, включающий несколько полос различной толщины.
Утолщение фибрилл происходит постепенно вследствие присоединения новых молекул тропоколлагена, однако этот процесс находится под контролем, причем для каждого вида ткани характерен свой диаметр фибрилл. В рыхлой волокнистой ткани недавно образованные ("молодые") фибриллы цилиндрической формы во много раз тоньше более зрелых, часто имеющих неправильную форму.
Коллагеновые протофибриллы и коллагеновые микрофибриллы -
промежуточные уровни организации коллагеновых структур (между уровнем молекул тропоколлагена и коллагеновых фибрилл), выделяемые рядом авторов. Коллагеновые протофибршты диаметром 3-5 нм образованы пучками молекул тропоколлагена; коллагеновые микрофибриллы диаметром до 20 нм образованы несколькими протофибриллами.
Объединение коллагеновых фибрилл в пучки приводит к формированию коллагеновых волокон толщиной 1-20 мкм (см. рис. 10-6).
Разрушение (деградация) коллагена фибробластами осуществляется двумя основными путями - внутриклеточным и внеклеточным.
Внутриклеточное разрушение коллагена может происходить до и после секреции синтезированного материала. От 10 до 50% вновь образованного коллагена разрушается самим фибробластом в течение ближайшего времени после его продукции. При этом значительная часть коллагена после синтеза не выделяется из клетки. Предполагают, что такая внутриклеточная деградация коллагена связана с активностью некоего механизма "контроля качества", который выявляет и уничтожает молекулы с измененной структурой, возникшие вследствие "биологических ошибок”. Фибробласты подвергают внутриклеточному разрушению и коллагеновые фибриллы, находящиеся в межклеточном пространстве. Для этого они сначала распознают фибриллу, которая подлежит разрушению, затем частично расщепляют ее путем ферментного воздействия, фагоцитируют ее фрагменты и переваривают их внутриклеточно с помощью лизосомальных ферментов.
Внеклеточное разрушение коллагена осуществляется путем секреции фибробластами в межклеточное пространство группы ферментов (из которых наиболее изучена коллагеназа), обеспечивающих внеклеточное расщепление белков межклеточного вещества до мелких пептидных фрагментов.
- 308 -
Коллагеновые волокна толщиной 1-20 мкм образуются путем объединения в пучки коллагеновых фибрилл (см. рис. 10-6). В рыхлой волокнистой соединительной ткани коллагеновые волокна (собственно коллагеновые волокна) образованы преимущественно коллагеном I типа. На препаратах они имеют вид оксифильных продольно исчерченных извитых тяжей, идущих в различных направлениях поодиночке и часто образующих пучки вариабельной (до 150 мкм) толщины - (см. рис. 10-1). При изучении в поляризационном микроскопе обнаруживается, что коллагеновые волокна обладают свойством двойного лучепреломления, что указывает на наличие продольно расположенных субмикроскопических единиц. При исследовании под электронным микроскопом выявляются образующие их параллельно лежащие фибриллы диаметром 20-120 им с поперечной исчерченностью (период 64-68 нм) -см. рис. 10-6.
Основные функции коллагеновых волокон:
(1) обеспечение высоких механических свойств соединительной ткани.
Чем выше содержание коллагеновых волокон в данной ткани, тем большей прочностью она обладает. Эти волокна практически нерастяжимы; при увеличении нагрузки они лишь слегка распрямляются, утрачивая волнообразный ход и более не удлиняясь вплоть до достижения предела прочности, превышение которого вызывает их разрыв;
(2)определение (в значительной мере) архитектоники соединительной
ткани;
(3)обеспечение взаимодействий между клетками и межклеточным веществом, а также связь между отдельными компонентами межклеточного вещества;
(4)влияние на пролиферацию, дифференцировку, миграцию и функциональную активность различных клеток.
Нарушения синтеза коллагена и сборки коллагеновых волокон очень многообразны и могут явиться результатом дефектов (обычно генетически обусловленных) отдельных стадий внутриклеточного или внеклеточного этапов их образования. Они лежат в основе ряда заболеваний, связанных с мутациями генов, кодирующих молекулы коллагена. К таким заболеваниям, в частности, относятся различные формы синдрома Элерса-Данло (Ehlers-Danlos), при котором у больных отмечаются повышенная эластичность кожи, патологическая подвижность суставов, разрывы стенки аорты и (или) кишки; различные формы несовершенного остеогенеза (osteogenesis imperfecta), для которого характерны патологическая ломкость костей и нарушения функции сердца (см. также главу 12).
- 309 -
Поскольку для синтеза коллагена необходим витамин С (аскорбиновая кислота), его недостаточное поступление в организм вызывает серьезные расстройства (цингу), проявляющиеся, наряду с другими симптомами (мышечной слабостью, кровоточивостью, отечностью и изъязвлением десен), признаками, обусловленными нарушением выработки коллагена. В частности, при цинге происходит расшатывание и выпадение зубов (из-за нарушения обновления волокон периодонтальной связки - главного элемента поддерживающего аппарата зуба), замедляется заживление ран и костных переломов.
Нарушение баланса между образованием и разрушением коллагена может приводить к избыточному отложению коллагеновых волокон (диффузному или очаговому), которое характерно для фиброза - патологического состояния, возникающего в различных органах (печени, почках, легких, миокарде) и вызывающего нарушение их функций. Избыточное накопление коллагена в участках повреждения кожи приводит к формированию утолщенных келоидных рубцов (от греч. kele -опухоль и oidos - подобный).
Ретикулярные волокна
Ретикулярные волокна имеют малый диаметр (0.1-2 мкм) и, как правило, формируют тонкие растяжимые трехмерные сети, что определило их название (от лат. reticulum - сеточка). Они образованы коллагеном III типа, т.е. по своей химической природе также являются коллагеновыми. Эти волокна не обнаруживаются на препаратах, окрашенных гематоксилином и эозином. Их выявление основано на способности давать ШИК-реакцию и окрашиваться солями серебра, отчего их называют также аргирофильными (от греч. argyros - серебро и philia - любовь). Каждое ретикулярное волокно образовано пучком микрофибрилл толщиной 20-40 нм, обладающих поперечной исчерченностью с периодичностью 64-68 нм и заключенных в оболочку из гликопротеинов и протеогликанов, которая и обусловливают аргирофилию и ШИК-реакцию этих волокон.
Основная функция ретикулярных волокон – опорная. Они встречаются в рыхлой волокнистой соединительной ткани (особенно во вновь образованной или подвергающейся перестройке), а также во всех других видах соединительной ткани. Ретикулярные волокна многочисленны в кроветворных (миелоидной и лимфоидной) тканях, в которых вместе с ретикулярными клетками образуют поддерживающий каркас для развивающихся элементов крови (см. рис. 9-8). Ретикулярные во-
- 310 -
