
Быков- гистология( общая)
.pdf
ненные зеркально концами друг с другом в области М-линии, формируют толстые нити с центральной гладкой частью длиной около 0.2 мкм и двумя периферическими участками, в которых от центрального стержня отходят миозиновые головки (около 500). Миозин головок обладает АТФазной активностью (способностью осуществлять гидролиз АТФ), однако в отсутствие его взаимодействия с актином скорость гидролиза АТФ ничтожно мала.
Рис. 13-4. Строение толстых миофиламентов (по К.Де Дюву, 1987, с изменениями). 1 - молекула миозина имеет вид нити с двумя головками (Г) на одном конце. Миозин включает легкий меромиозин (ЛММ), образующий стержневую часть молекулы, и тяжелый меромиозин (ТММ), соответствующий участкам Г и связующей шейки. Участки сгибания молекулы миозина показаны стрелками. 2 - стержневые части молекул миозина собраны в пучки (П), снаружи которых располагаются миозиновые Г. 3 - толстые миофиламенты (ТЛМФ) образованы П молекул миозина, соединенными зеркально концами друг с другом. Центральная часть ТЛМФ - гладкая, периферические содержат многочисленные миозиновые Г.
Тонкие нити (миофиламенты) содержат сократимый белок актин (на него приходится 20% белков миофибриллы) и два регуляторных белка - тропонин (около 2%) и тропомиозин (около 7%). Последние формируют функционально единый тропонин-тропомиозиновый комплекс.
Актин в мономерной форме представлен полярными глобулярными субъединицами диаметром 4-5 нм (G-актин), которые имеют активные центры, способные связываться с молекулами миозина. G-актин агрегирует с образованием полимерного фибриллярного актина (F-актина), молекула которого имеет вид двух скрученных нитей толщиной 7 нм и вариабельной длины (рис. 13-5).
- 411 -
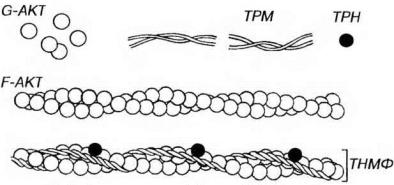
Рис. 13-5. Строение тонких миофиламентов. Тонкие миофиламенты (ТНМФ) содержат сократимый белок актин (АКТ) и два регуляторных белка - тропонин (TPH) и тропомиозин (TPM). Глобулярные субъединицы АКТ (G-AKT), агрегируют с образованием фибриллярного АКТ (F-AKT), молекула которого имеет вид двух скрученных нитей. TPM образован нитевидными молекулами, соединяющимися своими концами и образующими тяж, лежащий в борозде молекулы F-AKT. ТРН - глобулярный белок, связанный с молекулой ТРМ и формирующий с ней функционально единый комплекс ТРН-ТМ.
Тропомиозин представлен нитевидными молекулами, которые соединяются своими концами, образуя длинный тонкий тяж, лежащий в борозде, образуемой перевитыми нитями F-актина. Так как таких борозд на молекуле актина две, то и тропомиозиновых нити тоже две. Всего в состав тонкой нити входит примерно 50 молекул тропомиозина.
Тропонин представляет собой глобулярный белок, каждая его молекула располагается на тропомиозиновой молекуле вблизи ее конца. Тропонин состоит из трех субъединиц: ТnС - связывающей кальций, ТnТ - прикрепляющейся к тропомиозину, и TnI - ингибирующей связывание миозина с актином.
Механизм мышечного сокращения описывается теорией скользящих нитей, согласно которой укорочение каждого саркомера (а, следовательно, миофибрилл и всего мышечного волокна) при сокращении происходит благодаря тому, что тонкие нити вдвигаются в промежутки между толстыми без изменения их длины (рис. 13-6).
Скольжение нитей в саркомере и усилие, развиваемое мышцей, обеспечиваются благодаря циклической активности миозиновых мостиков, которые при сокращении повторно прикрепляются к актину, обес-
- 412 -

печивают усилие тяги, а затем открепляются от него (рис. 13-7). В этом механизме АТФ играет двойную роль, обеспечивая энергию, необходимую как для осуществления сокращения, так и для открепления мостиков.
Рис. 13-6. Механизм мышечного сокращения в соответствии с теорией скользящих нитей. Укорочение саркомеров (СМ) при сокращении (2) по сравнению с их состоянием в покое (1) происходит благодаря тому, что тонкие миофиламенты (ТНМФ) вдвигаются в промежутки между толстыми (ТЛМФ) без изменения их длины. Остальные обозначения - как на рис. 13-3.
Строгая пространственная упорядоченность взаимодействия множества толстых и тонких нитей в саркомере определяется наличием сложно организованного поддерживающего аппарата (см. ниже). Его элемента на всех этапах мышечного сокращения и расслабления, динамично перестраиваясь, фиксируют и удерживают миофиламенты в правильном положении, которое оптимальным образом обеспечивает их взаимный контакт, взаимодействие и взаимное скольжение.
- 413 -
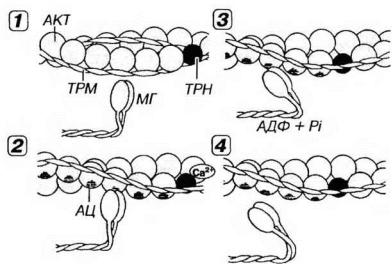
Рис. 13-7. Молекулярные механизмы мышечного сокращения. 1 - в покое миозиновые головки (МГ), с которыми связаны молекулы АТФ, неспособны взаимодействовать с активными центрами (АЦ) на молекуле актина (АКТ), потому что последние прикрыты комплексом тропонин-тропомиозин (ТРНТРМ). 2 - мышечное сокращение начинается вследствие повышения концентрации Са2+, который воздействует на ТРН. Возникающее изменение конформации ТРН и смещение молекулы связанного с ним ТРМ демаскирует АЦ на молекуле АКТ, с которыми связываются МГ, образуя поперечные мостики. 3 - за счет сгибания МГ в области их прикрепления к молекуле АКТ развивается усилие, смещающее тонкие миофиламенты (ТНМФ) вдоль толстых (ТЛМФ) к центру саркомера (см. рис. 13-06). АТФ при этом гидролизуется до АДФ и фосфата (Pi). 4 - размыкание мостика и его отделение от ТНМФ наступают вследствие связывания с ним новой молекулы АТФ. Далее мостик принимает исходное положение (перпендикулярное ТНМФ) и начинается новый цикл сокращения. Циклическое взаимодействие МГ и ТНМФ будет продолжаться при сохранении высокой концентрации ионов Са2+ и наличии АТФ.
В покое (при очень низкой концентрации ионов Са2+) в миофибрилле расслабленного мышечного волокна толстые и тонкие нити не соприкасаются. Миозиновые головки (с которыми связаны молекулы АТФ) не могут взаимодействовать с активными центрами (участками связывания миозина) на молекуле актина, потому что последние прикрыты тропонин-тропомиозиновым комплексом. Толстые и тонкие филаменты беспрепятственно скользят друг относительно друга. При этом мышечные волокна почти не сопротивляются пассивному растяжению. Такое состояние свойственно разгибательной мышце при сокращении соответствующей сгибательной. В отсутствие тропомиозина и тропонина (в условиях in vitro) миозин непрерывно взаимодействует с актином (пока имеется АТФ).
- 414 -
Мышечное сокращение вызывается резким повышением концентрации ионов Са2+ в области миофиламентов и включает несколько этапов (см. рис. 13-
7[2-4]).
A. Связывание ионов Са2+ с тропонином и освобождение активных центров на молекуле актина. Ионы Са2+ связываются с ТnС-субъединицами тропонина на тонких филаментах. При этом тропонин изменяет свою конформацию, смещает молекулы тропомиозина и открывает активные центры (участки связывания миозина) на молекуле актина.
Б. Связывание миозина и актина (формирование поперечных мостиков).
Миозиновые головки связываются с активными центрами на молекуле актина, формируя мостики, расположенные перпендикулярно продольной оси нити. Менее чем через 1 мс после этого под влиянием актомиозинового комплекса происходит гидролиз АТФ и отщепление его продуктов (АДФ и неорганического фосфата). При этом угол наклона мостика относительно продольной оси нити изменяется до 40°. Такой конформационный переход, происходящий в области прикрепления головки миозиновой молекулы, обусловливает развитие усилия и смещение тонких филаментов к центру саркомера. Предполагается, что "рабочий ход" миозинового мостика составляет около 10 нм; таким образом за один цикл мостик вызывает относительное перемещение тонких нитей на расстояние, равное примерно 1/200 длины саркомера.
B. Размыкание мостика. Связывание новой молекулы АТФ с мостиком вызывает его отделение от тонкого филамента. Мостик размыкается, возвращаясь в прежнее положение относительно миозиновой нити и может прийти в замыкание со следующим активным центром на тонкой. Каждый цикл замыкания-размыкания сопровождается расщеплением молекулы АТФ. В живой мышце это осуществляется с интервалом в несколько десятков миллисекунд после присоединения новой молекулы АТФ. В трупной мышце, где АТФ отсутствует, мостик не может разомкнуться, и мышца переходит в состояние трупного окоченения (rigor mortis).
При сокращении мышцы не происходит одновременного замыкания всех мостиков - их число нарастает по ходу его развития. При последующем расслаблении мышцы число мостиков снижается.
Изменение длины саркомера при сокращении является результатом относительного продольного смещения толстых и тонких нитей. При этом ширина A-диска не меняется; по мере проникновения в него тонких нитей происходит укорочение I-диска; соответственно значительно сужается Н- полоска (см. рис. 13-6).
- 415 -
Расслабление после мышечного сокращения происходит в результате снижения концентрации Са2+ в области саркомера, которое вызывает отщепление Са2+ от ТnС-субъединицы тропонина и возвращение тропонина в первоначальное конформационное состояние. Нити тропомиозина при этом вновь закрывают активные центры на молекулах актина, что обусловливает прекращение циклического образования мостиков.
Аппарат передачи возбуждения (саркотубулярная система) необходим для того, чтобы распространяющаяся по сарколемме волна деполяризации могла вызвать срабатывание сократительного аппарата миофибрилл. В мышечном волокне связь между возбуждением и сокращением выполняют две специализированные мембранные системы - саркоплазматическая сеть и поперечные (Т-) трубочки (от англ. transverse - поперечный), образующие функционально единую саркоту-булярную систему (рис. 13-8).
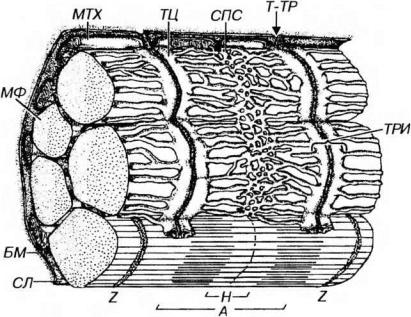
Рис. 13-8. Саркотубулярная система волокна скелетной (соматической) мышечной ткани. Саркотубулярная система включает саркоплазматическую сеть (СПС) и поперечные, или Т-трубочки (Т-ТР). СПС окружает каждый саркомер миофибриллы; ее трубочки сливаются, образуя пары плоских терминальных цистерн (ТЦ). Т-ТР представляют собой впячивания сарколеммы (С/1), отходящие от нее под прямым углом и проникающие в промежуток между двумя ТЦ, в совокупности с которыми они формируют триады (ТРИ). МФ - миофибриллы. Обозначения компонентов саркомера - те же, что на рис.
13-3.
- 416 -
Саркоплазматическая сеть - система уплощенных, вытянутых и анастомозирующих мембранных трубочек и мешочков, которая окружает каждый саркомер миофибриллы наподобие муфты. В области наружных отделов А- и I-дисков трубочки сливаются, образуя пары плоских терминальных цистерн (на каждый саркомер приходится по две такие пары). Саркоплазматическая сеть обладает выраженной способностью депонировать и выделять ионы кальция. Ее мембрана содержит высокие концентрации интегральных белков, являющихся кальциевыми насосами, а на внутренней поверхности находится белок кальсеквестрин, связывающий ионы Са2+.
Поперечные (Т-) трубочки представляют собой впячивания сарколеммы, отходящие от нее под прямым углом к оси волокна и расположенные у млекопитающих вблизи границы I- и А- дисков. Ветви соседних Т-трубочек опоясывают каждый саркомер и анастомозируют друг с другом. Конечные участки Т-трубочек проникают в промежуток между двумя терминальными цистернами саркоплазматической сети (см. рис. 13-8), формируя вместе с ними особые структуры - триады. В области триады между параллельно лежащими мембранами Т-трубочки и терминальных цистерн, разделенными узкой щелью, имеются специализированные контакты, которые образованы рядами плотных частиц (ножек), предположительно служащие каналами выделения кальция.
Выделение кальция происходит после того, как волна деполяризации с поверхности сарколеммы по Т-трубочкам распространяется вглубь волокна. В области триад возбуждение передается на мембрану саркоплазматической сети и вызывает повышение ее проницаемости. Это приводит к быстрому выделению из ее элементов ионов кальция (главным образом, в области терминальных цистерн). Выделившийся Са2+ диффундирует в миофибриллы, где он, присоединяясь к тропониу, запускает механизм взаимодействия актина и миозина (см. выше). Концентрация Са2+ вокруг миофиламентов при этом резко повышается с 10-7М до 10-5М.
Активный обратный транспорт кальция в саркоплазматическую сеть
(секвестрация кальция) происходит наряду с его выбросом, который представляет собой кратковременный процесс. Обратный транспорт Са2+ осуществляется благодаря деятельности кальциевых насосов (Са-зависимой АТФазы) в мембране саркоплазматической сети. Падение концентрации Са2+ вследствие его секвестрации приводит к возвращению тропонина в первоначальное конформационное состояние, прекращению взаимодействия миозиновых мостиков с актином и расслаблению мышечного волокна.
- 417 -
Опорный аппарат мышечного волокна включает особые элементы цитоскелета, обеспечивающие высокоупорядоченное расположение миофиламентов и миофибрилл внутри волокна, а также связанную с ними сарколемму и базальную мембрану (см. рис. 13-3, 13-6 и 13-8), соединяющие мышечное волокно с сухожилием, на которое передается усилие, развиваемое волокном при сокращении.
Телофрагма (Z-линия) - область прикрепления тонких миофиламентов двух соседних саркомеров; она имеет вид плотной полоски шириной 30-100 нм без резких границ. Представляет собой сложную трехмерную решетку из особых тонких нитей (Z-филаментов), идущих зигзагообразно под углом 45° к оси саркомера и образующих тетрагональную (четырехугольную) структуру, связывающую тонкие нити двух соседних саркомеров. В ячейках решетки этих филаментов имеется плотный материал. В состав Z-линий входит ряд белков: α- актиния, филамин, Z-белок.
Мезофрагма (М-линия) - плотная линия шириной 75-85 нм, расположенная в центре А-диска и являющаяся областью закрепления толстых (миозиновых) филаментов в саркомере. Она образована центральными участками миозиновых филаментов, которые располагаются в виде гексагональных фигур и связаны друг с другом системой мостиков, состоящих из тонких нитей белков миомезина, креатинкиназы и М-белка.
Титин (коннектин) представляет собой белок с эластическими свойствами, нити которого присоединены к толстым филаментам по всей их длине и, продолжаясь в I-диски, прикрепляют концы толстых филаментов к Z- линиям. Таким образом, нити титина связывают М и Z-линии, и, благодаря своей эластичности, препятствуют перерастяжению мышцы. Они образуют внутри саркомера решетчатую структуру и поддерживают упорядоченное взаимное расположение системы толстых и тонких миофиламентов.
Небулин - белок, имеющий вид удлиненных нитей, расположенных по всей ширине I-диска параллельно тонким филаментам, с которыми он связан. Предполагается, что небулин отвечает за поддержание длины тонких филаментов и (или) обеспечивает их механическую стабилизацию.
Промежуточные филаменты (диаметром около 10 нм), состоящие из белка десмина, являются важным элементом цитоскелета и образуют в пределах мышечного волокна две пространственные системы. Первая
- 418 -
состоит из филаментов, которые располагаются в саркомерах продольно и связывают соседние телофрагмы одной миофибриллы. Вторая представлена поперечно ориентированными филаментами, которые связывают мезофрагмы, а также телофрагмы соседних миофибрилл друг с другом. Такие же филаменты прикрепляют телофрагмы к сарколемме и элементам системы Т-трубочек и сарконлазматической сети. Благодаря описанной организации системы промежуточных филаментов поддерживается упорядоченное взаимное расположение саркомеров соседних миофибрилл и других компонентов мышечного волокна.
Дистрофии - белок, одними участками прикрепляющийся к актиновым филаментам, а другими - к комплексу гликопротеинов, которые пронизывают сарколемму и связываются на ее поверхности с компонентами базальной мембраны. Таким путем усилия, создаваемые внутри мышечного волокна, посредством ряда белков передаются на элементы межклеточного вещества. Генетический дефект, связанный с нарушением выработки дистрофина, обусловливает развитие мышечного заболевания - дистрофии Дюшенна (см. ниже).
Костамеры - кольца из белка винкулина, охватывающие изнутри мышечное волокно и расположенные перпендикулярно к его длинной оси. Они представляют собой участки непосредственного соединения между сарколеммой и подлежащими I-дисками миофибрилл. Благодаря наличию в костамерах интегринов они, также, возможно, являются структурами, которые через адгезивный гликопротеин фибронектин связывают элементы межклеточного вещества (например, коллагеновые волокна) с миофибриллами. Помимо винкулина, в костамерах имеются другие белки, связанные с цитоскелетом: талин, сиектрин, α-актинин.
Структура краевых участков мышечных волокон. На концах мышечных волокон сарколемма, покрытая базальной мембраной, образует многочисленные глубокие впячивания, в которые вдаются коллагеновые волокна сухожилия, вплетающиеся в базальную мембрану и прочно связывающие сухожилие с мышечными волокнами.
Энергетический аппарат мышечных волокон представлен митохондриями, вырабатывающими энергию, необходимую для осуществления мышечной работы, синтетических, транспортных и других процессов жизнеобеспечения, а также трофическими включениями, содержащими вещества, расщепление которых служит источником энергии.
Митохондрии в миосимпласте располагаются в виде цепочек под сарколеммой и между миофибриллами (см. рис. 13-8). Они имеют вытя-
- 419 -
нутую форму, содержат большое количество поперечно расположенных ламеллярных крист, характеризуются высокой активностью окислительновосстановительных ферментов. Их содержание и размеры больше в красных волокнах, чем в белых (см. ниже) и увеличиваются при тренировке мышц.
Энергия, необходимая для осуществления мышечной работы, запасается в мышечных волокнах в виде АТФ и фосфокреатина - энергоемких фосфатных соединений. Источником энергии служит расщепление гликогена и липидов. При кратковременных резких нагрузках на скелетные мышцы источником энергии служит глюкоза, получаемая преимущественно в результате расщепления гликогена. Главным источником энергии при выполнении работы, требующей выносливости, служат жирные кислоты.
Гликоген находится в саркоплазме (преимущественно белых волокон - см. ниже) в виде β-частиц диаметром 20-30 нм. Последние образуют скопления между миофибриллами, большей частью на уровне I-дисков. Запасы гликогена, составляющие 0.5-1% массы волокна, опустошаются при длительной интенсивной нагрузке.
Липидные капли располагаются между миофибриллами по всей толщине миосимпласта, образуя скопления преимущественно на уровне I-дисков. Их содержание варьирует в широких пределах, но в среднем выше в красных волокнах (0.5% объема саркоплазмы), чем в белых (0.2%).
Миоглобин - железосодержащий кислород-связывающий пигмент мышечных волокон, придающий им красный цвет и сходный по строению и функции с гемоглобином эритроцитов - типичное включение мышечного волокна, которое можно условно отнести к энергетическому аппарату. Миоглобин находится в более высоких концентрациях в красных волокнах (что и определяет их цвет); его способность к связыванию кислорода способствует повышению активности процессов окислительного фосфорилирования).
Синтетический аппарат мышечного волокна представлен свободными рибосомами и полирибосомами (особенно многочисленными под сарколеммой в области I-диска и вблизи ядер), цистернами грЭПС и комплексом Гольджн, элементы которого в виде сотен или тысяч стопок мешочков рассеяны по саркоплазме миосимпласта.
Лизосомальный аппарат (аппарат внутриклеточного переваривания)
в мышечных волокнах необходим для обеспечения постоянно протекающего процесса обновления его структурных
- 420 -
