
Быков- гистология( общая)
.pdfкомпонентов. Содержание лизосом связано с функциональной активностью мьппцы и возрастом человека. Остаточные тельца лизосомального генеза, содержание липофусцин, становятся многочисленными при старении и, в особенности, при резком снижении функциональной активности мышцы.
Миосателлитоциты - мелкие уплощенные клетки, располагающиеся в неглубоких вдавлениях сарколеммы миосимпластической части мышечного волокна и покрытые вместе с ней общей базальной мембраной (см. рис. 13-3). Ядро миосателлитоцита - плотное, относительно крупное (занимает почти всю клетку), с более высоким содержанием гетерохроматина, чем в ядрах миосимпласта, органеллы мелкие и немногочисленные. Эти клетки представляют собой камбиальные элементы скелетной мышечной ткани. Они активируются при повреждении мышечных волокон и обеспечивают их репаративную регенерацию. Слипаясь с симпластической частью волокна при усиленной нагрузке, миосателлитоциты участвуют в его гипертрофии. В мышечных волокнах у плода и новорожденного доля ядер миосателлитоцитов достигает 30-35% от общего содержания ядер; после рождения она быстро снижается, составляя в детстве 7-10%, а у взрослого - около 5%. Содержание этих клеток выше красных волокнах, чем в белых (см. ниже).
Типы мышечных волокон
Мышечные волокна в скелетных мышцах позвоночных животных и человека обладают, несмотря на общий план строения, определенными структурными, биохимическими и функциональными различиями. Используемые классификации мышечных волокон основаны на учете их различных признаков и совпадают неполностью. В обобщенном виде можно условно выделить три основных тина мышечных волокон, между которыми существуют переходные варианты (рис. 13-9): тип I (красные), тип IIВ (белые) и тип IIА (промежуточные).
Тип I - красные, медленные, тонические, устойчивые к утомлению, с небольшой силой сокращения, окислительные. Характеризуются малым диаметром, относительно тонкими миофибриллами, высокой активностью окислительных ферментов (например, сукцинатдегидрогеназы - СДГ), низкой активностью гликолитических ферментов и миозиновой АТФазы, преобладанием аэробных процессов, высоким содержанием миоглобина (определяющим их красный цвет), крупных митохондрий (занимают около 15% объема саркоплазмы) с многочисленными кристами и липидных включений, широкой (50-100 нм)
- 421 -

Z-линией, высоким содержанием миосателлитоцитов, богатым кровоснабжением. Численно преобладают в мышцах, выполняющих длительные тонические нагрузки.
Рис. 13-9. Типы мышечных волокон в скелетной мышце. На препарате - поперечном срезе мышечных волокон - проведено гистохимическое выявление фермента сукцинатдегидрогеназы (СДГ). Плотность продукта гистохимической реакции пропорциональна активности СДГ. Представлены три основных типа мышечных волокон: тип I (I) - красные (с высокой активностью СДГ), тип IIВ (IIВ) - белые (с низкой активностью СДГ) и тип IIА (IIА) - промежуточные (с умеренной активностью СДГ).
Тип IIВ - белые, быстрые, тетанические, легко утомляющиеся, с большой силой сокращения, гликолитические. Характеризуются большим диаметром, крупными и сильными миофибриллами, высокой активностью глпколитических ферментов (например, лактатдегидрогеназы - ЛДГ) и АТФазы, низкой активностью окислительных ферментов, преобладанием анаэробных процессов, относительно низким содержанием митохондрий (более мелких и с менее развитыми кристами, чем в волокнах I типа и занимающих около 7% объема саркоплазмы), липидов и миоглобина (определяющим их светлый цвет), значительным количеством гликогена, узкой (30-40 нм) Z-линией, относительно небольшим числом миосателлитоцитов, сравнительно слабым кровоснабжением. Преобладают в мышцах, выполняющих быстрые движения, например, мышцах конечностей.
- 422 -
Тип IIА - промежуточные, быстрые, устойчивые к утомлению, с большой силой, оксилительно-гликолитические. На препаратах напоминают волокна типа I. В равной степени способны использовать энергию, получаемую путем окислительных и гликолитических реакций. По своим морфологическим и функциональным характеристикам занимают положение, промежуточное между волокнами типа I и IIВ.
Красные и белые волокна различаются также содержанием различных изоформ миозина и субъединиц тропонина. В частности, изоформы миозина, характерные для белых волокон, отличаются более быстрой циклической активностью миозиновых мостиков, а, следовательно, большей скоростью сокращения.
Соотношение числа волокон различных типов в мышце. Скелетные мышцы человека являются смешанными, т.е. содержат волокна различных типов, которые распределены в них мозаично. Соотношение красных и белых волокон в мышцах каждого человека индивидуально, предопределено генетически и почти не меняется с возрастом. В мышцах большинства людей белые и красные волокна содержатся примерно в равных количествах. Вместе с тем, у отдельных людей могут преобладать волокна того или иного типа, что что позволяет им более успешно справляться с длительной физической нагрузкой небольшой мощности или с кратковременной тяжелой нагрузкой.
Изменения в волокнах различных типов при тренировке мышц
неодинаковы и зависят от характера нагрузок. Нарастание массы мышц при этом связано с увеличением диаметра (гипертрофией) мышечных волокон (главным образом, белых); в последние годы вновь высказываются взгляды о возможности некоторого увеличения и числа волокон при очень высоких нагрузках.
РЕГЕНЕРАЦИЯ СКЕЛЕТНОЙ МЫШЕЧНОЙ ТКАНИ
Физиологическая регенерация волокон скелетной мышечной ткани
непрерывно осуществляется в нормальных условиях на ультраструктурном уровне и состоит в самообновлении их органелл и других структурных компонентов, обеспечивающем поддержание баланса между анаболическими и катаболическими процессами.
Гипертрофия мышечных волокон развивается в ответ на повышенные нагрузки в результате преобладания анаболических процес-
- 423 -
сов над катаболическими. Она проявляется увеличением содержания компонентов их саркоплазмы; при этом нагрузки, требующие выносливости, вызывают увеличение всего объема саркоплазмы и, особенно, митохондрий, а скоростно-силовые нагрузки - преимущественное нарастание массы миофибрилл (вследствие увеличения их числа и диаметра).
Атрофия мышечных волокон возникает вследствие бездействия (при денервации или гипокинезии), а также при голодании.
Денервация вызывает снижение массы мышцы на 50% и более, уменьшение диаметра волокон, дезорганизацию сократительного аппарата и элементов цитоскелета, сглаживание различий их типов. Наиболее быстро атрофируются белые волокна, красные изменяются в меньшей степени.
Гипокинезия обусловливает более выраженные изменения в красных волокнах, которые более чувствительны к снижению нагрузки, чем белые, которые вовлекаются в процесс атрофии позднее. Выраженные явления мышечной атрофии развивается у космонавтов; наибольшие изменения при этом отмечены в красных мышечных волокнах.
Голодание сопровождается распадом белков миофибриллярного аппарата и поражает в первую очередь белые волокна.
Репаративная регенерация мышечных волокон направлена на восстановление их целостности после повреждения и частично напоминает эмбриональный миогенез. При любых видах травмы процесс регенерации включает закономерную последовательность явлений:
(1)инфильтрацию области повреждения фагоцитами,
(2)восстановление целостности сосудов (реваскуляризацию),
(3)фагоцитоз некротизированных мышечных волокон,
(4)пролиферацию миогенных клеток-предшественников,
(5)их последующее слияние с образованием мышечных трубочек,
(6)дифференцировку трубочек с образованием зрелых мышечных волокон,
(7)восстановление иннервации.
Миграция фагоцитов (нейтрофилъных гранулоцитов и макрофагов) в
область повреждения происходит под хемотаксическим действием продуктов, выделяемых травмированными волокнами. Устремляясь к поврежденным волокнам, фагоциты активно поглощают тканевой детрит, часто сохраняя базальную мембрану разрушенных волокон. Вместе с тем, получены сведения, что чрезмерная активация инфильтрирующих фагоцитов в очаге повреждения может вызвать их дегрануляцию с выделением ряда токсических продуктов, воздействие которых способно усугубить начальное повреждение мышечных волокон.
- 424 -
Собственно регенерация мышечных волокон начинается одновременно с поглощением фрагментов некротизированной ткани фагоцитами и, очевидно, может осуществляться несколькими механизмами:
1.Путем роста утолщенных концов поврежденных волокон (мышечных почек) навстречу друг другу, который обеспечивается в результате формирования в их миофибриллах новых саркомеров, связывающихся с ранее образованными (подобно тому, как это происходит при физиологическом росте мышцы),
2.Путем активации системы миосателлитоцитов (вблизи участка травмы), которые усиленно размножаются, мигрируют в область повреждения, располагаясь внутри цилиндров, образованных базальной мембраной разрушенных волокон, и дифференцируются в миобласты. Миобласты в дальнейшем, по-видимому, могут:
(а) сливаться друг с другом и формировать мышечные трубочки (подобно тому, что происходит при эмбриональном развитии мышцы), превращающиеся
вновые мышечные волокна, которые соединяются с концами сохранившихся и постепенно замешают дефект между ними;
(б) включаться в мышечные почки, усиливая их рост навстречу друг другу.
Пролиферация миосателлитоцитов вблизи участка травмированной мышечной ткани происходит под митогенным влиянием веществ, выделяемых поврежденными волокнами. Этот процесс и последующая дифференцировка миосателлитоцитов регулируются рядом факторов роста (ФРФ, ТРФР. инсулиноподобный фактор роста и др.).
Использование миосателитоцитов для стимуляции регенерации мышечной ткани стало реальным в последние годы благодаря возможности выделения этих клеток из ткани. В настоящее время разрабатываются методы стимуляции восстановления структуры поврежденных скелетных мышц путем введения в них миосателлитоцитов. В экспериментальных условиях предприняты также попытки использования этих клеток для замещения погибшей сердечной мышечной ткани. Показано, в частности, что при введении в поврежденный миокард миосателлитоциты формируют волокна скелетной мышечной ткани, которые устанавливают связь с кардиомиоцитами.
Новые мышечные волокна, образовавшиеся в зонах повреждения в результате слияния миобластов, - тонкие, нередко с центрально расположенными (как в мышечных трубочках) ядрами. Неполностью сливаясь друг с другом или исходным регенерирующим волокном, они формируют так называемые расщепленные волокна. Такая картина, в част-
- 425 -
ности, отмечается в биоптатах мышц при различных миопатнях, при которых процессы повреждения сочетаются с явлениями регенерации.
Полноценная регенерация мышечных волокон возможна лишь при их незначительных дефектах; ее условием является сохранение целостности их базальной мембраны. Предполагают, что базальная мембрана служит своеобразным барьером, предотвращающим проникновение клеток фибробластического ряда в поврежденное волокно, но пропускающим макрофаги, поглощающие некротизированную ткань. Она осуществляет также роль направляющей, поддерживающей и ориентирующей структуры для мигрирующих миосателлитоцитов и для формирующихся мышечных трубочек, обеспечивает условия микроокружения, оптимальные для процесса регенерации.
Неполноценная регенерация мышечных волокон наблюдается при значительной травме мышцы (сопровождающейся обширным повреждением не только мышечных волокон, но и соединительнотканных структур). Полноценной регенерации в этих случаях обычно препятствует разрастание соединительной ткани эндо- и перимизия (см. ниже). Последняя быстро заполняет область дефекта и в конечном итоге образует в области краев поврежденных мышечных волокон соединительнотканный рубец, который является барьером, препятствующим их воссоединению. Функция мышцы при этом остается нарушенной.
Эктопическое развитие костной ткани внутри поврежденной скелетной мышцы отмечается в некоторых случаях через 2-3 нед. после травмы. Оно происходит, очевидно, вследствие активизации малодифференцированных остеогенных клеток-предшественников, лежащих в соединительнотканных структурах травмированного участка мышцы, которые превращаются в остеобласты. Индукции этих клеток метут способствовать вещества, выделяемые поврежденными мышечными волокнами.
СКЕЛЕТНАЯ МЫШЦА КАК ОРГАН
Скелетная мышца состоит из пучков мышечных волокон, связанных воедино системой соединительнотканных компонентов.
Количество мышечных волокон в отдельных мышцах человека варьирует в широких пределах. Так, в четырехглавой мышце бедра (m. quadriceps femoris) оно составляет около 1.7 млн., икроножной мышце (m. gastrochnemius) - 1-1.5 млн., портняжной мышце (m. sarto-
- 426 -
rius) - 100-200 тыс., в двуглавой и трехглавой мышцах плеча (m. biceps и т. triceps brachii) оно примерно одинаково и колеблется в пределах 200-600 тыс.
Соединительнотканные компоненты мышцы представлены эпимизием,
перимизием и эндомизием (рис. 13-10). Общее содержание соединительной ткани в скелетной мышце очень значительно - в зависимости от типа мышцы коллаген соединительной ткани составляет от 3 до 30% ее белков.
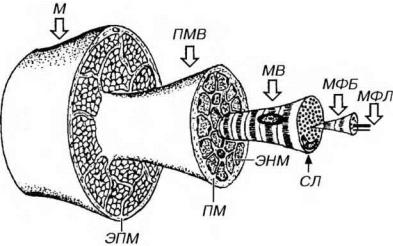
Рис. 13-10. Структурная организация скелетной мышцы. Мышца (М) покрыта эпимизием (ЭПМ), отдающим вглубь более тонкие соединительнотканные перегородки - перимизий (ПМ), который образует оболочки пучков мышечных волокон (ПМВ). От ПМ внутрь ПМВ отходят тончайшие прослойки рыхлой волокнистой соединительной ткани, окружающие каждое мышечное волокно (МВ), именуемые эндомизием (ЭНМ). МВ покрыто сарколеммой (СЛ) и базальной мембраной (не показана) и обладает поперечной исчерченностью; в его центральной части содержатся поперечно исчерченные миофибриллы (МФБ), образованные системой тонких и толстых миофиламентов - МФЛ.
Эпимизий - тонкий, прочный и гладкий снаружи чехол из плотной волокнистой соединительной ткани, окружающий всю мышцу.
Перимизий - тонкие, разветвляющиеся и не всегда четко очерченные соединительнотканные перегородки, отходящие от внутренней поверхности эпимизия вглубь мышцы. Он образует оболочки отдельных пучков мышечных волокон, численностью 10-100 (наиболее часто - около 20) волокон.
- 427 -
Эндомизий - тончайшие прослойки рыхлой волокнистой соединительной ткани, отходящие от перимизия внутрь пучков мышечных волокон и окружающие каждое мышечное волокно. Соединительнотканные волокна эндомизия вплетаются в базальную мембрану мышечных волокон.
КРОВОСНАБЖЕНИЕ СКЕЛЕТНОЙ МЫШЕЧНОЙ ТКАНИ
Кровоснабжение скелетной мышечной ткани осуществляется артериями, которые проникают в мышцу вместе с нервами через эпимизий и идут вдоль прослоек перимизия, постепенно разветвляясь. Между этими ветвями имеются многочисленные анастомозы. Тонкие артериальные веточки располагаются перпендикулярно длинной оси мышечных волокон, а отходящие от них капилляры проходят в эндомизии вдоль волокон, соединяясь перемычками и образуя густую сеть. При сокращении мышцы капилляры спиралеобразно скручиваются. Мышца относится к числу обильно васкуляризованных тканей - на одно мышечное волокно приходится в среднем 3-4 капилляра.
ИННЕРВАЦИЯ СКЕЛЕТНОЙ МЫШЕЧНОЙ ТКАНИ
Скелетные мышцы обладают эфферентной (двигательной) и афферентной (чувствительной) иннервацией.
Эфферентная иннервация скелетных мышц обеспечивается нервными волокнами (аксонами α-мотонейронов), образующими на мышечных волокнах специализированные нервно-мышечные окончания (нервно-мышечные синапсы, или моторные бляшки), которые осуществляют передачу возбуждения с нервного волокна на мышечное. Описание нервно-мышечных окончаний представлено в главе 14. Один мотонейрон может иннервировать различное количество мышечных волокон.
Двигательная единица (ДЕ) представляет собой совокупность мотонейрона и иннервируемых им мышечных волокон. Количество мышечных волокон, входящих в одну ДЕ, минимально в мелких мышцах, осуществляющих точные и тонкие движения. В глазных мышцах человека ДЕ включает от 2-6 до 13-20 мышечных волокон, в мышцах кисти - от 10-25 до 100-300, в мышцах туловища - 1500-2000. Управление мышечной активностью обеспечивается как изменением частоты активации ДЕ, так и вовлечением различного их числа в процесс сокращения.
- 428 -
Мышечные волокна, образующие одну ДЕ, обладают одинаковыми механическими свойствами, гистохимическими характеристиками и относятся к одному типу, однако рассеяны по обширной территории мышцы.
Афферентная иннервация скелетных мышц обеспечивается нервномышечными веретенами - рецепторами растяжения волокон поперечнополосатых мышц, которые представляют собой сложные инкапсулированные нервные окончания, состоящие из веточек нервных волокон, оплетающих особые тонкие (интрафузальные) мышечные волокна, заключенные в тончайшую соединительнотканную капсулу. Остальные мышечные волокна называются экстрафузальными. Нервно-мышечные веретена описаны в главе 14.
Клиническое значение нарушений структурно-функциональной организации скелетных мышц. Система скелетных мышц поражается разнообразными заболеваниями, из которых наибольшее клиническое значение имеют две группы. Первая включает тяжелые дистрофические расстройства (часто генетически обусловленные), при которых первично нарушается структура и функция мышечной ткани. Вторая группа заболеваний обусловлена нарушением иннервации мышечных волокон.
Мышечная дистрофия Дюшенна является наиболее распространенным заболеванием, относящимся к первой группе и имеющим наследственный характер. Она поражает мальчиков, проявляется нарастающей мышечной слабостью и приводит к смерти в молодом возрасте. Причина заболевания заключается, по-видимому, в нарушении функции гена, контролирующего выработку белка дистрофина, функция которого, как предполагают, заключается в обеспечении связи между миофибриллами и элементами межклеточного вещества (см. выше). В отсутствие этого белка мышечные волокна становятся очень непрочными, легко повреждаются и гибнут при небольших нагрузках, замещаясь соединительной тканью.
Амиотрофический латеральный склероз представляет собой наследственное заболевание, относящееся ко второй из указанных групп. При этом заболевании атрофия мышечной ткани и смерть больного от поражения дыхательных мышц обусловлены дегенеративными изменениями мотонейронов спинного мозга.
Злокачественная миастения (myasthenia gravis) также относится к мышечным расстройствам, обусловленным нарушениями иннервации. В ее основе лежит аутоиммунный процесс, который характеризуется образованием антител к рецепторам ацетилхолина на сарколемме нервно-мышечного синапса. Связывание этих антител с рецепторами приво-
- 429 -
дит к нарушению их функции. При миастении отмечается прогрессирующая резко выраженная мышечная слабость.
Ботулизм является пищевым отравлением токсином, вырабатываемым бактериями Clostridium botulinum, который нарушает выделение медиатора в нервно-мышечном синапсе. Это тяжелое заболевание сопровождается параличом скелетных мышц.
СЕРДЕЧНАЯ МЫШЕЧНАЯ ТКАНЬ
Сердечная мышечная ткань (поперечнополосатая мышечная ткань целомического типа) встречается только в мышечной оболочке сердца (миокарде) и устьях связанных с ним крупных сосудов. Ее клетки (сердечные миоциты, или кардиомиоциты) составляют лишь 30-40% общего числа клеток сердца, но образуют 70-90% его массы. Основным функциональным свойством сердечной мышечной ткани служит способность к спонтанным ритмическим сокращениям, на активность которых влияют гормоны и нервная система (симпатическая и парасимпатическая).
ГИСТОГЕНЕЗ СЕРДЕЧНОЙ МЫШЕЧНОЙ ТКАНИ
Источником развития сердечной мышечной ткани служит миоэпикардиальная пластинка висцерального листка спланхнотома (целомическая выстилка в шейной часта эмбриона). Клетки этой пластинки (миобласты) активно размножаются митозом и постепенно образуют миофиламенты, формирующие миофибриллы. С появлением последних клетки именуются сердечными миоцитами, или кардиомиоцитами). Миофибриллы первоначально не обладают поперечной исчерченностыо и строгой ориентацией в клетке; в дальнейшем они располагаются вдоль ее длинной оси, а их тонкие филаменты прикрепляются к уплотненным участкам сарколеммы (Z-вешеству) у концов кардиомиоцитов.
Дифференцировка кардиомиоцитов, в отличие от волокон скелетной мышечной ткани, сочетается с их размножением: гликоген и миофибриллы накапливаются в саркоплазме клеток, которые еще продолжают делиться, уже обладая сократительной способностью. В период деления сердечных миоцитов часть их миофибрилл подвергается распаду с последующей повторной сборкой. В цитоплазме дифференцирующихся кардиомиоцитов нарастает содержание рибосом, цистерн грЭПС, митохондрий. Из-за отсутствия цитотомии при делении некото-
- 430 -
