
- •Биокинетика
- •Глава 1. Введение в биокинетику
- •Предмет изучения биокинетики
- •Химическая кинетика как основа биокинетики
- •1.2.1. Современные представления о механизме химической реакции
- •1.2.2. Скорость химической реакции
- •1.2.3. Константа равновесия
- •1.2.4. Выражения для константы скорости элементарной химической реакции
- •1.2.5. Влияние pH на скорость химической реакции
- •1.2.6. Кинетический эксперимент
- •Глава 2. Ферментативный катализ
- •2.1. Кинетические схемы и механизм ферментативной реакции
- •2.1.1. Схема Михаэлиса-Ментен
- •2.1.2. Определение параметров Wm и Km из экспериментальных данных
- •2.1.3. Метод графов при анализе кинетических схем
- •2.1.4. Определение концентрации активных центров
- •2.2. Типичные зависимости начальной стационарной скорости реакции от концентрации субстрата
- •2.2.1. Ингибирование и активация избытком субстрата
- •2.2.2. Аллостерические эффекты
- •2.3. Многосубстратные реакции
- •2.4.2. Релаксационная кинетика
- •2.5. Влияние температуры и pH на скорость ферментативных реакций
- •2.6. Ингибирование ферментативных реакций
- •2.7. Инактивация ферментов
- •2.8. Полиферментные системы. Сопряженные ферментные реакции
- •2.9. Кинетика действия ферментов в открытых системах
- •3.1.1. Химическое строение рецепторов и лигандов
- •3.1.2. Агонисты и антагонисты
- •3.2.3. Строение и функционирование g-белок сопряженных рецепторов
- •3.2.4. Механизмы внутриклеточного проведения и усиления рецепторного сигнала
- •3.2.5. Инактивация рецепторного сигнала
- •3.3.1. Диффузия рецепторов
- •3.3.2. Связываение нескольких молекул лиганда с одним рецептором
- •1) Координаты Хилла.
- •2) Координаты Бьеррума.
- •3.4. Взаимодействие нескольких лигандов с одним рецептором
- •3.5. Учет функции распределения клеток по количеству рецепторов на мембране
- •3.6. Феномен колебаний рецепторного связывания
- •Глава 4. Клеточный рост
- •4.1. Клеточный цикл
- •4.2. Экспоненциальная фаза роста
- •4.2.1. Многосубстратные процессы
- •4.2.2. Ингибирование и активация клеточного роста
- •4.2.3. Влияние pH
- •4.4.1. Выражение для удельной скорости клеточного роста в экспоненциальной фазе
- •4.4.2. Многостадийность клеточного цикла
- •5.1. Пассивный транспорт
- •5.2. Активный ионный транспорт
- •Глава 6. Эндоцитоз
2.4.2. Релаксационная кинетика
Релаксационные методы основаны на том принципе, что при быстром внешнем воздействии на систему (изменение температуры, давления, пр.) время, которое нужно системе для достижения нового равновесия (или стационарного состояния), зависит от скорости химической реакции (и иногда от скорости диффузии реагентов.
Рассмотрим простейшую реакцию комплексообразования активного центра фермента с лигандом
![]() (2.49)
(2.49)
В начале система
находится в равновесии, которое
характеризуется константой равновесия
K0=K(T0)
и соответственно равновесными
концентрациями![]() ,
,![]() ,
,![]() .
Предположим, что в системе резко меняется
температураT->T0+T.
Это приводит к изменению константы
равновесияK->K0+K, которое определяется отношением
.
Предположим, что в системе резко меняется
температураT->T0+T.
Это приводит к изменению константы
равновесияK->K0+K, которое определяется отношением
![]() (2.50)
(2.50)
где H– стандартное изменение энтальпии. После этого система переходит в новое равновесное состояние:
![]() (2.51)
(2.51)
 (2.52)
(2.52)
Уравнение (2.51) нелинейно. Предположим, что отклонение от равновесия невелико и тогда
![]() (2.53)
(2.53)
и уравнение (2.51) преобразуется в линейное дифференциальное уравнение:
![]() (2.54)
(2.54)
Решение этого дифференциального уравнения:
![]() (2.53)
(2.53)
Величина
![]() (2.54)
(2.54)
называется временем релаксации.
2.5. Влияние температуры и pH на скорость ферментативных реакций
Влияние этих факторов на скорость элементарной химической реакции было рассмотрено в Гл.1. Особенность состоит в том, что ферментативные реакции являются сложными многостадийными реакциями (состоящие из многих элементарных реакций). Кроме того, состояние молекул фермента в растворе характеризуется набором конформеров, обратимо переходящих друг в друга. Конформационные переходы молекулы определяются в значительной степени температурой и pHраствора.
2.6. Ингибирование ферментативных реакций
Вещества, подавляющие каталитическую активность ферментов, называются ингибиторами. Различают два основных класса ингибиторов –обратимые
![]() (2.55)
(2.55)
(пестициды, зарин, зоман, аспирин и др.)
и необратимые(инактиваторы)
![]() (2.55)
(2.55)
(окись углерода, цианид-ион, анальгин и др.)
2.7. Инактивация ферментов
Биополимерные молекулы (ферменты) являются термодинамически неустойчивыми и, как правило, с течением времени изменяют свою структуру и свойства. В большинстве случаев процесс инактивации может быть описан как переход между двуми состояниями фермента активного Eaи неактивногоEi:
![]() (2.56)
Кинетика процесса описывается
соответствующим дифференциальным
уравнением
(2.56)
Кинетика процесса описывается
соответствующим дифференциальным
уравнением
 (2.57)
(2.57)
и характеризуется постоянной времени
![]() (2.58)
(2.58)
Процесс инактивации фермента может иметь различную физико-химическую природу. Наиболее общим является тепловая денатурация, представляющая собой существенную перестройку макромолекулы, изменение третичной и частично вторичной структуры.
Для целей инактивации могут быть использованы кавитационный ультразвук, радиоактивное излучение и пр.
Изменение pHтакже может привести к денатурации фермента. При каждом значенииpHбелок характеризуется соответствующим распределением зарядов (ионогенные группы). При очень низких или очень высокихpHраспределение зарядов может существенно поляризовать молекулу, приводить к появлению изомеров и необратимо конформировать ее с разрушением структуры активного центра. Например:

Денатурацию фермента вызывают и денатурирующие агенты, разрушающие вторичную структуру белка (например, мочевина), а также окислительные процессы с участием кислорода.
При изучении таких процессов важная информация получена релаксационными методами. Как правило, конформационные изменения сопровождаются изменением окружения ароматических аминокислот – тирозина и триптофана (полоса поглощения излучения на 290 нм). Это проявляется в изменении спектров поглощения и флуоресценции.
Обратимые конформационные изменения обычно идут со временем 0.1-100 мс, а необратимые – 1-1000 мин.
Пример 1.Простейшая кинетическая схема инактивации с равновесием конформеров:
![]() (2.59)
(2.59)
Кинетика процесса описывается одним характеристическим временем
![]() (2.60)
(2.60)
Пример 2.Инактивации подвержены оба конформера:
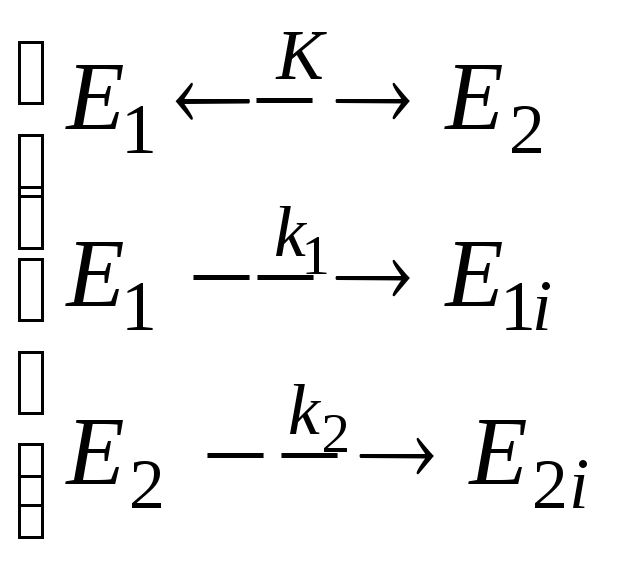 (2.61)
(2.61)
![]() (2.62)
(2.62)
Пример 3.Более общий случай для системы с участиемnконформеров:
![]() (2.63)
(2.63)
![]() (2.64)
(2.64)
Часто ферменты в растворе образуют димеры, и в димерной форме оказываются стабильнее. Тогда наблюдается диссоциативный механизм инактивации:
![]() (2.65)
(2.65)
Следующая схема отражает возможные механизмы инактивации в процессе реакции (мономолекулярная инактивация свободной формы фермента, мономолекулярная инактивация фермен-субстратного комплекса, бимолекулярная инактивация фермента субстратом, бимолекулярная инактивация фермента продуктом):
 (2.66)
(2.66)
Дискриминация механизмов инактивации и определение кинетических характеристик реакции обычно проводится несколькими методами:
анализируя зависимость выхода продукта от концентрации фермента;
устанавливая связь степени конверсии субстрата со степенью инактивированности фермента;
проведение реакции при низких степенях конверсии субстрата и низких концентрациях фермента;
проведение реакции при больших концентрациях фермента;
предынкубация фермента с компонентами реакции;
использование интегральных уравнений реакции.
