
Naselenie_Gornogo_Altaya_v_epokhu_rannego_zheleznogo_veka_kak_etnokulturny_fenomen
.pdf
ÃËÀÂÀ 3
ПАЛЕОГЕНЕТИЧЕСКИЕ ИССЛЕДОВАНИЯ НОСИТЕЛЕЙ КУЛЬТУРЫ РАННЕГО ЖЕЛЕЗНОГО ВЕКА ГОРНОГО АЛТАЯ (ПЛОСКОГОРЬЕ УКОК)
ИНТЕГРАЦИОННЫЕ ПРОЕКТЫ
Современные методы молекулярной генетики позволяют пол учать генотипиче- ские характеристики ДНК представителей разных историче ских эпох. Выделение и клонирование ДНК из египетской мумии впервые было осуществлено С. Паабо в 1986 г. [1]. Дальнейший прогресс в этой области связан с изобретением полимеразной цепной реакции (ПЦР), позволяющей in vitro нарабатывать сотн и миллионов копий от определенных участков молекулы ДНК. На основе ПЦ Р в 1990-х гг. были проведен молекулярно-генетический анализ останков «Айсмена» — тирольского че- ловека, извлеченного из ледника [2], расшифрована нуклеотид ная последовательность фрагмента митохондриальной ДНК (мтДНК) неандертал ьца [3], выполнен ряд исследований, связанных с анализом останков представите лей древнего населения Японии [4], Нового Света [5], Европы [6] и России [7].
Привсехсовременныхдостиженияхметодологииисследова нияструктурыДНК работа с древней ДНК всегда осложнена многими не предвиде нными для ее анализа обстоятельствами.
Непредвиденные трудности могут быть обусловлены разной степенью сохранности молекул ДНК в останках, наличием в биологических пр епаратах органиче- ских и неорганических примесей, ингибирующих матричный с интез ДНК и полимеразу, в частности, опасностью загрязнения анализируемых о бразцов современной ДНКиеепродуктамиПЦР.Допроведениянастоящегоисследо ванияфрагментыдревних образцов ДНК выделяли, как правило, относительно небольшого размера, по сравнению с последовательностями нуклеотидов, извлекаемых из современного материала для анализа структуры ДНК. Это обстоятельство с ущественно ограничи- вало получение генетической информации в необходимом об ъеме и снижало возможность определения расовых и этнических особенностей структуры ДНК у индивидов прошлых исторических эпох.
Следовало иметь в виду также, что для воссоздания структу ры генофонда пазырыкцев (IV—III вв. до н. э.) и определения родственных связей этих древних кочевников с современными этническими группами Евразии необх одимо было проанализировать значительное число древних образцов ДНК от разн ых индивидов, и поэтому методические подходы, используемые в эксперименте, по мере возможности должны были быть унифицированы. Кроме того, по истечении врем ени стало ясно, что для проведения адекватного филогеографического анализа вряд ли можно ограни- читьсясравнительнымисследованиемпоследовательносте йнуклеотидовтолькоконтрольногорайонамтДНКиможетвозникнутьнеобходимость анализаструктурыДНК
ГЛАВА. 3. ПАЛЕОГЕНЕТИЧЕСКИЕ ИССЛЕДОВАНИЯ НОСИТЕЛЕЙ КУЛЬТУ РЫ РАННЕГО ЖЕЛЕЗНОГО ВЕКА |
121 |

ИНТЕГРАЦИОННЫЕ ПРОЕКТЫ
некоторых участков ядерного генома (X- и Y-хромосом, аутосом ных генетических маркеров). Поэтому следовало разрабатывать такие методы, которые были бы пригодными для выделения достаточно существенных количест в ДНК и позволяли бы перерабатывать большой объем исходного костного матери ала. Учитывая тот факт, что территорию, занимаемую пазырыкцами (Горный Алтай), на протяжении длительногопериодавремениокружалиареалыразнородныхне тольковэтническом,но ивантропологическомотношениипопуляций,которые,ктом уже,современемзамещались другими, требовалось подвергнуть молекулярно-ген етическому анализу также и ДНК представителей максимально возможного числа сов ременных этнических групп для выявления их родственных связей с пазырыкцами.
Кначалупроведениянастоящихисследованийсведенияост руктурегенофондов ядерной и мтДНК народов севера Евразии были либо очень фр агментарны, либо вообще отсутствовали. Поэтому параллельно с основными исследованиями требовалось проведение сбора биологического материала от р азных этнических групп севера Евразии для создания банка ДНК и осуществления мас сированного секвенированияэтойДНК.
Первые четыре образца ДНК пазырыкцев, подвергнутые молек улярно-генети- ческому анализу, были получены из хорошо сохранившихся мя гких тканей (мышцы, мозг), поскольку погребенные находились в ледяных природ ных линзах [8].
ДНК погребенной в кургане Ак-Алаха-5 женщины [9] (образец 1) выд еляли измышечнойткани,взятойизобластибедраспомощьюстери льныхножницискальпеля. Внешне ткань была коричневого цвета, полностью обез вожена, сохраняла волокнистуюструктуру.Вкачествеисходногоматериаладляв ыделенияДНКпогребенных из курганов ¹ 1 и 3 памятника Верх-Кальджин-II [10] (образцы 2 и 3) использовали светло-коричневую массу, извлеченную с помощью стери льных инструментов из черепной коробки через затылочное отверстие. Эту орган ическую массу, находившуюся в желеобразном состоянии, идентифицировали как сме сь жировых и мозговых клеток. В общей сложности из полости каждого черепа бы ло отобрано по 50— 100 г материала. Его хранение осуществлялось при температуре –45 °С.
Выделение ДНК и удаление ингибирующих ПЦР-примесей осуще ствляли с помощьюмодифицированнойметодики[11],основаннойнаселекти внойсорбциифрагментов ДНК на частицах SiO2. Для удаления остатков двуокиси кремния, оказывающих негативный эффект на ферментативный синтез ДНК, получ енный препарат дополнительно обрабатывали системой Wizard DNA Clean Up (Promega).
Для амплификации контрольного района мтДНК использовал и праймеры Thr (15898-5´-TCAAAGCTTACACCAGTCTTGTAAACC-3´-15926) è TDKD (16518-5´- CCTGAAGTAGGAACCAGATG-3´-16498). 50 мкл амплификационной смеси содержали 75 мM Tris–HCl pH 9,0, 20 мM (NH4)2SO4, 0,01 % Tween 20, 1,5 ìM MgCl2, 0,2 мMdNTPs,1 ед.Taqpol,1,0—1,5 мкгдревнейДНК,по25 пмолькаждогопраймера.Сорокцикловамплификациипроводилисиспользованиемпр иборафирмы«БИС» (пос. Кольцово,г. Новосибирск)вследующемрежиме:94 °С — 3 мин,1цикл,94 °С — 0,8 мин, 54 °С — 1,2 мин, 72 °С — 1,5 мин. Продукты амплификации оценивали при помощи электрофореза в 4%-м полиакриламидном геле.
Двухцепочечный продукт ПЦР для образцов ¹ 1 и 2 клонировали в векторе pCRTM II (Invitrogen, original TA cloning kit). Полученную плазмидную ДНК секвенировали на автоматическом секвенаторе, а также обычным с пособом с исполь-
122 НАСЕЛЕНИЕ ГОРНОГО АЛТАЯ В ЭПОХУ РАННЕГО ЖЕЛЕЗНОГО ВЕКА КА К ЭТНОКУЛЬТУРНЫЙ ФЕНОМЕН

зованиемкоммерческихнаборов.Последовательностьнуклеотидовконтрольногорайона мтДНК образца 3 определялась прямым секвенированием п родукта асимметричнойПЦР.
На всех стадиях выделения древней ДНК контролировали наличие примесей нуклеиновых кислот иной природы (например, продуктов ПЦР ). Для каждого индивида результат воспроизводился дважды на препаратах ДНК , выделенных из разных фрагментов ткани. С целью дополнительной верификации пол ученных данных процедура выделения ДНК и амплификации была полностью воспр оизведена в лаборатории молекулярной онкологии Института Пастера (г. Лилль, Франция), в которой работы с ДНК жителей Северной и Центральной Азии ранее не выполнялись.
Первичнуюстатистическуюобработкунуклеотидныхпослед овательностейиих группирование по этнической принадлежности для последу ющей обработки осуществляли средствами пакета прикладных программ SPSS 8.0. Попарные внутри- и межпопуляционные нуклеотидные различия рассчитывали с помощью программы PAIRPOP (В. Н. Бабенко, ИЦиГ СО РАН) и ARLEQUIN. Генетические дистанции между парами популяций рассчитывали на основе средних вн утри- и межпопуляционных попарных различий по формуле, предложенной Ф. Калаф елл с соавторами [12]. Деревья генетических расстояний строили с помощью программ NEIGHBOR, DRAWTREE(PHYLIP 3.5).
Доступностьхорошосохранившихсямягкихтканейдревних останковпазырыкцев, несомненно, способствовала успешному развитию наших работ на начальных этапах исследования с древней ДНК. Однако археологически е находки такого типа достаточноуникальныиориентироватьсянанихвширокома сштабныхпопуляционных исследованиях нельзя. Необходима была методика, адапт ированная для выделения ДНК из костной ткани, представленной обычно в довольн о больших количе- ствахприархеологическихраскопках.Несомненныетрудно стивызывалоитообстоятельство, что извлеченная из костной ткани древних остан ков мтДНК является в большей своей части фрагментированной, вследствие чего , как правило, воспроизводимо амплифицируются лишь короткие фрагменты ДНК. Поэт ому, чтобы провести секвенирование ДНК контрольного участка (D-петля) мито хондриального генома древних индивидов, по размеру сопоставимого с анализир уемым в случае мтДНК из современных популяций человека, необходимо отдельно а мплифицировать и секвенировать пять—восемь перекрывающихся фрагментов посл едовательностей нуклеотидов. В результате резко увеличивается объем работ и, как следствие, усиливается риск загрязнения чужеродной ДНК.
Âсвязи с описанными выше сложностями примеры массового а нализа древних образцов с определением первичной структуры участка, соп оставимого по размеру
ñанализируемым для современных образцов ДНК, в мировой л итературе крайне редки и являются, скорее, исключением.
Âтожевремявслучаеиспользованиятакогомолекулярно-г енетическогомаркера, как мтДНК, очевидно, что достаточно обоснованные и знач имые эволюционногенетические заключения о древних популяциях могут быть получены только при массовом скрининге образцов, сопоставимом с таковым для с овременных этнических групп. Ни одна из применяемых на практике методик выделения древней ДНК негарантируетдолжногокачестваееполучениявкаждомко нкретномслучае.Основные причины такой непредсказуемости обусловлены разной степенью деградации
ИНТЕГРАЦИОННЫЕ ПРОЕКТЫ
ГЛАВА. 3. ПАЛЕОГЕНЕТИЧЕСКИЕ ИССЛЕДОВАНИЯ НОСИТЕЛЕЙ КУЛЬТУ РЫ РАННЕГО ЖЕЛЕЗНОГО ВЕКА |
123 |

ИНТЕГРАЦИОННЫЕ ПРОЕКТЫ
ДНК в образцах и различием состава сопутствующих ингибит оров ПЦР, которые определяются, главным образом, условиями хранения останк ов.
В зависимости от степени сохранности древнего материала , содержание высокомолекулярной ДНК в полученных препаратах может варьир овать в широких пределах до полного их отсутствия. Первичная структура ДНК м ожет быть изменена локально или кластерно: возможны депуринизация и депиримидинизация оснований, их модификация, сшивки между нуклеотидами. Наибольши е помехи привносят различные по механизму действия ингибиторы ПЦР, присутст вующие в виде примесей в образцах ДНК. Точная природа ингибиторов в настояще е время не известна и, соответственно, не существует стандартных высокоэффективных методов их удаления. Учитывая все перечисленные обстоятельства, совершен но очевидно, что разработка и усовершенствование технологий выделения древне й ДНК является ключе- вым звеном развития палеогенетических исследований и не обходимым условием выхода на уровень массового анализа.
ÌЕТОДЫ ИЗВЛЕЧЕНИЯ ÄÍÊ ИЗ ДРЕВНИХ ОСТАНКОВ
Метод 1. Основан на экстракции из раствора тотальной ДНК фрагмент ов с определенной нуклеотидной последовательностью путем их и збирательного связывания с иммобилизованными олигонуклеотидами. В исследован иях использовали биотинилированные олигонуклеотидные праймеры, иммобилизованные на стрептовидине, закрепленном на поверхности полимерной оболочки, по крывающей парамагнитныечастицы.Вэкспериментахиспользовалипрепара тыDynabeadsDNADirect фирмы «Dynal». Применение иммобилизации на парамагнитных час тицах позволяет существенно упростить и ускорить все процессы очистки и разделения компонентов растворов. Основные этапы методики включают: 1) получение раствора ДНК; 2) денатурациютотальнойДНК;3) добавлениекрастворуДНКбиотинилированного олигонуклеотидногопраймераиегоотжигсфрагментамиДН К,содержащимикомплементарные праймеру последовательности; 4) добавление к раствору стрептовидина, иммобилизованного на парамагнитных частицах, получен ие комплекса между биотином, расположенным на 5´-конце праймера, и стрептовидином; 5) формированиекомплексамеждуодноцепочечнойДНКвраствореиоли гонуклеотиднымпраймером на парамагнитных частицах; 6) осаждение парамагнитных частиц со связанной ДНК на стенки пробирки в магнитном поле; 7) диссоциация двухцепочечной ДНК, закрепленной на парамагнитных частицах нагреванием или добавлением щелочи, и осаждение парамагнитных частиц с одноцепочечным о лигонуклеотидом в магнитном поле. Далее ДНК, находящаяся в растворе, исполь зуется в качестве исходной матрицы в полимеразной цепной реакции. Однако выде ленная и очищенная целевая ДНК часто бывает подвержена чрезвычайно быстрой деградации в растворе. Для повышения устойчивости препарата ДНК эксперимент ально подбираются специфические добавки, существенно повышающие сроки ее с охранности.
Предлагаемый метод имеет ряд очевидных преимуществ, по ср авнению с существующими методами выделения древней ДНК. Среди них:
1. ВозможностьизвлечениядонеобходимыхконцентрацийтребующегосяфрагментаДНКблагодаряотсутствиюограниченийвколичестве перерабатываемойткани.
124 НАСЕЛЕНИЕ ГОРНОГО АЛТАЯ В ЭПОХУ РАННЕГО ЖЕЛЕЗНОГО ВЕКА КА К ЭТНОКУЛЬТУРНЫЙ ФЕНОМЕН

2. ВозможностьселективноговыделениятолькополноразмерногофрагментаДНК |
ПРОЕКТЫ |
|
путем подбора специфических праймеров к каждой из цепей в участках, фланкирую- |
||
|
||
щих локус с двух сторон. |
|
|
3. Освобождение раствора от фрагментов ДНК, не представляющих интерес |
ИНТЕГРАЦИОННЫЕ |
|
в конкретном исследовании и составляющих основную часть препарата ДНК, ис- |
||
|
||
пользующегося для ПЦР при традиционных подходах. В настоя щее время экспери- |
|
|
ментально установлено, что при амплификации низкокопийн ых матриц неспецифи- |
|
|
ческое связывание праймеров с различными примесными фра гментами ДНК в ра- |
|
|
створе является основным фактором, резко снижающим эффек тивность амплифика- |
|
|
ции целевого фрагмента. В связи с этим возможность извлеч ения и концентрирова- |
|
|
ния из гетерогенной смеси геномной ДНК лишь тех молекул, к оторые требуются для |
|
|
анализа,позволяеткардинальнорешитьпроблемуэффектив ногопроведенияПЦР. |
|
|
4. СелективноеудалениецелевойДНКизпервичногорастворапозволяетвдаль- |
|
|
нейшем эффективно избавляться от присутствующих в нем ко мпонентов, ингибиру- |
|
|
ющих полимеразную цепную реакцию в случае экстракции ДНК из археологических |
|
|
образцов. |
|
|
Таким образом, реализация нового метода выделения ДНК соз дает предпосыл- |
|
|
ки для формирования расширенной базы образцов древней ДН К из всех доступных |
|
|
биологическихматериалов.Средимногихфакторов,осложня ющихработусдревни- |
|
|
ми образцами ДНК, наибольшей непредсказуемостью отличаю тся так называемые |
|
|
контаминирующиепродуктыПЦР.Дляихустранениякомпонен тыреакционныхсме- |
|
|
сей, используемые для проведения полимеразной цепной реа кции, подвергают обра- |
|
|
ботке ферментами рестрикции. В большой серии эксперимент ов показано, что по- |
|
|
добная обработка надежно очищает компоненты реакционно й смеси как от нежела- |
|
|
тельных примесей чужеродной ДНК, так и от примесных ПЦР-пр одуктов. |
|
|
Выделение тотальной ДНК из кости с использованием гуанид интиоционата. |
|
|
Наначальномэтапекостныепрепаратысбольшимсодержани емгубчатойкостираз- |
|
|
малывали в мелкодисперсный порошок. Целый препарат кости предварительно об- |
|
|
жигали в пламени спиртовки снаружи и длительно облучали у льтрафиолетом. Далее |
|
|
тотальную ДНК извлекали из кости с помощью одной из следу ющих методик. |
|
|
На1 гкостибрали4 млэкстракционногобуфера(4 Мгуанидинтиоционат;0,1 М |
|
|
NaCl; 0,014 Ì b-меркаптоэтанол; 0,025 М ЭДТА; 0,5%-й SDS) и инкубировали 12 ч |
|
|
при60 °Сипостоянномперемешивании.Далеепутемцентрифугирования(12 000 об., |
|
|
5 мин)отбиралисупернатантиосаждалиеготакимжеобъемом ПЭГ(20%-йПЭГ6000 |
|
|
в 2,5 М NaCl): инкубировали 1 ч при 37 °С с последующим центрифугированием и |
|
|
двухкратной отмывкой осадка 80%-м этанолом. Растворяли в 60 мкл H2O. |
|
|
Выделение тотальной ДНК из кости с использованием коллаг еназы и протеина- |
|
|
зы. На 1 г кости брали 10 мл лизирующего буфера (100 мМ трис-HCl (pH 8); 2 мМ |
|
|
ЭДТА;10 мМNaCl),по5 мгсухойколлагеназыисухойпротеиназыиинкубировалив |
|
|
течениесутокпри37 °С.Далеепроводилидвухкратнуюочисткуполучившегосясупер- |
|
|
натантафенолом,фенол/хлороформомихлороформом.ДНКизс упернатантаосажда- |
|
|
лиизопропаноломспоследующейпромывкойосадка80%-мэтано лом. |
|
|
Выделение митохондриальной ДНК из пула тотальной ДНК с ис пользованием |
|
|
магнитных частиц. Проводится в два этапа. |
|
|
1. Отжиг митохондриальной ДНК с биотинилированным праймером (5´-á- |
|
|
ACTCCÑÑACCATTAGCACCCAAA-3´), взятого в концентрации 50 нМ, проводили |
|
ГЛАВА. 3. ПАЛЕОГЕНЕТИЧЕСКИЕ ИССЛЕДОВАНИЯ НОСИТЕЛЕЙ КУЛЬТУ РЫ РАННЕГО ЖЕЛЕЗНОГО ВЕКА |
125 |

ИНТЕГРАЦИОННЫЕ ПРОЕКТЫ
в буфере 5 мМ трис-HCl (pH 7,5), содержащем 50 мM NaCl. Процедура включала денатурацию ДНК в течение 10 мин при 95 °С и отжиг с праймером в течение 30 мин при 53 °С.
2.Иммобилизация биотинилированного праймера на магнитные частицы.
Êсмеси добавили 5 мкл магнитных частиц, промытых пять раз в 2 ´ B&W буфере (10 мМтрис-HCl(pH 7,5);1 мМЭДТА;2 МNaCl),и13 мкл5 МNaCl.Гибридизацию проводилиприкомнатнойтемпературеипостоянномпомешиваниивтечение2 ч.Затемприпомощимагнитногопланшетамагнитныечастицысим мобилизованнымина нихпраймерамидваждыпромывалибуфером(10 мМтрис-HCl(pH 7,5);1 мМЭДТА).
ЭлюциюодноцепочечнойДНКспраймеровпроводилипри70 °Свтечение10 мин. Метод 2.Основан на очистке тотальной ДНК с помощью электрофореза в поли-
акриламидном геле с последующей электроэлюцией ее на ДЕА Е-целлюлозу. ДНК извлекали из кости с помощью одной из методик, описанных в ыше.
ДНК,выделеннаясиспользованиемгуанидинтиоционата,был аподвергнутаэлектрофорезу в 6%-м полиакриламидном геле (ПААГ) с последующим окрашиванием этидиумомбромида(EtBr).Былавырезанаполоскагеля,содержа щаяфрагментыДНК свыше 400 нп. Данная полоска была помещена в аппарат для электроэлюции.
Перенос производили при токе 9 мА в течение часа в 1 ´ ТBE (трис-боратном) буфере. Эффективность переноса проверяли поглощением в д линноволновом УФО. Затем отмывали ДЕАЕ-мембрану в низкосолевом буфере (50 мM трис-HCl (pH 8,0); 10 мMEDTA;0,15 MNaCl)иинкубировалиеев700 млвысокосолевогобуфера(50 мM трис-HCl (pH 8,0); 10 мM EDTA; 1 M NaCl) при 65 °С в течение 25 мин. Элюат центрифугировалиифильтроваличерезмикроколонкуWizard.Далее растворинкубировали в течение 5 мин при 95 °С с 200 мкл суспензии Chelex и снова фильтровали через микроколонку Wizard. Полученный супернатант отмывали бутанолом. ДНК осаждали изопропанолом в течение часа при –20 °С с последующей отмывкой осадка 80%-м этанолом.
ÑЕКВЕНИРОВАНИЕ ФРАГМЕНТА КОНТРОЛЬНОГО РАЙОНА МИТОХОНДРИАЛЬНОЙ ÄÍÊ ДРЕВНИХ ОБРАЗЦОВ
Дляпроведениямолекулярно-генетическогоанализадревн ихобразцовДНКнеобходимоопределениенуклеотидныхпоследовательностей техрайонов,которыенаиболее информативны в антропологическом отношении. В наст оящее время установление порядка чередования нуклеотидов в последовательн остях ДНК можно осуществлять посредством прямого секвенирования ПЦР-продукт ов, избирательно синтезированных с таких районов.
Прямое секвенирование имеет ряд существенных преимущес тв, по сравнению с секвенированием клонированных продуктов ПЦР, в частнос ти, значительно меньшую вероятность фиксации ошибок в структуре нуклеотидно й последовательности, привнесенных термофильной ДНК-полимеразой в ходе синтез а ДНК. Поскольку ошибочные замены в ПЦР-продуктах распределены стохастич ески в разных копиях продукта, то они не регистрируются при автоматическом «пр очтении» текста нукле- отидныхпоследовательностейДНК.ОднакоколичествоПЦР-п родукта,амплифици-
126 НАСЕЛЕНИЕ ГОРНОГО АЛТАЯ В ЭПОХУ РАННЕГО ЖЕЛЕЗНОГО ВЕКА КА К ЭТНОКУЛЬТУРНЫЙ ФЕНОМЕН
рованного с матриц древней ДНК, оказывается, как правило, н едостаточным для прямогосеквенирования.Поэтомупродуктыпервичногоамп лификатаповторноподвергают амплификации перед анализом структуры ДНК.
ÄАННЫЕ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКОГО АНАЛИЗА ПОСЛЕДОВАТЕЛЬНОСТЕЙ НУКЛЕОТИДОВ КОНТРОЛЬНОГО РАЙОНА МИТОХОНДРИАЛЬНОЙ ÄÍÊ, ИЗВЛЕЧЕННОЙ ИЗ МЯГКИХ ТКАНЕЙ ОСТАНКОВ ПАЗЫРЫКЦЕВ
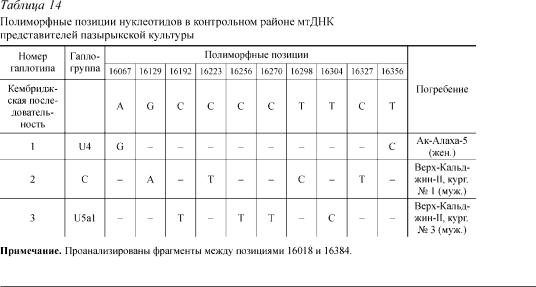
У всех извлеченных из мягких тканей образцов ДНК пазырыкц ев были амплифицированы и секвенированы фрагменты контрольного района размером 619 нп. В табл. 14 приведены позиции, по которым нуклеотидная последовательность контрольного района мтДНК каждого из трех индивидов отличает ся от используемой в мировой литературе в качестве стандарта Кембриджской п оследовательности. Все нуклеотидныезаменыявляютсятранзициями.Результатыпо дробногосравнениякаждогоизтрехпазырыкскихвариантовмтДНКсгаплотипамира зличныхсовременных этнических групп Евразии ранее были опубликованы [13]. Гапло тип 1 сходен с подавляющей частью европейских вариантов и существенно от личается от структуры большинства монголоидных. Это обстоятельство позволяет рассматривать его как вариант, более специфичный для европеоидного пула мтДНК. По своей структуре гаплотип 1 является вариантом гаплогруппы I (U4) (здесь и дале е первое обозначе- ниесоответствуетклассификациигаплотиповконтрольног орайонамтДНК[14],второе — классификации, основанной на последовательности контрольного района и дополнительном рестрикционном анализе, представленно й в митохондриальном генофонде европейцев и занимающей в нем доминирующее мес то). Родственные гаплотипу 1 варианты распространены также у алтайцев и финно-угров Западной Сибири.
ИНТЕГРАЦИОННЫЕ ПРОЕКТЫ
ГЛАВА. 3. ПАЛЕОГЕНЕТИЧЕСКИЕ ИССЛЕДОВАНИЯ НОСИТЕЛЕЙ КУЛЬТУ РЫ РАННЕГО ЖЕЛЕЗНОГО ВЕКА |
127 |

ИНТЕГРАЦИОННЫЕ ПРОЕКТЫ
128 НАСЕЛЕНИЕ ГОРНОГО АЛТАЯ В ЭПОХУ РАННЕГО ЖЕЛЕЗНОГО ВЕКА КА К ЭТНОКУЛЬТУРНЫЙ ФЕНОМЕН

Примечание.Вверхнейматрицеподиагоналивыделенызначениявнутрипопуляционныхпопарныхнуклеотидныхразличий.Источники:алтайцы[30]; кеты,селькупы [31]; коряки, эвены, якуты [32]; монголы [33]; финно-угры Западной Сибири [34]; эскимосы Азии, чукчи [35]; казахи, киргизы горные, киргизы равнинные, уйгуры [36]; китайцы, корейцы, айны [37]; русские [38]; карелы, финно-угры Поволжья, Северной Европы, саамы [39]; испанцы, баски, немцы [40]; турки, болгары [41]; Ближний Восток [42]; канарцы, индусы-мукри, индусы-хавик [43].
Выраженные особенности, специфичные для вариантов ряда современных популяций Северной Азии, обнаруженывслучаепоследовательностигаплотипа 2.Три из четырех замен, отличающих этот гаплотип от Кембриджского (16223: С ® Ò; 16298: Ò ® Ñ è 16327: Ñ ® Т), соответствуютзаменам,которые,вероятно,являютсяспецифическимидлявариантовгаплогруппыС,выделенной Д. Воласем и А. Торрони в популяции человека на основетотальногорестрикционногоанализамитохондриального генома [15]. Данная гаплогруппа широко распространена среди коренного населения Северной Азии (преимущественно эвенки, эвены, селькупы) и Америки и в значительно меньшей степени среди жителей Центральной Азии.
При сравнительном анализе структуры гаплотипа 3 выяснилось, что он относится к европейской гаплогруппе V (U5a1) и характеризуется относительно более высокой частотой распространения в современных европеоидных популяциях, по сравнению с другими обследованными выборками представителей современного населения Евразии [16].
Обнаружение гаплотипа 3 в небольшом числе проанализированныхдревнихобразцовДНКдаетоснования предполагать более высокую представленность гаплотипов гаплогруппы V в митохондриальном генофонде пазырыкцев, по сравнению с современными этническими группами как европеоидного, так и монголоидного происхождения.
ИзданныхрестрикционногоанализаДНКвсегомитохондриальногогеномаисеквенированиянуклеотидных последовательностейконтрольногорайона(D-петля)сле- дует, что для европеоидных популяций наиболее характерны основные гаплогруппы — HV, H, V, J, T, U, K, I, W, X [17], а для монголоидных — A, B, E, F, Y, М (C, D, G, Z). Гаплогруппа М является супергаплогруппой, которая делится на субкластеры С, D, G, Z и др. [18].
Наиболее представленные у народов Западной Евразии гаплогруппы H, I, J, T, U, V, W и X, составляющие более 80 % от всех типов мтДНК, сохранились в их генофондесверхнегопалеолита[19].Широкораспространенный кластер U считается среди них самым древним. Возрастего50 тыс.лет[20].Кластервключаетнесколькоподкластеров U1—U8, причем характер распространения каждого из них на континенте специфичен. Так, в Запад- нойЕвропевыявленытолькогаплогруппыU1—U5.Гап- логруппаU6обнаруженанаафриканскомконтиненте,U7
ИНТЕГРАЦИОННЫЕ ПРОЕКТЫ
ГЛАВА. 3. ПАЛЕОГЕНЕТИЧЕСКИЕ ИССЛЕДОВАНИЯ НОСИТЕЛЕЙ КУЛЬТУ РЫ РАННЕГО ЖЕЛЕЗНОГО ВЕКА |
129 |

ИНТЕГРАЦИОННЫЕ ПРОЕКТЫ
являетсятипичнойлиниеймтДНКвпопуляцияхИордании,Кувейта,Ирана,Саудовской Аравии [21].
Âисследованных нами образцах были выявлены две гаплогру ппы, относящиеся
êсубкластеру U, — это U4 и U5 (см. табл. 14).
Гаплогруппа U5 является одной из распространенных гаплогр упп мтДНК в Западной Европе, странах Средиземноморья и встречается так же у народов Ближнего Востока и Центральной Азии. Самая высокая частота данной гаплогруппы была зафиксирована у саамов (53 %) [22]. Также данная гаплогруппа была выявлена в популяциях коренных жителей Западной Сибири и Волго-Уральско го региона [23]. Выявленный нами мотив (16192-16256-16270-16304) ранее был зафиксирован в популя - циях русских, мари, осетинцев и финнов [24].
Гаплогруппа U4 наиболее характерна для северо-восточной ч асти Западной Европы[25]изафиксированатакжесвысокойчастотойвпопуляц ияхЗападнойСибири и Волго-Уральского региона [26].
Гаплогруппы C и Z, имеющие общее происхождение, широко предс тавлены
âпопуляцияхАзии,СевернойиВосточнойСибири.Ранеепров еденныеисследования показали, что частота гаплогруппы С достигает 50 % в популяции эвенков и юкагиров, с частотой около 30 % она встречается у народов, проживающих в северных областях Сибири, ее распространенность прогрессивно снижается до 10 % и менее у чукчей, эскимосов и ительменов на востоке, казахов и монголов на юге, селькупов и кетов на западе [27]. В странах Южной и Западной Европы гапло группа С либо отсутствует, либо ее частота составляет не более 1 %, что характерно и для финноугорских народов Волго-Уральского региона (0 у коми-зырян, до 3 % у удмуртов), а также балто-финских популяций (не превышает 2 %) [28].
Гаплогруппа Z характерна для тунгусо-маньчжурских популя ций северной частиСибири,монголов,тюркоязычныхнародовЦентральнойАзи и,Волго-Уральского региона, а также саамов [29].
НебольшаяпоразмерувыборкамтДНКпазырыкцевоказалась информативной
âпервом приближении для установления структуры их геноф онда, поскольку обнаруженные гаплотипы, принадлежащие к разным гаплогруппам , наиболее распространенывтакомнаборетольковнекоторыхпопуляцияхСредн ейиЦентральнойАзии, а также средиаборигенов Западной Сибири. Ставя целью дать интегральну ю оценку эволюционно-генетических связей имеющейся выборки пазы рыкских гаплотипов с митохондриальными генофондами современного населения Евразии, мы рассчитали средние попарные внутри- и межпопуляционные нуклеотид ные различия для пазырыкцевиописанныхвлитературесовременныхэтнически хгруппконтинента.Данные по средним попарным нуклеотидным различиям были испо льзованы для определения генетических дистанций между отдельными парами анализируемых популяций. В табл. 15 представлены соответствующие матрицы для пазырыкцев, мало- численных народностей различных регионов России, а также для многочисленных народов, населяющих наиболее близкие к ним территории Евр опы, Восточной, Центральной и Средней Азии (русские, китайцы, монголы и казахи ). Матрицы рассчи- тывали для фрагмента мтДНК между позициями 16090 и 16365, поскольку для него имелись данные во всех сравниваемых выборках.
Какследуетизтабл. 15, величинасреднихпопарныхвнутрипопуляционныхнуклеотидных различий в выборке пазырыкских гаплотипов бли зка к регистрируемой
130 НАСЕЛЕНИЕ ГОРНОГО АЛТАЯ В ЭПОХУ РАННЕГО ЖЕЛЕЗНОГО ВЕКА КА К ЭТНОКУЛЬТУРНЫЙ ФЕНОМЕН
