
- •Лекции по физике пласта. Лекция №1.
- •Предмет, задачи и специфики дисциплины «Физика пласта».
- •Методы исследования характеристик пласта:
- •Методы изучения пласта.
- •Лекция №2.
- •2. Типы взаимодействия пластов.
- •3. Пласт, как термодинамическая система
- •Виды гетерогенности.
- •Особенности твёрдой фазы.
- •Уровни неоднородности.
- •Лекция №3.
- •7. Гранулометрический анализ.
- •8. Глинистость пласта.
- •9. Окатанность.
- •10. Пористость нефтяного и газового пласта.
- •11. Типы коллекторов.
- •Лекция №4.
- •12. Количественные и качественные характеристики.
- •16. Условия совместной фильтрации.
- •17. Условия совместного движения трёх фаз.
- •Способы определения.
- •18. Обобщённый закон Дарси.
- •Лекция №6.
- •19. Структура внутрипорового пространства и её влияние на фильтрационные и ёмкостные свойства.
- •20. Модели проницаемости.
- •21. Формулы, связывающие коэффициент проницаемости и капиллярное давление.
- •Лекция №7.
- •22. Физика деформационных процессов в нефтегазовых пластах.
- •23. Объёмный коэффициент упругости пласта:
- •24. Эффективные напряжения.
- •25. Деформационная форма.
- •26. Реологические модели.
- •27. Пластическая деформация.
- •Лекция №8.
- •28. Прочность и разрушение породы.
- •29. Теория критических трещин Гриффитса.
- •30. Реологические свойства нефтегазовых пластов.
- •31. Поведение пласта при циклических нагрузках.
- •32. Волновые свойства нефтегазовых пластов.
- •Волны Ленда.
- •Лекция №10.
- •33. Тепловые процессы в нефтегазовых пластах.
- •34. Механизмы теплопередачи.
- •Кондуктивный перенос тепла;
- •Конвективный перенос;
- •Теплообмен, связанный с излучением.
- •Количественное описание переноса тепла.
- •QgrаdТ.
- •Коэффициенты, характеризующие тепловые свойства пласта.
- •Теплоёмкость:
- •Теплопроводность.
- •Температуропроводность.
- •Теплопередача.
- •Лекция №11.
- •35. Физическое состояние нефти и газа при различных условиях в залежи.
- •36. Состав и классификация природных нефтей и газов. Нефти.
- •37. Парциальные давления и объёмы. Основные законы.
- •Закон Дальтона
- •Закон Амага
- •38. Жидкие смеси, их состав. Идеальные и реальные газы.
- •Лекция №12.
- •39. Плотность природного газа и стабильного конденсата.
- •40. Вязкость газов и углеводородных конденсатов.
- •Лекция №13.
- •41. Фазовое равновесие в углеводородных системах.
- •Ткр.Эксп. Ткр.Расч.
- •42. Растворимость газов в нефти.
- •43. Давление насыщения нефти газом.
- •44. Коэффициент сжимаемости нефти. Объёмный коэффициент.
- •Коэффициент усадки.
- •45. Плотность и вязкость пластовой нефти.
- •46. Структурно-механические свойства нефти. Аномальные жидкости.
- •Старение нефти.
- •Лекция 15. Упруго пластические жидкости.
- •Вязкопластическая жидкость.
- •Степенная жидкость.
- •Вязкоупругая жидкость.
- •Лекция №16.
- •2. Адсорбционная вода;
- •3. Плёночная вода;
- •4. Свободная вода;
- •Физические свойства пластовых вод.
- •Плотность.
- •Тепловое расширение воды.
- •Вязкость воды.
- •Выпадение неорганических осадков из пластовых вод.
- •Лекция №17. Влияние термодинамических условий на выпадение солей. (продолжение к лекции №16).
- •Поступление на забой скважины вод из разных горизонтов.
- •49. Явления на поверхности раздела фаз.
- •Поверхностные натяжения.
- •Параметр смачивания и краевой угол смачивания.
- •Работа адгезии.
- •Теплота смачиваемости.
- •Лекция №17_1 Влияние термодинамических условий на выпадение солей. (продолжение к лекции №16).
- •Поступление на забой скважины вод из разных горизонтов.
- •49. Явления на поверхности раздела фаз.
- •Поверхностные натяжения.
- •Параметр смачивания и краевой угол смачивания.
- •Работа адгезии.
- •Теплота смачиваемости.
- •Лекция №18.
- •Ггидрофобизации, или адсорбции, пород.
- •50. Физические основы вытеснения нефти и газа из пластов.
- •Лекция №19.
- •51. Виды остаточной нефти и механизмы их образования.
- •51.1. Виды остаточной нефти и механизмы их образования.
- •Лекция №20.
- •5) Остаточная нефть, образовавшаяся в результате неустойчивого процесса вытеснения.
- •Лекция №21.
- •52. Способы оценки остаточной нефти.
- •Геофизические методы.
- •Методы Увеличения Нефтеотдачи (мун).
- •53. Техногенное изменение пласта по технологиям.
- •54. Физические принципы повышения продуктивности скважин.
- •Лекция №22.
- •54.1 Физические методы повышения продуктивности скважин.
37. Парциальные давления и объёмы. Основные законы.
Парциальное давление было введено для идеального газа.
Смесь идеальных газов характеризуется свойством аддитивности и свойством парциальности объёмов идеальных газов. Каждый газ в смеси ведёт себя так, будто он один.
Парциальное давление компонента – давление, которое оказывает данный компонент при удалении из объёма других компонентов.
Парциальный объём – объём, который занимал бы данный компонент при удалении из объёма остальных компонентов при постоянном давлении и постоянной температуре.
Существуют важные, строгие, всегда выполняющиеся законы, которые предопределили свойства реальных газов через свойства идеальных газов. Это:
-
Закон Дальтона
Этот закон выражает свойства аддитивности парциального давления.
рсм=рi
рi/рсм=ni/=уi
рi=уiрсм,
где ni – число молей i-ого компонента; - число молей; уi – молярная концентрация.
-
Закон Амага
Этот закон показывает свойство аддитивности парциального объёма.
vсм=vi
vi/vсм=ni/N=yi
vi=yivcм
Используются в расчётах газовых месторождений.
38. Жидкие смеси, их состав. Идеальные и реальные газы.
=100/(g1/1+…+gi/i)=100Мсм/(х1М1/1+…+хiМi/i),
где g – массовая доля компонентов жидкой смеси;
х – молярные доли;
- плотности компонентов и смеси;
М – молекулярная масса.
-
Объём паров после испарения:
v0=G/0=22,4G/М,
где М – молекулярная масса; 0 – плотность паров при нормальном давлении и температуре; G – масса испаряющегося газа;
Если мы проводим расчёт для смеси, то вместо М берём Мсм.
-
Закон состояния идеального газа Менделеева-Клапейрона:
РV=GRТ (справедлив для идеального газа).
Идеальные газы – газы, силами взаимодействия в которых можно пренебречь.
(Е/V)Т=0, где Е – внутренняя энергия парообразования.
Свойство идеальных газов заключается в том, что: РV/(GRТ)=1=z.
Новый введённый нами коэффициент z, который для идеальных газов равен 1, а для реальных газов отличен от неё, называется коэффициентом сверхсжимаемости.
z – коэффициент, с помощью которого свойства идеальных газов прилагаются к реальным. Он характеризует степень отклонения идеального газа от реального.
Были проведены различные попытки усовершенствования описания:
1) Уравнение Ван-дер-Ваальса:
(Р+а/v2)(v-в)=RТ,
где v – удельный объём; в – поправка на объём молекул; а/v2=соnst – константа сцепления молекул.
Величина а/v2 выражает внутреннее давление, которое является как бы равнодействующей силой притяжения всех молекул в объёме v.
При давлениях до 100 МПа, и температурах Т=150С необходимо определить наиболее точное описание зависимостей. В рассмотрении этого вопроса наука пошла по двум направлениям:
-
введение коэффициента сверхсжимаемости z;
-
добавление в уравнение состояния дополнительных констант.
2) Любую экспериментальную зависимость можно описать с помощью полинома, поэтому был избран путь увеличения количества констант. Наиболее распространёнными оказались уравнения с пятью константами Битти-Бриджмена и восьмью константами Бенедикта-Вебба-Рубина. Все постоянные величины определяются методом наименьших квадратов.
Но есть ли физический смысл в этих константах?
Рассмотрим два подхода:
I. Введение z в уравнение состояния. На основе экспериментов выяснилось: если у нас приведённые параметры Рпр, Тпр одинаковы и находятся в соответствующих состояниях, то при этом такие термодинамические свойства, как коэффициент сверхсжимаемости, одинаковы для различных газов. Т.е. z=f(Рпр, Тпр).
Приведённые параметры идеальных компонентов – безразмерные величины, показывающие, во сколько раз действительные параметры состояния газов больше критических. Под параметрами понимаются: Рабс, Т, V и z.
Тпр=Т/Ткр; Рпр=Р/Ркр; zпр=z/zкр.
Р еальные
газы – смесь
углеводородных и не углеводородных
компонентов. Молекулы аргона, ксенона,
криптона и метана имеют сферическую
конфигурацию. Молекулы таких газов,
как пропан и бутан, - несферическую,
поэтому для учёта формы молекул был
введён параметр – ацентрический
фактор ().
Он показывает, что если молекула
сферическая, то силы, которые на неё
действуют – сферические, что указывает
на симметрию сил. Если же молекулы не
сферические, то возникает асимметрия
действующих сил.
еальные
газы – смесь
углеводородных и не углеводородных
компонентов. Молекулы аргона, ксенона,
криптона и метана имеют сферическую
конфигурацию. Молекулы таких газов,
как пропан и бутан, - несферическую,
поэтому для учёта формы молекул был
введён параметр – ацентрический
фактор ().
Он показывает, что если молекула
сферическая, то силы, которые на неё
действуют – сферические, что указывает
на симметрию сил. Если же молекулы не
сферические, то возникает асимметрия
действующих сил.
z=z(Рпр, Тпр, )
zсм=z0(Рпр, Тпр)+z1(Рпр, Тпр)см,
где z0 – коэффициент сверхсжимаемости простого газа. Для простого газа молекулы сферические и =0.
z1 – поправка к коэффициенту сверхсжимаемости непростого газа, который зависит от Рпр, Тпр и 0.
см – ацентрический фактор всей смеси, характеризуемой определёнными концентрациями:
см=уii
Отсюда можно видеть, что ацентрический фактор смеси зависит от ацентричного фактора каждого компонента.
уi – молярная концентрация компонента.
Приведённые параметры рассчитываются на основании критических параметров, отсюда рассмотрим вопрос определения критических параметров.
Ркр=уiРкрi; Ткр=уiТкрi; zкр=уizкрi
На практике для уменьшения числа компонентов природного газа определяются не полностью, а до бутана или гепсана, а остальные объединяют в единый псевдокомпонент С5+, С7+. Псевдокомпонент, его параметры при известном групповом составе вычисляются по средней молекулярной массе.
Зависимости приведённых параметров выглядят следующим образом:
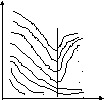 z
z
Тпр
Рпр
Рассмотрим вопрос влияния неуглеводородных газов. Учёт содержания может быть проведён так:
z=уаzа(1-уа)zу,
где уа – молярная доля азота (как неуглеводородного газа);
zа – коэффициент сверхсжимаемости азота;
zу – коэффициент сверхсжимаемости углеводородной составляющей.
Каждый неуглеводородный газ имеет свой z.
II. (Второй подход рассмотрим в следующих лекциях).
