
- •1.Динамическая биохимия. Характеристика
- •2. Распад углеводов в желудочно-кишечном тракте.
- •3.Гликолиз. Регуляция гликолиза. Гликогенолиз.
- •4.Спиртовое брожение. Глюконеогенез.
- •5. Окислительное декарбоксилирование пирувата.
- •6.Цикл лимонной кислоты. Регуляция цикла.
- •7.Дыхательная цепь: организация компонентов в
- •2 Бензохиноновым соединением, носящим названии
- •3 От СoQ на кислород представлен группой различн
- •4 В транспорте электронов принимают участие белки
- •8.Дыхательная цепь: редокс-потенциалы дыхательных
- •9.Окислительное фосфорилирование в дыхательной
- •10.Строение атр-синтазного комплекса.
- •11.Челночные механизмы транспорта цито
- •1. Глицеролфосфатный челночный механизм
- •12. Транспорт атф и через мембраны митохондрий
- •13.Свободное окисление и его функции
- •14.Расщепление липидов в желудочно-кишечном
- •15.Расщепление тканевых липидов.
- •16. Транспорт жирных кислот в митохондрии.
- •18.Метаболизм кетоновых тел.
- •19.Два пути биосинтеза триацилглицеролов.
- •20.Биосинтез холестерина. Роль гидроксиметилглутарилСоА
- •21.Расщепление белков в жкт..
- •22. Характеристика ферментов вне- и внутриклеточного
- •23. Транспорт аминокислот через мембраны.
- •24. Дезаминирование аминокислот, его типы.
- •25. Окислительное дезаминирование глутамата.
- •26.Декарбоксилирование аминокислот. Обезвреживание
- •27. Окислительное дезаминирование аминокислот оксидазами l- и d-аминокислот.
- •28. Переаминирование аминокислот.
- •29. Метаболизм аммиака: пути образования и детоксикации.
- •30.Орнитиновый цикл Кребса.
- •31. Расщепление нуклеиновых кислот в желудочно-
- •32. Катаболизм пуриновых нуклеотидов.
- •33. Катаболизм пиримидиновых нуклеотидов
22. Характеристика ферментов вне- и внутриклеточного
протеолиза.
Протеолиз, процесс гидролиза пептидных связей, катализируемый
протеолитическими ферментами. Протеолитические ферменты, уч
аствующие в переваривании белков и пептидов пищи, синтезирую
тся и выделяются в полость ЖКТ в виде проферментов или зимоге
нов. Выделяют: эндопептидазы (асщепляют пептидную связь внут
ри пептидной цепи. Они «узнают» и связывают короткие пептидны
е последовательности субстратов и относительно специфично гидр
олизуют связи между определенными аминокислотными оста
тками.) пепсин трипсин химотрипсин и экзопептидазы (классифи
цируются по механизму реакции) ферменты, гидролизующие белк
и, отщепляя аминокислоты от конца пептида: карбоксипептидазы
— от C-конца, аминопептидазы — от N-конца, дипептидазы расщеп
ляют дипептиды.
23. Транспорт аминокислот через мембраны.
γ-глутамильный цикл.
Различная скорость проникновения аминокислот через мембраны
клеток, установленная при помощи метода меченых атомов, свиде
тельствует о существовании в организме активной транспортной сис
темы, обеспечивающей перенос аминокислот как через внешнюю п
лазматическую мембрану, так и через систему внутриклеточных ме
мбран Предполагают, что главную роль в этом процессе играет мем
бранно-связанный гликопротеин – фермент γ-глутамилтрансфераза,
которая катализирует перенос γ-глутамильной группы от глутатиона
или другого γ-глутамильного пептида на транспортируемую аминок
ислоту. Комплекс γ-глутамил–аминокислота после переноса через би
омембрану распадается внутри клетки (или внутри субклеточного об
разования) под действием γ-глутамилциклотрансферазы на свободную
аминокислоту и 5-оксопролин (пироглутаминовая кислота), образова
ние которого почти целиком сдви-гает реакцию расщепления компле
кса вправо. Благодаря возможности ресинтеза глутатиона, требующего
затраты энергии АТФ, цикл может повторяться многократно, транспорт
ируя значительные количества аминокислот
.

24. Дезаминирование аминокислот, его типы.
это процесс отщепления NH2-группы с образованием
аммиака и различных кислот. Возможны 4 варианта дезаминирования.
Восстановительное
+2H
R-СНNH2-СООН → R-CH2-COOH + NH3
Гидролитическое
+H2O
R-CHNH2-COOH → R-CНОН-COOH + NH3
Внутримолекулярное
R-CH2-CHNH2-COOH → R-CH=CH-COOH + NH3
Окислительное
½ O2
R-CHNH2-COOH → R-CO-COOH + NH3
25. Окислительное дезаминирование глутамата.
Характеристика глутаматдегидрогеназы.
осуществляется в две стадии: сначала АК превращается
в иминокислоту при участии специфической дегидрогеназ
ы с NAD+ или NADP+ в качестве акцептора водорода. З
атем иминокислота спонтанно гидролизуется на кетокис
лоту и аммиак.
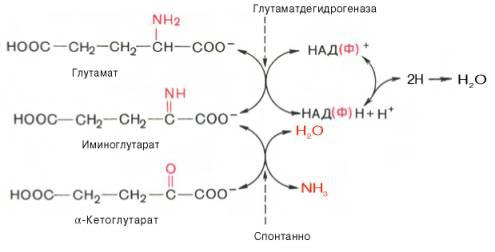
глутаматдегидрогеназа (ГлДГ), реакция является обратимой и
из α-кетоглутарата и NH3 в организме может образоваться глутами
новая кислота. L-ГлДГ – фермент, широко распространенный в тканях
млекопитающих, обладающий высокой каталитической активностью.
Является митохондрипльным ферментом, локализованным в матри
ксе. Является регуляторным ферментом: АТР, GTP, NADH – отрицат
ельные аллостерические эффекторы; ADP, GDP – положительные.
На активность L-ГлДГ оказывают влияние некоторые гормоны.
