
- •Сера и ее неорганические соединения
- •1.1.Сера
- •1.2.Полисульфидные анионы
- •1.3. Гидриды серы (сульфаны)
- •1.4. Галогениды серы
- •2. Органические соединения серы
- •2.1. Тиоспирты (меркаптаны, тиолы)
- •2.1.1. Способы синтеза тиолов
- •2.1.2. Физические свойства тиолов
- •2.1.3.Синтезы на основе тиолов
- •2.2. Сульфиды (тиоэфиры)
- •2.3.Сульфоокиси и сульфоны
- •2.4.Сульфокислоты
- •2.5..Сернистые производные угольной кислоты.
- •3. Основные методы извлечения сероорганических
- •3.1. Общая характеристика методов очистки нефтей от сероорганических соединений
- •3.2. Экстракционные методы
- •Метод сернокислотной экстракции.
- •Метод щелочной экстракции.
- •Экстракция органическими растворителями (сольвентная экстракция).
- •3.3. Методы комплексообразования
- •3.4. Методы окисления
- •3.5. Адсорбционно-хроматографические методы
- •Адсорбция на силикагелях.
- •Адсорбция на оксиде алюминия.
- •Адсорбция на цеолитах.
- •Вопросы для самопроверки
- •Список использованной литературы
2.2. Сульфиды (тиоэфиры)
Сульфиды, как и тиолы, могут быть алифатическими, ароматическими, гетероароматическими и смешанными. Некоторые способы получения сульфидов рассмотрены в предыдущей главе.
Одним из наиболее старых, но до сих пор эффективных способов синтеза симметричных сульфидов является алкилирование щелочных солей сероводорода. Эта реакция является SN2 типом замещения при насыщенном атоме углерода:
RX + Na2S → RSNa + NaX
RX + RSNa → R-S-R + NaX
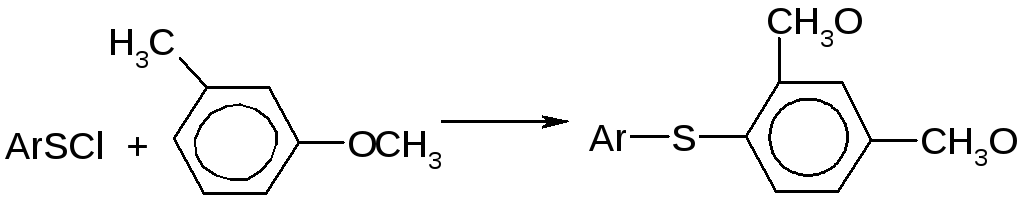
Арилсульфиды получают электрофильным ароматическим замещением, проходящим как присоединение – отщепление.
Активированные ароматические и гетероароматические соединения реагируют с сульфонилгалогенидами без катализатора, например:
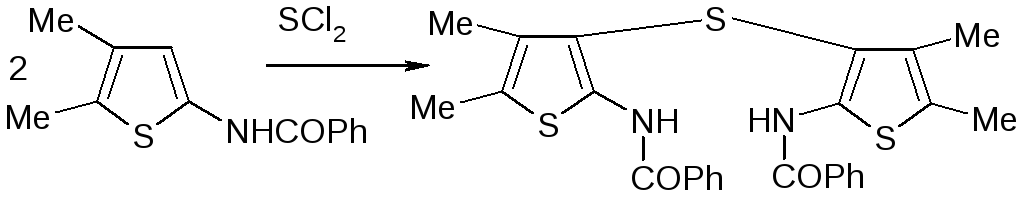
Использование SCl2 приводит к симметричным сульфидам:
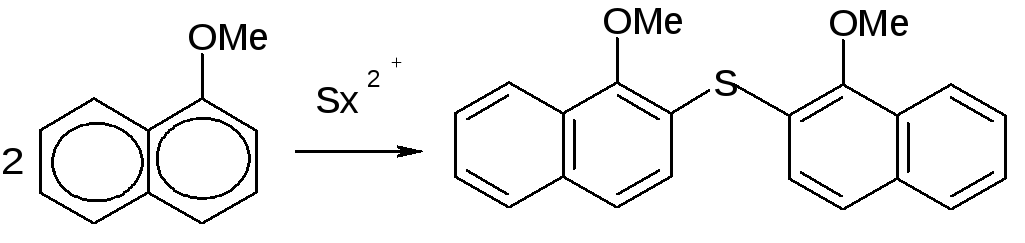
Электрофильные реагенты, содержащие Sx2+, образуются на аноде, состоящем из C и S. Они легко реагируют с такими ароматическими субстратами как анизол, вератрол метоксинафталины с образованием дисульфидов:
Арилсульфиды могут быть получены также нуклеофильным и радикальным замещением
Как известно, но неактивированные галогениды с трудом вступают в SNAr. Реакция облегчается, если ее проводить в апротонном биполярном растворителе. Например, арилсульфид можно получить по реакции:
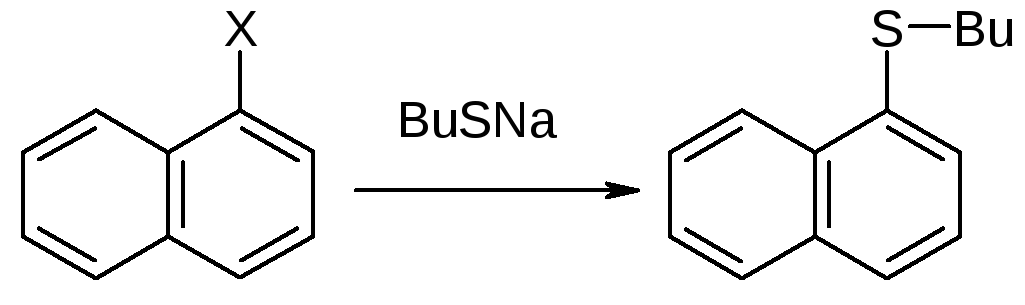
ДМСО
Bu - бутил
ДМСО – диметилсульфидоксид
В газовой фазе (t=500-6000С) реакция хлораренов с H2S и меркаптанами или дисульфидами носит, очевидно, радикальный характер и легче протекает в присутствии π- донорных растворителей:
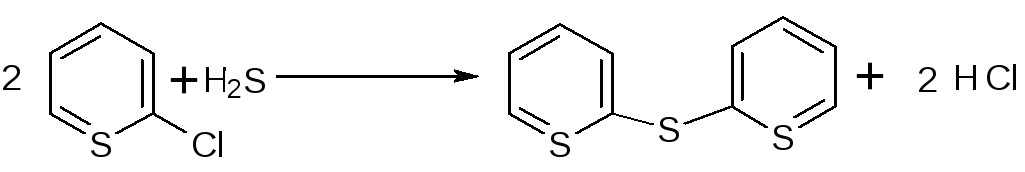
Реакция пойдет как SR, если инициировать радикал RS ∙ :
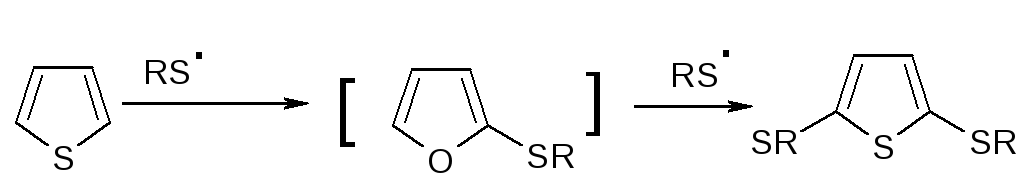
R=Alk
Если R=Ar, то реакция идет по схеме
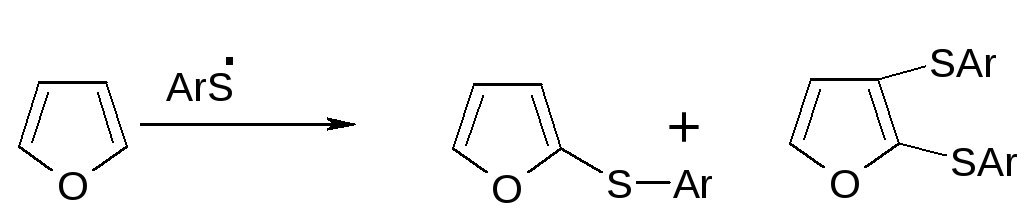
Особенности строения и химического поведения сульфидов.
Сульфиды имеют две неподеленные пары электронов, но известно, что диалкилсульфиды не реагируют с кислотами – они практически не имеют основных (протонофильных свойств), но образуют очень прочные комплексные соединения с рядом металлических солей, например: R2SHgCl2; R2SAuCl3.
Диалкилсульфиды выступают в качестве нуклеофильных реагентов (участвуют электронные пары серы) по отношению к соединениям, которые легко претерпевают нуклеофильное замещение; при этом образуются соли сульфония.
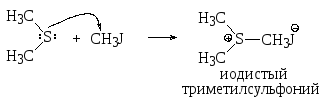
К![]()
![]() атион
включает трехвалентную положительно
заряженную (формально четырехвалентную)
серу. Эти давно известные третичные
сульфониевые соли – аналоги третичных
оксониевых солей
атион
включает трехвалентную положительно
заряженную (формально четырехвалентную)
серу. Эти давно известные третичные
сульфониевые соли – аналоги третичных
оксониевых солей
Третичные оксониевые соли гораздо менее прочны, чем сульфониевые.
Образование сульфониевых солей из алкилгалогенидов обратимо: нагревание соли вызывает диссоциацию на компоненты. Соли сульфония также сходны по структуре и свойствам с четвертичными аммониевыми солями. Их гидроксиды в водных растворах обладают сильными основными свойствами.
Интересно, что при наличии трех различных заместителей, связанных с серой, соли сульфония удается разделить на оптические энантиомеры. Так, взаимодействие метилэтилсульфида с бромуксусной кислотой приводит к соли сульфония, которая в виде соли с оптически активным амином была разделена на право- и левовращающую форму путем кристаллизации.
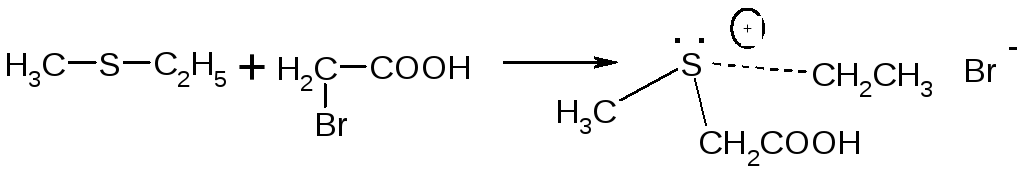
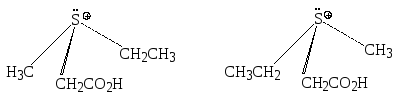
Причина асимметрии этих ионов заключается в неплоском расположении связей, образуемых сульфониевым атомом серы.
Тиоэфиры, как и кислородные аналоги неассоциированы и кипят выше, чем простые эфиры:
|
Вещества |
Температура кипения |
|
(CH3)2O |
-23 С |
|
(C2H5)2O |
35 С |
|
(CH3)2S |
38 С |
|
(C2H5)2S |
92 С |
