
- •Сера и ее неорганические соединения
- •1.1.Сера
- •1.2.Полисульфидные анионы
- •1.3. Гидриды серы (сульфаны)
- •1.4. Галогениды серы
- •2. Органические соединения серы
- •2.1. Тиоспирты (меркаптаны, тиолы)
- •2.1.1. Способы синтеза тиолов
- •2.1.2. Физические свойства тиолов
- •2.1.3.Синтезы на основе тиолов
- •2.2. Сульфиды (тиоэфиры)
- •2.3.Сульфоокиси и сульфоны
- •2.4.Сульфокислоты
- •2.5..Сернистые производные угольной кислоты.
- •3. Основные методы извлечения сероорганических
- •3.1. Общая характеристика методов очистки нефтей от сероорганических соединений
- •3.2. Экстракционные методы
- •Метод сернокислотной экстракции.
- •Метод щелочной экстракции.
- •Экстракция органическими растворителями (сольвентная экстракция).
- •3.3. Методы комплексообразования
- •3.4. Методы окисления
- •3.5. Адсорбционно-хроматографические методы
- •Адсорбция на силикагелях.
- •Адсорбция на оксиде алюминия.
- •Адсорбция на цеолитах.
- •Вопросы для самопроверки
- •Список использованной литературы
2.3.Сульфоокиси и сульфоны
Как было указано выше, окисление сульфидов (лучше всего перекисью водорода в уксусной кислоте) дает сульфоксиды и сульфоны.
Конечный продукт зависит от соотношения реагентов и от природы окислителя.
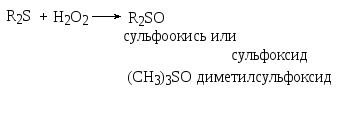
Сильные окислители (KMnO4, HNO3 конц.) - дают сульфоны:
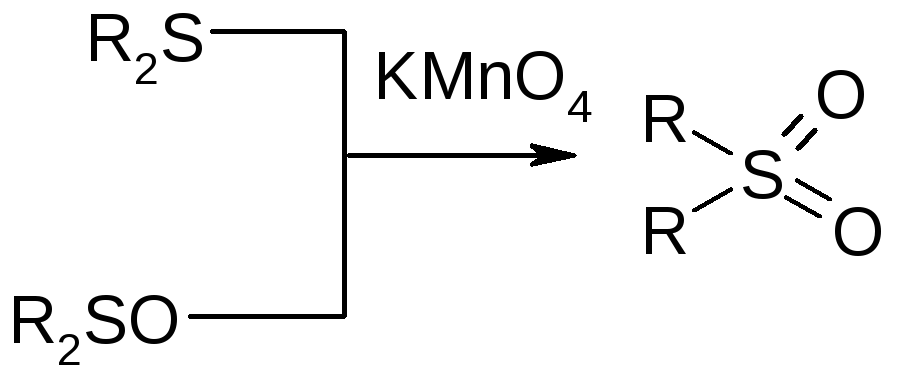
сульфон
Сульфоокиси реагируют с йодистым метилом и другими алкилами аналогично сульфидам – с образованием нового типа ониевых соединений – сульфоксониевых солей
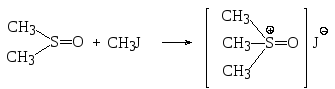
диметилсульфоксид иодид триметилсульфоксония
Связь S=O в сульфоксидах близка к семиполярной, так что формулу сульфоксониевой соли можно написать и так:
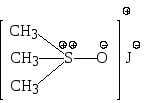
С гидридом натрия NaH, действующим подобно сильной щелочи, эта соль реагирует с потерей HJ и образованием соединения нового интересного типа:
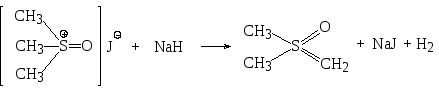
Это соединение представляет собой как бы сульфон, в котором один кислород заменен на метиленовую группировку СН2.
Молекулы сульфоксидов могут быть ассоциированы межмолекулярными связями в сложную систему. Так, для ДМСО (диметил сульфоксид) с помощью квантово-химических расчетов доказана энергетическая выгодность образования димера:
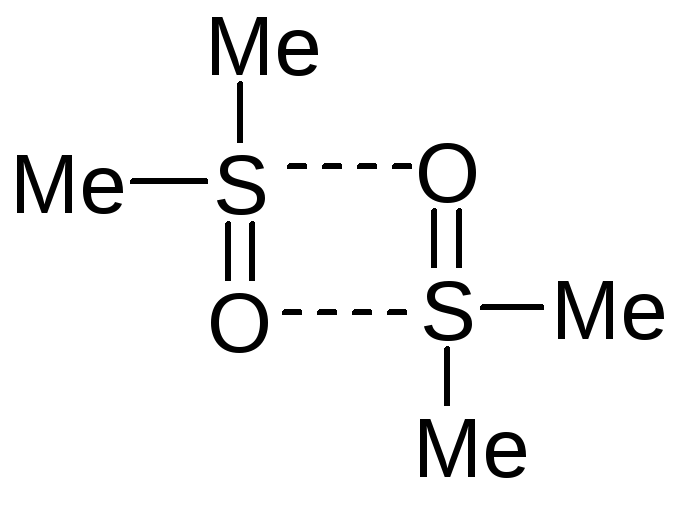
Сульфоксиды достаточно лабильны, они способны диспропорционироваться с образованием сульфида и сульфона даже при наибольшем нагревании.
Наиболее известным из сульфоксидов является диметилсульфоксид (ДМСО)
![]()
Температура кипения - 86С (25 мм. рт. ст.). Это растворитель, находящий широкое применение, особенно удобен в качестве среды для реакций между полярными и неполярными реагентами. В нем диссоциируют галоидные алкилы и вещества с протонируемой связью С-Н. Но ДМСО инертен далеко не всегда. Так, он быстро реагирует с активными -бромкетонами и более медленно с сульфонатами при повышенных температурах. При t > 80С он может разлагаться.
Сульфоны – нейтральные, кристаллические, очень устойчивые вещества.
Они могут быть также хорошими растворителями, но при комнатной температуре – это твердые вещества. Особенностью сульфонов являются высокотемпературные реакции, приводящие к образованию новых С-С связей.:
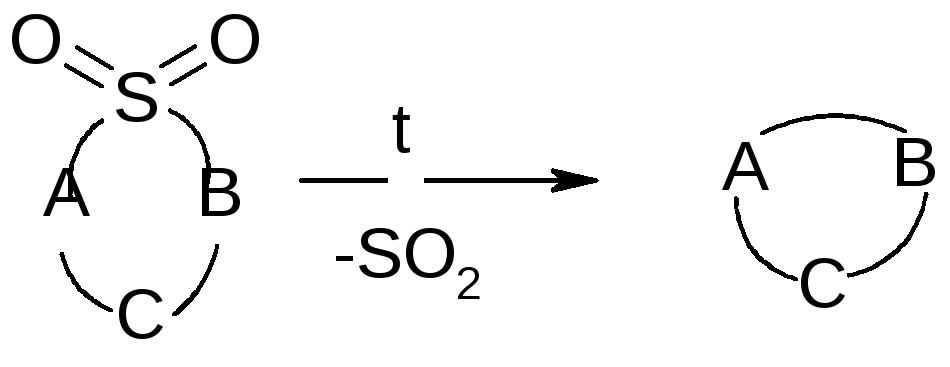
Эти процессы носят свободно радикальный характер.
Сульфоксиды и сульфоны широко представлены в природе. Например, один из наиболее простых сульфоксидов
![]() входит
в состав лука и чеснока.
входит
в состав лука и чеснока.
В них же содержатся и более сложные сульфоксиды. Терпеноидные сульфоксиды содержаться в тяжелых фракциях нефти.
Сульфоны обнаружены в составе различных водорослей, морских губок, грибов, тропических растений.
2.4.Сульфокислоты
Общая формула сульфокислот R-SO3H. Основными методами получения являются:
-
Окисление меркаптанов и дисульфидов сильным окислителем, например, азотной кислотой, приводит к образованию алкансульфокислот:

-
Алифатические сульфокислоты можно также получить по реакции сульфата натрия с алкилгалогенидами, гладко реагирующими по механизму SN2:
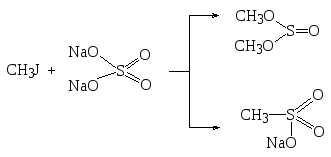
Здесь наряду с нормальной реакцией образования сложного эфира сернистой кислоты (алкилирование по кислороду) происходит реакция с переходом реакционного центра (1,4 – присоединение) – алкилирование по атому серы.
-
Углеводороды, содержащие третичный атом водорода, при действии дымящей серной кислоты сульфируются до алкансульфокислот:
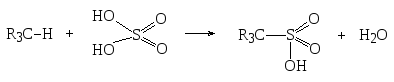
-
Индуцируемое кислородом воздуха присоединение гидросульфита натрия (идет по радикальному механизму – против правила Марковникова).
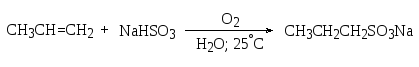
пропансульфонат натрия
5) С 1936 года в технике получают сульфокислоты через их хлорангидриды – сульфохлориды RSO2Cl. На высшие алканы действуют хлором и сернистым газом при инициировании реакции светом. Идет цепная реакция:
![]()
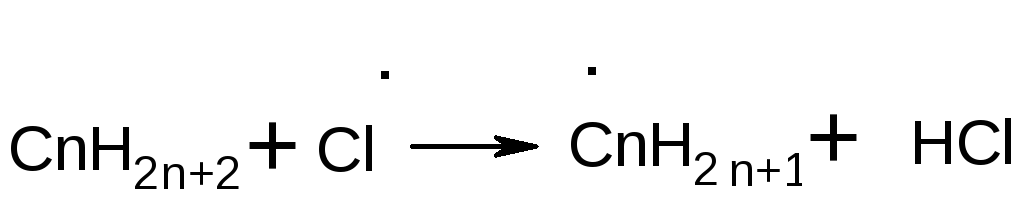
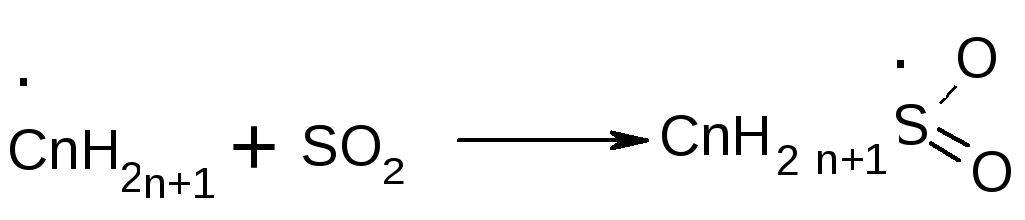
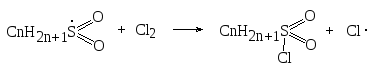
Получается смесь изомерных хлорангидридов, т.к. атомарный хлор вырывает атом водорода в любом звене углеводорода с равной вероятностью. Хлорангидриды сульфокислот превращают в натриевые соли, которые применяются как моющие и эмульгирующие средства, пригодные для употребления, в частности, и в жесткой воде.
6. Алкансульфокислоты получают сульфоокислением, стехиометрия которого может быть описана уравнением:
RH + SO2 + ½ O2 → RSO2OH
Механизм реакции является радикальным;
RH + O2 →R. + .OOH
R· + SO2→ RSO2·
RSO2· + O2 → RSO2OO·
RSO2OO· + RH → RSO2OOH + R·
RSO2OOH → RSO2O· + ·OH
RSO2O· + RH → RSO2OH + R·
и т.д.
7. Ароматические и гетероароматические сульфокислоты получают сульфированием по механизму SEAr
ArH + SO3 → ArSO3H
Механизм реакции:
2 H2SO4 → SO3 + H3O+ + HSO4-
2 H2SO4 → H3SO4+ + HSO4-
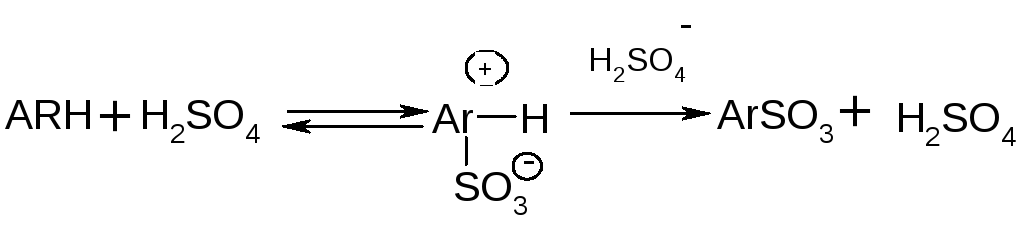
Процессы сульфирования, особенно с использованием олеума, сопровождаются побочной реакцией образования сульфидов:
ArSO3H + 2 H2SO4 → ArSO2+ + H3O+ + 2HSO4-
ArSO3H + SO3 → ArSO2+ + HSO4-
ArSO2+ + ARh → ArSO2Ar + H+
Сульфокислоты по своей силе сравнимыми с серной и хлорной кислотой.
Сульфатные группы представляют собой отличные уходящие группы при реакциях нуклеофильного замещения у атома углерода – отсюда широкие синтетические возможности.
С аммиаком хлорангидриды образуют амиды (сульфамиды):
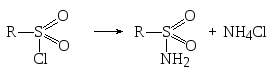
Ароматические сульфокислоты используют для получения лекарственных средств, так называемые сульфамидные препараты, представляют собой производные амидов сульфокислот:
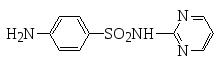
сульфадизин
