
- •Лекций по курсу «методы получения биологически активных соединений» Электронный вариант на основе учебника: в.С. Мокрушин, г.А. Вавилов
- •Предисловие
- •Введение
- •Глава 1
- •Классификация лекарственных средств
- •Действие лекарственных средств на метаболизм живых организмов
- •1.2. Методы поиска новых препаратов
- •1.2.1. Основные этапы создания лекарственных препаратов, подходы к получению и отбору лекарственных средств
- •1.2.2. Разработка плана синтеза
- •1.3. Сырьевая база химико-фармацевтической промышленности
- •1.3.1. Продукты переработки твердого топлива и коксохимического производства
- •1.3.2. Продукты нефтеоргсинтеза
- •1.3.3. Лесохимическое сырье
- •1.3.4. Некоторые продукты многотоннажных производств
- •1.4. Теоретические аспекты выбора метода синтеза
- •1.4.1. Энергетические факторы
- •1.4.2. Классификация реакций
- •1.4.3. Механизм и кинетика реакций
- •1.4.4. Уравнения Гаммета, Тафта
- •1.4.5. Квантово-химические расчеты
- •1.4.6. Выбор растворителя
- •Характеристики растворителей
- •1.5. Разработка технологической схемы производства
- •1.5.1. Категории и типы технологических схем
- •1.5.2. Правила составления и основные требования к технологическим схемам
- •1.5.3. Оформление чертежей технологических схем
- •1.5.4. Типовое оснащение и привязка химического реактора к конкретному производству
- •Глава 2 методы получения промежуточных продуктов и синтетических лекарственных препаратов
- •2.1. Реакции электрофильного замещения
- •2.1.1. Нитрование
- •2.1.1.1. Реакции нитрования в синтезе некоторых лекарственных препаратов
- •2.1.1.2. Химические особенности реакций нитрования, реагенты, механизм
- •2.1.1.3. Нитрование арил и гетариламинов
- •2.1.1.4. Нитрование азотной кислотой
- •2.1.1.5. Технологические аспекты нитрования
- •2.1.1.6. Использование реакции нитрования для получения полупродуктов и лекарственных средств
- •2.1.1.7. Получение нитроэфиров и n-нитросоединений Так же как и при нитровании ароматических соединений, при получении нитроэфиров используют смесь азотной и серной кислот:
- •2.1.2. Нитрозирование
- •2.1.2.1. Механизм нитрозирования, реагенты
- •2.1.2.2. Особенности проведения реакции
- •2.1.2.3. Особенности структуры и свойств нитрозосоединений
- •2.1.2.4. Практика проведения реакции нитрозирования
- •2.1.2.5. Техника безопасности, экология
- •2.1.3. Сульфирование
- •2.1.3.2. Реагенты, использующиеся при проведении реакции сульфирования, механизм реакции
- •2.1.3.3. Особенности сульфирования, побочные реакции
- •2.1.3.4. Влияние температуры
- •2.1.3.5. Сульфирование бензола и его производных
- •2.1.3.6. Сульфирование анилина и его производных
- •2.1.3.8. Сульфирование хлорсульфоновой кислотой
- •2.1.3.9. Техника безопасности, экология
- •2.1.4. Сульфохлорирование
- •2.1.4.1. Химические особенности реакции
- •2.1.4.2. Технологические аспекты сульфохлорирования
- •2.1.4.3. Синтез сульфаниламидных препаратов
- •2.1.4.4. Техника безопасности, экология
- •2.1.5. Введение углеродных остатков в Ароматическое и гетероциклическое ядро
- •2.1.5.1. Реакции с-алкилирования
- •Реагенты, катализаторы. Как отмечалось, реагентами могут быть алкилгалогениды, олефины и спирты:
- •Механизм реакции. При взаимодействии реагента и катализатора быстро образуется карбокатион, его присутствие зафиксировано с помощью спектроскопии ямр:
- •2.1.5.2. Реакции гидроксиалкилирования
- •2.1.5.3. Реакции хлоралкилирования
- •2.1.5.4. Реакции аминоалкилирования
- •2.1.5.5. Реакции с-ацилирования
- •2.1.5.6. Реакции с-формилирования
- •2.1.5.7. Реакция карбоксилирования
- •2.1.5.8. Карбоксилирование алифатических соединений
- •2.1.5.9. Техника безопасности, экология
- •2.1.6. Галогенирование
- •2.1.6.1. Препараты, содержащие в молекуле атомы галогенов
- •2.1.6.2. Реагенты, механизм реакций галогенирования
- •2.1.6.3. Хлорирование ароматических соединений
- •2.1.6.4. Бромирование, иодирование
- •2.1.6.5. Технологические аспекты галогенирования
- •2.1.6.7. Галогенирование альдегидов, кетонов и кислот
- •2.1.6.8. Свободнорадикальное галогенирование
- •Энергия стадий процесса
- •2.1.6.10. Получение галогенамидов
- •2.1.6.11. Окислительное хлорирование
- •2.1.6.12. Меры предосторожности при проведении реакций галогенирования
- •2.1.6.13. Экология
- •2.2. Реакции нуклеофильного замещения
- •Реакции нуклеофильного замещения у насыщенного атома углерода
- •2.2.1.1. Типы реакций
- •Реагенты для проведения реакций алкилирования
- •Механизмы реакций
- •Алкилирование аминов
- •Селективные методы синтеза первичных аминов
- •Селективные методы синтеза вторичных аминов
- •Алкилирование спиртов и фенолов
- •Алкилирование сн кислот
- •Алкилирование гетероциклических соединений
- •Техника безопасности, экология
- •2.2.2. Реакции нуклеофилов с соединениями,
- •2.2.2.1. Обзор реакций, их кинетика и механизм
- •2.2.2.2. Реакции ацилирования
- •2.2.2.3. Реакции нитрилов с нуклеофилами
- •2.2.2.4. Реакции этерификации, получение амидов и гидразидов кислот
- •2.2.2.5. Получение азометинов и гидразонов
- •2.2.2.6. Методы получения первичных аминов с помощью перегруппировок
- •2.2.2.7. Использование реакций в основном органическом синтезе
- •2.2.2.8. Технология, техника безопасности, экология
- •2.2.3. Нуклеофильное замещение в ряду ароматическИх и гетероциклических оединений
- •2.2.3.1. Нуклеофильное замещение по типу sn1
- •2.2.3.2. Ариновое замещение
- •2.2.3.3. Реакции нуклеофилов с ипсо-замещением нуклеофугных групп
- •Получение полупродуктов и лекарственных препаратов. В отсутствие электроноакцепторных заместителей замещение атома хлора происходит при высокой температуре и в присутствии катализатора:
- •2.2.3.4. Нуклеофильное замещение водорода
- •Еще в начале хх в. Было найдено, что реакция хинолина (изохинолина, фенантридина) с хлорангидридами кислот и цианидом натрия дает устойчивые соединения Райсерта (реакция Райсерта):
- •2.2.3.5. Замещение гидроксигрупп
- •2.2.3.6. Замещение по механизму anrorc
- •2.2.3.7. Технологические аспекты проведения реакций, техника безопасности, экология
1.4.5. Квантово-химические расчеты
Используются две группы методов: неэмпирические – ab initio и полуэмпирические. Наиболее точные результаты дает ab initio. Оба используют SCF MO self-consistent-field molecular orbitals, т. е. метод самосогласованного поля и приближения молекулярных орбиталей.
В неэмпирических методах вычисляют большое число молекулярных интегралов. С увеличением размера молекулы базис расчета возрастает приблизительно пропорционально n4. Величина n – общее число базисных атомных орбиталей (АО). При учете конфигурационных взаимодействий, электронной корреляции, поправок на релятивистские эффекты и неадиабатичность существенно увеличивается время расчета. В простейшем случае неэмпирические расчеты строятся с использованием минимального базиса АО. Каждая из АО в разложении представлена одной орбиталью слейтеровского типа (STO). Минимальный базис, содержащий N гауссовских функций (GTO), примененный для аппроксимации одной слейтеровской, равняется трем – STO-3G.
Из-за больших затрат времени на расчеты обычно используют полуэмпирические методы. Разница в том, что в полуэмпирических методах рассматривают только взаимодействия валентных электронов, при этом некоторая часть этих интегралов параметризуется и/или задается константами (именно это и является причиной потери точности), тогда как в ab initio все эти взаимодействия просчитываются (отсюда и большие затраты времени). Приближения, используемые в полуэмпирических методах:
- CNDO complete neglect of differential overlap (Pople, Santry, Segal/1965) рассматривает только валентные электроны. Метод аппроксимирован на атомных потенциалах и сродстве к электрону, причем некоторые из них брались как полуэмпирические величины. Первый метод назывался CNDO/1; в настоящее время используется CNDO/2, в нем улучшена параметризация.
- MINDO/1 (Barid, Dewar/1969) – первая версия модифицированного INDO. Параметры выбирались на основе экспериментальных молекулярных теплот образования, но метод плохо воспроизводил геометрию молекулы. Поэтому в 1970 г. был улучшен в методе MINDO/2 (дает хорошие результаты по длинам связей и теплотам образования, но плохие по длинам связей с водородом). Следующие версии были MINDO/2’ и MINDO/3. Наиболее удачен последний, его ошибки составили 11 ккал/моль по теплоте образования, 0,02 Å по длинам связей, 5 по углам, 0,4D по дипольному моменту и 0,8 эВ по величинам потенциалов ионизации.
- MNDO (модифицированный MNDO) разработан в 1977 г. Его ошибки по величинам: по теплоте образования 9 ккал/моль, 0,025 Å по длинам связей, 3 по углам, 0,36 D по дипольному моменту и 0,5 эВ по потенциалу ионизации.
- AM1 (Austin Model 1) разработан на основе MNDO в 1985 г. В нем была улучшена способность воспроизведения водородных связей, по сравнению с предшествующей версией.
- PM/3 (MNDO parametric method 3) (первый и второй были MNDO и AM1) существенно снизил ошибки MNDO и AM1, при этом точность расчетов теплот образования, геометрии, дипольного момента не теряется.
Сравнение методов MNDO, AM1, РМ3 показывает то, что абсолютная ошибка по Hf298 составляет 22,5 %, 13,8 % и 8,2 % соответственно.
В тонком органическом синтезе для оценки направления атаки реагента на один из альтернативных реакционных центров используют величины зарядов на них (зарядовый контроль реакции), величины и знаки коэффициентов атомной орбитали (АО) высшей занятой молекулярной орбитали или низшей свободной орбитали – АОВЗМО или АОНСМО (орбитальный контроль реакции). Для сравнения реакционной способности в ряду соединений важно знать и величины энергии граничных орбиталей ЕВЗМО и ЕНСМО. Эти данные могут быть получены с помощью квантово-химических расчетов. В реакциях электрофильного и нуклеофильного замещения в ряду ароматических и гетероароматических соединений наблюдается зарядовый контроль. В качестве примера на схеме приведены величины зарядов на атомах двух молекул (расчет проведен в приближении АМ1).
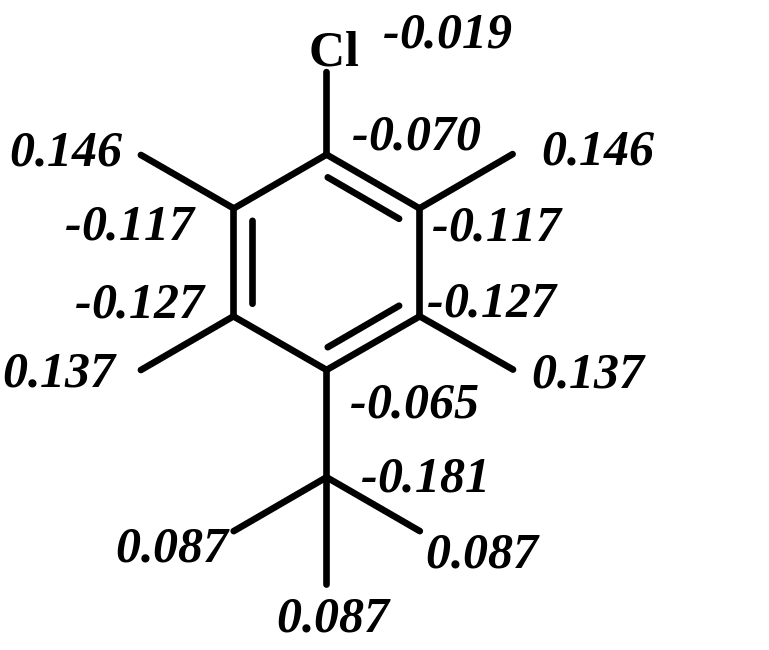
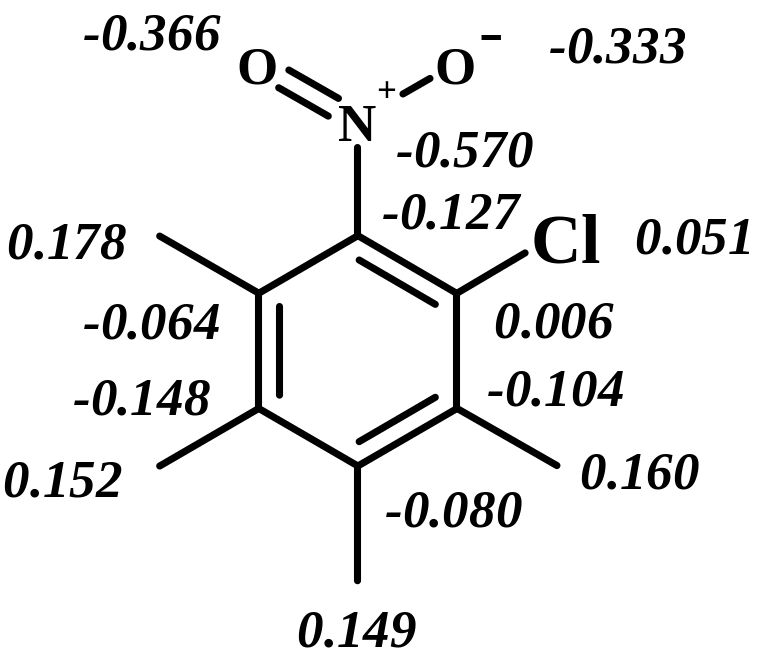
Дипольные моменты: 1,615D 5,351D
ЕВЗМО = - 9,296 эВ, ЕНСМО = 0,134 эВ ЕВЗМО = - 10,314 эВ, ЕНСМО = -1,263 эВ
Экспериментально найденные величины дипольных моментов данных молекул в газовой фазе составляют соответственно 1,74D и 4,35D, что близко к расчетным данным и подтверждает корректность полученных величин. Для сравнения дипольные моменты молекул, найденные расчетом по методу CNDO/2, составляют 3,151D и 6,72D. Сравнение расчетных величин дипольных моментов, полученных с помощью методов АМ1 и CNDO/2, с экспериментальными позволяет отдать предпочтение методу АМ1. Из величин зарядов на атомах углерода п-хлортолуола видно, что в реакциях электрофильного замещения атака электрофильного агента предпочтительнее в положение 2, хотя не исключается атака и в положение 3. Подробно поведение этого соединения в реакции нитрования будет рассмотрено в разделе 2.1.1. В случае о-нитрохлорбезола атака электрофильного агента предпочтительнее в положение четыре ароматического цикла. Действительно, в случае нитрования о-нитрохлорбезола в основном образуется 2,4-динитрохлорбензол. Если рассмотреть поведение этих соединений в реакциях нуклеофильного замещения, то из данных расчета видно, что при взаимодействии с нуклеофилами замещение атома хлора в о-нитрохлорбезоле возможно, а в п-хлортолуоле проблематично.
Таким образом, в сложных случаях с помощью квантово-химических расчетов можно прогнозировать поведение молекулы в различных реакциях. Однако корректность расчетов должна быть подтверждена соответствием полученных результатов с физическими параметрами. Например, с геометрией молекулы, найденной с помощью рентгеноструктурного анализа (РСА), а в приведенных примерах с величинами дипольных моментов молекул. В противном случае из результатов квантово-химических расчетов можно сделать неправильные выводы.
Квантово-химические расчеты используют также для описания механизма реакции. При этом они являются единственным некосвенным источником информации о структуре и энергетике переходных состояний, которые в принципе невозможно наблюдать экспериментально. Они также незаменимы при рассмотрении высоколабильных интермедиатов, поскольку экспериментальные методы не позволяют их охарактеризовать. В таких случаях ведут расчет поверхности потенциальной энергии (ППЭ).
