
- •Моносахариды. Строение, номенклатура. Стереохимия и конформация моносахаридов. Аномерный центр: его стереохимия, особые свойства гидроксильной группы.
- •Важнейшие производные моносахаридов: гексозы, дезоксисахара, аминосахара, уроновые кислоты, нейраминовая и сиаловые кислоты.
- •Химические свойства моносахаридов (алкилирование, ацилирование, восстановление, окисление, енолизация, гликозилирование).
- •Олигосахариды. Классификация, номенклатура, стереохимия.
- •Определение моносахаридного состава
- •Определение мест присоединения моносахаридных остатков друг к другу
- •Последовательность звеньев в молекуле гетероолигосахарида.
- •Метод Кенигса-Кнорра.
- •Ортоэфирный метод.
- •Оксазолированный метод
- •Стериоспецифичность
- •Трихлорацетимидатный метод
- •Полисахариды. Классификация. Гомополисахариды: крахмал, целлюлоза, гликоген, хитин, декстран. Гетерополисахариды: гемицеллюлоза, пектиновые вещества.
- •Общие принципы установления строения полисахаридов.
- •Группоспецифические вещества крови. Антигены и антитела, агглютинация.
- •Гликолипиды. Гликозилдиглицериды, цереброзиды. Ганглиозиды: классификация и биологическая роль.
- •Фосфолипиды. Строение и номенклатура. Глицерофосфолипиды. Полиглицерофосфаты, фосфоинозитиды.
- •Глицерофосфолипиды:
- •Полиглицерофосфаты:
- •Фосфоинозитиды:
- •Ферменты липидного обмена. Специфичность, использование в полусинтезе липидов.
- •Методы синтеза фосфолипидов. Использование фосфиттриэфирного и н-фосфонатного методов для образования фосфодиэфирной связи.
- •Фосфодиэфирный метод
- •Выделение липидов из природного сырья.
- •Сфинголипиды. Сфингозиновые основания, типы природных сфинголипидов. Сфингофосфосфолипиды.
- •Липиды и биологические мембраны
- •Фазовые состояния липидных агрегатов, фазовые переходы. Динамическое состояние липидов в бислое. Понятие о жидкокристаллическом состоянии. Латеральная диффузия и флип-флоп.
- •Витамины и кофакторы ферментов. Общая характеристика витаминов группы в. Другие водорастворимые витамины.
- •Биологическая роль оксидоредуктаз.
- •Витамин в1 (тиамин). Нахождение в природе, биологическая роль тиаминпирофосфата (кокарбоксилазы) как кофермента альдегиддегидрогеназ и дегидрогеназ.
- •Витамин в2 (рибофлавин), флавинмононуклеотид (фмн) и флавинадениндинуклеотид (фад).
- •Витамин в3 (пантотеновая кислота). Строение, биологическая роль как части кофермента а.
- •Витамин рр (никотиновая кислота и никотинамид). Принципы биологического действия: понятие о над- и фад-зависимых ферментах.
- •Витамин в6 (пиридоксаль). Биологическая роль пиридоксаля как кофермента трансаминаз.
- •Витамин Вс (фолиевая кислота). Биологическая роль в переносе одноуглеродных фрагментов.
- •Витамины группы в12 (цианкобаламин, оксикобаламин). Строение и биологическое действие.
- •Витамин н (биотин). Строение, биологическое действие.
- •Витамин n (липоевая кислота). Биологическая роль в процессах окислительного декарбоксилирования.
- •Витамин с (аскорбиновая кислота).
- •Витамины группы а. Витамин а1 (ретинол) и витамин а2 (дегидроретинол), их роль в зрительном процессе. Β-Каротин - провитамин а.
- •Витамины группы к, убихиноны. Роль в системе свертывания крови.
- •Витамины группы е (токоферолы). Биологическое действие.
- •Незаменимые ненасыщенные кислоты (витамины группы f). Эйкозаноиды. Каскад арахидоновой кислоты. Понятие о простагландинах и лейкотриенах.
- •Каскад арахидоновой кислоты
- •Витамины группы d, строение, биологическое действие. Холестерин как предшественник витаминов группы d.
- •Понятие о способах и механизме межклеточной сигнализации. Локальные химические медиаторы, гормоны, нейромедиаторы. Механизмы действия водорастворимых и жирорастворимых сигнальных молекул.
- •Общее представление о механизме действия стероидов на молекулярном уровне.
-
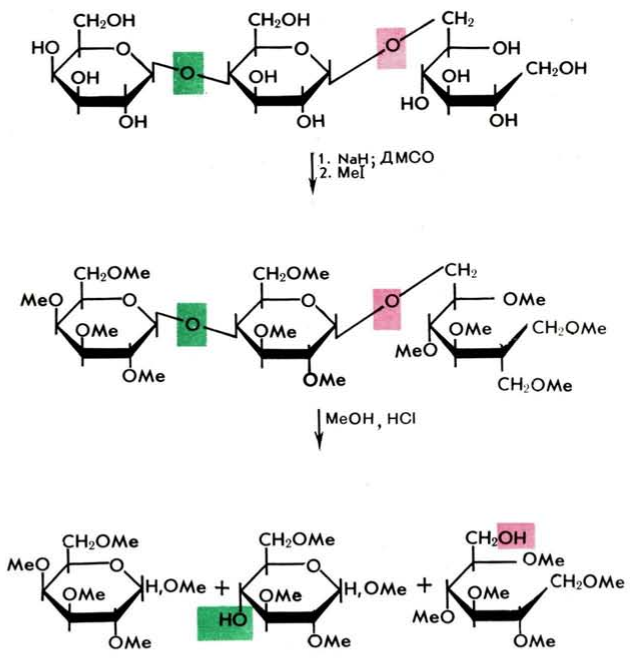
Определение мест присоединения моносахаридных остатков друг к другу
Осуществляется исчерпывающим метилированием олигосахарида с последующим гидролизом и анализом образующихся продуктов.
-
ДМСО, 30% NaOH (м-д Хеуорса)
-
CH3I, Ag2O (мягкий)
-
CH3I, NaH, ДМСО (метод Хакомори)
Олигосахарид подвергается далее кислотному гидролизу или, лучше, метанолизу, в результате получается набор метилированных моносахаридов со свободными гидроксильным группами, участвующими в образовании гликозидных связей.
Обнаружение в метилированных продуктах после метанолиза моносахаридов с более чем одной свободной гидроксильной группой свидетельствует о наличии в цепи разветвлений. Остаток, локализованный на невосстанавливающем конце олигосахаридной цепи, не содержит свободных гидроксильных групп, а моносахарид, находившийся на восстанавливающем конце, легко идентифицировать в вид метилированного полиола в продуктах гидролиза метилированного восстановленного олигосахарида.
-
Последовательность звеньев в молекуле гетероолигосахарида.
-
Определяется главным образом с помощью экзогликозидаз — ферментов, отщепляющих по одному моносахаридному остатку с невосстанавливающего конца молекулы.

Важным свойством гликозидаз является стереоспецифичность действия: α-гликозидаза не расщепляет β-гликозидную связь. Это свойство позволяет однозначно установить конфигурацию гликозидной связи расщепляемого олигосахарида.
-
Периодатное окисление. Модификацией метода является деградация п Ф. Смиту, заключающаяся в последовательном окислении сахарида периодатом, восстановлении боргидридом и последующего мягкого кислотного гидролиза образующегося продукта; сохранившиеся гликозидные связи при этом не затрагиваются.
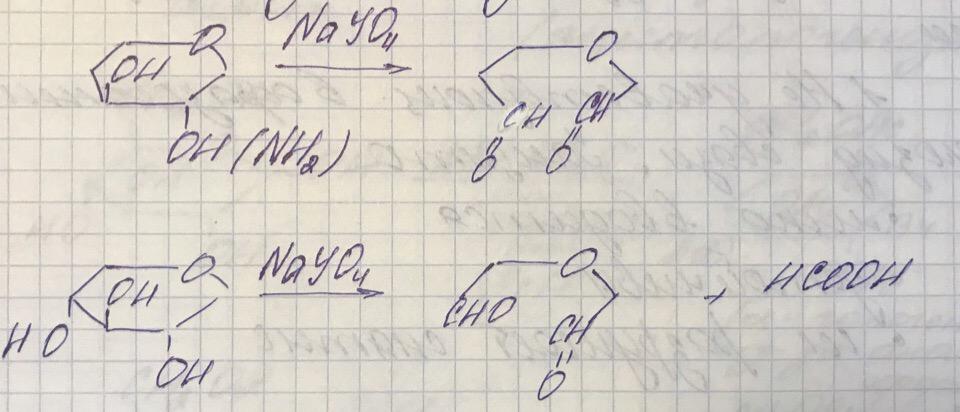

-
Методы синтеза олигосахаридов (методы Кенигса-Кнорра, ортоэфирный, оксазолиновый, трихлорацетимидатный, гликозилфторидный), стереохимия гликозидной связи, основные проблемы синтеза олигосахаридов: особенности и способы синтеза 1,2-цис- и 1,2-транс-гликозидов.
-
Введение защиты на не участвующие в создание связи группы
-
Условие выбора: легко вводится, устойчива, не разрушает вещество при снятии
Защиты:
-
Защита
Снятие
Bn (бензильный)
H2/Pd
Tr (по первичному CH2OH)
H+
TBDMS (третбутилдиметилсилильная)
Bu4NF
TBDPS (третбутилдифинилсилильная)
Bu4NF
Ac (ацетильная)
OH-
Bz (бензоильная)
OH-
Изопропилидиновая
H+
Бензилиденова
H+
Все методы создания отличаются характером создания активации гликозидного центра.
-
Метод Кенигса-Кнорра.
Гликозилирующий агент (гликозильный донор): ацилированный α-D-гликозилгалогенид (ацетилгалогеноза).


Реакция с гидроксилсодержащим компонентом в присутствии оксида или карбоната серебра приводит к образованию 1,2-гранс-гликозидной связи. Оксид и карбонат серебра играют двоякую роль: с одной стороны, они облегчают диссоциацию связи С-1 — галоген, являясь таким образом катализатором реакции, с другой стороны, служат акцептором протонов, образующихся в ходе превращения.
Недостатками метода являются образование в ходе реакции воды, разлагающе ацилгалогенозу, и гетерогенность реакционной смеси.
