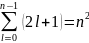- •23. Собственный механический и магнитный моменты электрона.
- •24 Полный механический и магнитный моменты электрона. Принцип Паули
- •25. Распределение электронов в атоме по состояниям. Таблица Менделеева.
- •7. Давление света.
- •8. Гипотеза де Броиля.Волновой пакет частиц.
- •11. Операторы.
- •12 Собственные волновые функции и собственные значения физических величин. Собственные волновые функции оператора компоненты импульса.
- •15 Уравнение Шредингера для свободной частицы.
- •Частица в одномерной потенциальной яме.
- •20. Линейный гармонический квантовый осциллятор
- •21. Классическая модель атома водорода
- •22. Уравнение Шредингера для водорода. Квантовые числа
- •43.Деление ядер
- •44.Плазма
- •9.Соотношение неопределенностей Гейзенберга.
- •10.Опыт Дэвиссона и Джермера. Смысл волн де Бройля
- •4.Гипотеза Планка. Вывод формулы Планка.
- •5.Внешний фотоэффект.
- •6.Эффект Комптона.
- •34. Эффективная масса электрона
- •35. Полупроводники. Собственная и примесная проводимость.
- •36. Полупроводниковый диод.
- •37. Эффект Зеебека. Эффект Пельтье.
- •38. Конт разн потенц Контакт металл-металл.
- •39. Атомное ядро и его характеристики.
- •40. Ядерные силы и их свойства.
- •41. Радиоактивность. Альфа-распад. Бета-распад.
- •42.Закон радиоактивного распада.
- •26 Механический и магнитный моменты атома. Ls-связь.
- •27 Понятия об энергетических уровнях молекул.
- •28.Рентгеновские спектры. Закон Мозли.
- •29. Принцип тождества микрочастиц
- •30. Электронный газ в одномерном случае. Энергия Ферми.
- •31. Распределение Ферми-Дирака
- •32. Распределение Бозе-Эйнштейна
- •33. Энергетические зоны кристалла
- •45. Термоядерный синтез
- •46. Цепная реакция
- •Особенности теплового излучения, его характеристики.
- •2 Законы Кирхгофа, Стефана-Больцмана, Вина.
- •3. Тепловое излучение. Формула Релея-Джинса.
- •17 Решение уравнение Шредингера для низкого потенциального барьера.
- •18 Решение уравнение Шредингера для высокого потенциального барьера.
- •19)Туннельный эффект
- •13. Принцип причинности. Общее уравнение Шрёдингера.
- •14.Уравнение Шредингера для стационарных состояний
21. Классическая модель атома водорода
1. Модель атома Томпсона (пудиноговая)
Атом – однородная положительно заряженная по объему сфера, в которую вкраплены отрицательные заряды для создания нейтрального атома. Отрицательный заряд под действием квазиупругой силы колеблется.
2. Модель Резерфорда (планетарная)
Вокруг ядра, в котором сосредоточен положительный заряд, движутся по круговым орбитам электроны. Размеры ядра – 10-13 см
атома – 10-8см.
Недостаток: электрон, двигаясь по орбите, обладает ускорением, а любая заряженная частица, двигаясь ускоренно, излучает электромагнитные волны и, как следствие, теряет энергию, следовательно, электрон должен упасть на ядро. Модель оказалась нестабильной.
3. Модель атома Бора
Для создания устойчивой модели Бор высказал два постулата:
1. Атом может находиться сколь угодно долго в стационарном состоянии En , и при этом не излучать и не поглощать энергию. Это означает, что электрон может сколь угодно долго двигаться по своей орбите. Математически 1 постулат Бора записывается в виде условия квантования орбитального момента импульса электрона . Иначе , это условие называется условием квантования боровских орбит. mvrn=nℏ, где rn - радиус орбиты электрона.
2. Атом может излучать или поглощать энергию только при переходе электрона с одной стационарной орбиты на другую. При этом излучаемая или потребляемая энергия определяется условием hv=En-Em
Получим выражения, определяющие радиусы боровских орбит и энергию в атоме водорода.
Уравнение движения электрона по орбитам:
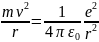
Из условия квантования орбит
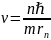
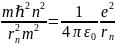
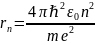
Рассчитаем энергию электрона в атоме водорода
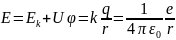
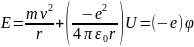
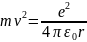
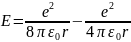
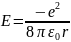
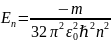
22. Уравнение Шредингера для водорода. Квантовые числа
Электрон
в атоме водорода движется в
центально-симметричном поле и обладает
потенциальной энергией: U=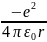
Уравнение Шредингера для атома водорода имеет вид
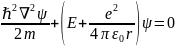
Уравнение Шредингера в декартовых координатах не решается, поэтому перейдем к полярным координатам
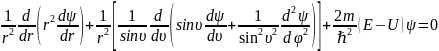

Уравнение Шредингера для атома водорода имеет решение для значений энергии E>0 и E<0
1. решение E>0 соответствует пролету электрона около ядра и интереса не представляет.
2. Решение E<0 соответствует электрону, связанному с ядром. Решение уравнение Шредингера дает значение энергии.
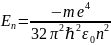 n-
главное квантовое число, определяет
номер энергетического уровня для
электрона. Значения – 1,2,3…
n-
главное квантовое число, определяет
номер энергетического уровня для
электрона. Значения – 1,2,3…
При
решении уравнения Шредингера для атома
водорода получаются волновые функции,
которые не
только зависят
от сферических координат и от трех
квантовых чисел (n,
l,
m).
Квантовое число l
– орбитальное. Определяет условие
квантования квадрата модуля момента
импульса.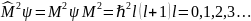
Для электрона в атоме l изменяется от 0 до n-1.
Каждому значению l соответствует буква
l=0 – s-состояние
l=1 – p-состояние
l=2 – d-состояние
Квантовое число m – магнитное квантовое число. Определяет условия квантования проекции момента импульса.
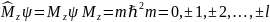
n=1, 2, 3…
l=0,1,2,…, n-1
m=
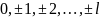
Каждому значению числа n соответствуют n значений числа l
Каждому значению числа l соответствуют 2l+1 значений числа m
Каждому значению n, которое определяет энергетический уровень, соответствует n2 волновых функций, отличающихся друг от друга значениями l и m.
Энергетический уровень выражает степень вырождения