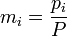- •Вопрос 30
- •Вопрос 31
- •Вопрос 32
- •Вопрос 33
- •Вопрос 34
- •Средняя квадратичная скорость молекул — среднее квадратическое значение модулей скоростей всех молекул рассматриваемого количества газа
- •70.Развитие представлений о природе света
- •71.Интерференция света
- •4.4 Интерференция в тонких плёнках
- •73. Дифракция
- •74. Дифракционная решётка
- •75.Пространственная решетка и рассеяние света
- •76.Дисперсия Света
- •35 Вопрос
- •Вопрос 36
- •Вопрос 37
- •Вопрос 38
- •Вопрос 39
- •Вопрос 40
- •Вопрос 41
- •1 Вопрос
- •2 Вопрос
- •3 Вопрос
- •4 Вопрос
- •7 Вопрос
- •6 Вопрос
- •[Править]Вывод
Вопросс 29
Закон Гей-Люссака : Закон пропорциональной зависимости объёма газа от абсолютной температуры при постоянном давлении. Гей-Люссак первым продемонстрировал, что закон применим ко всем газам, а также к парам летучих жидкостей при температуре выше точки кипения. Математически он выразил своё открытие так:
![]()
где ![]() —
объём данного количества газа при
температуре 100 °C;
—
объём данного количества газа при
температуре 100 °C; ![]() —
объём того же газа при 0 °C;
—
объём того же газа при 0 °C; ![]() —
константа, одинаковая для всех газов
при одинаковом давлении.
—
константа, одинаковая для всех газов
при одинаковом давлении.
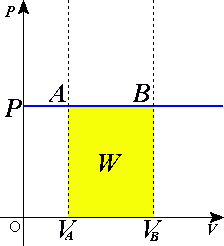
Изобарный процесс:
термодинамический процесс, происходящий в системе при постоянном давлении и постоянной массе идеального газа.
Согласно закону
Гей-Люссака,
при изобарном процессе в идеальном
газе .
![]()
Работа,
совершаемая газом при расширении или
сжатии газа, равна
.
![]()
Количество
теплоты, получаемое или отдаваемое
газом, характеризуется изменением энтальпии: ![]() .
.
Простейшие примеры изобарных процессов — нагревание воды в открытом сосуде, расширение газа в цилиндре со свободно ходящим поршнем. В обоих случаях давление равно атмосферному. Если изобарный процесс происходит настолько медленно, что давление в системе можно считать постоянным и равным внешнему давлению, а температура меняется так медленно, что в каждый момент времени сохраняется термодинамическое равновесие, то изобарный процесс обратим. Для осуществления изобарного процесса к системе надо подводить или отводить теплоту, которая расходуется на работу расширения и изменение внутренней энергии.
Графическое представление изобарного процесса
Вопрос 30
Основные уравнение мкт
![]() ,
где k является постоянной
Больцмана (отношение универсальной
газовой постоянной R к числу
Авогадро NA), i —
число степеней свободы молекул (
,
где k является постоянной
Больцмана (отношение универсальной
газовой постоянной R к числу
Авогадро NA), i —
число степеней свободы молекул (![]() в
большинстве задач про идеальные газы,
где молекулы предполагаются сферами
малого радиуса, физическим аналогом
которых могут служить инертные газы),
а T -
абсолютная температура.
в
большинстве задач про идеальные газы,
где молекулы предполагаются сферами
малого радиуса, физическим аналогом
которых могут служить инертные газы),
а T -
абсолютная температура.
Основное уравнение МКТ связывает макроскопические параметры (давление, объём, температура) газовой системы с микроскопическими (масса молекул, средняя скорость их движения).
Изохорный процесс
Изохорический или изохорный процесс (от др.-греч. ἴσος «равный» и χώρος «место») — термодинамический процесс, который происходит при постоянном объёме. Для осуществления изохорного процесса в газе или жидкости достаточно нагревать (охлаждать) вещество в сосуде, который не изменяет своего объёма.
Изохорный процесс осуществляется в газах и жидкостях, находящихся в замкнутом сосуде, объем которого не меняется. В этом случае при изменении температуры газа (жидкости) изменяется его давление.
При изохорном процессе газ над внешними телами работы не совершает, не совершается и механической работы, связанной с изменением объема тела, поэтому изменение внутренней энергии тела происходит только за счет поглощения или выделения тепла. В случае изохорного процесса в идеальном газа вся теплота, сообщаемая газу, идет на увеличение его внутренней энергии.
В идеальном газе при изохорном процессе для данной массы газа при постоянном объеме давление газа, в соответствии с законом Шарля, прямо пропорционально температуре. Изохорный процесс можно описать уравнением:
р = рoaT,
где р — давление газа при абсолютной температуре Т;
р0 — давление газа при температуре 0оС;
a — температурный коэффициент объемного расширения газа, равный 1/273 К-1
графическое представление изохорного процесса
Уравнение изохорного процесса: v = const.
Графически в p-v-диаграмме изохорный процесс изображается линией, параллельной оси давлений Линии изохорного процесса в диаграмме состояния называется изохорой
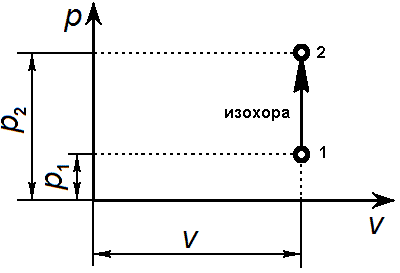
Связь между параметрами в изохорном процессе подчиняется закону Шарля
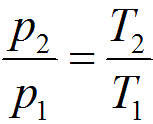
И изохорном процессе вся подведенная теплота расходуется на изменение внутренней энергии тела. Для тела с произвольной массой вещества m имеем:
![]()
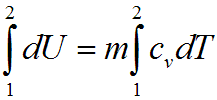
![]()
где cv — средняя массовая изохорная теплоемкость в интервале температур от T1, до Т2.
Вопрос 31
Количество вещества
физическая
величина,
характеризующая количество однотипных
структурных единиц, содержащихся
в веществе.
Под структурными единицами понимаются
любые частицы, из которых состоит
вещество (атомы, молекулы, ионы, электроны или
любые другие частицы). Единица
измерения количества
вещества в СИ — моль.
Фактическое количество единиц вещества
в 1 моле называется числом
Авогадро (![]() )
)
Молярная масса — это масса, которая приходится на один моль данного вещества. Молярная масса вещества может быть получена произведениеммолекулярной массы этого вещества на количество молекул в 1 моле — на число Авогадро. Необходимо отметить, что значение молярной массы вещества определяется его качественным и количественным составом, т.е. зависит от Mr и Ar. Поэтому разные вещества при одинаковом количестве молей имеют различные массы m
Постоянная Авогадро
(число
Авогадро) - число структурных элементов
(атомов, молекул, ионов или других частиц)
в одном моле.
Названа в честь А. Авогадро, обозначается ![]() .
постоянная Авогадро - одна из
фундамнентальных физических констант,
существенная для определения многих
других физических констант (постоянной
Больцмана, постоянной Фарадея и
др.)
.
постоянная Авогадро - одна из
фундамнентальных физических констант,
существенная для определения многих
других физических констант (постоянной
Больцмана, постоянной Фарадея и
др.)
Закон Авогадро
Его можно сформулировать так: один моль любого газа при одинаковых температуре и давлении занимает один и тот же объем, при нормальных условияхравный 22,41383 л. Эта величина известна как молярный объем газа.
Закон Дальтона
Закон
о суммарном давлении смеси газов
- Давление смеси химически не
взаимодействующих идеальных
газов равно
сумме парциальных
давлений.
![]()
Закон
о растворимости компонентов газовой
смеси - При
постоянной температуре растворимость в
данной жидкости каждого из компонентов
газовой смеси, находящейся над жидкостью,
пропорциональна их парциальному
давлению.