
- •Вопрос 30
- •Вопрос 31
- •Вопрос 32
- •Вопрос 33
- •Вопрос 34
- •Средняя квадратичная скорость молекул — среднее квадратическое значение модулей скоростей всех молекул рассматриваемого количества газа
- •70.Развитие представлений о природе света
- •71.Интерференция света
- •4.4 Интерференция в тонких плёнках
- •73. Дифракция
- •74. Дифракционная решётка
- •75.Пространственная решетка и рассеяние света
- •76.Дисперсия Света
- •35 Вопрос
- •Вопрос 36
- •Вопрос 37
- •Вопрос 38
- •Вопрос 39
- •Вопрос 40
- •Вопрос 41
- •1 Вопрос
- •2 Вопрос
- •3 Вопрос
- •4 Вопрос
- •7 Вопрос
- •6 Вопрос
- •[Править]Вывод
Вопрос 39
Круговым
процессом (или циклом) называется
процесс, при котором система, проходя
через ряд состояний, возвращается в
первоначальное. На диаграмме цикл
изображается замкнутой кривой (рис. 1).
Цикл, который совершает идеальный газ,
можно разбить на процессы расширения
(1—2) и сжатия (2—1) газа. Работа расширения
(равна площади фигуры 1a2V2V11) положительна
(dV>0), работа сжатия (равна площади
фигуры 2b1V1V22) отрицательна (dV<0).
Следовательно, работа, которую совершает
газ за цикл, равен площади, охватываемой
замкнутой кривой. Если за цикл совершается
положительная работа A=∫pdV>0 (цикл идет
по часовой стрелке), то он называется
прямым (рис. 1, а), если за цикл осуществляется
отрицательная работа A=∫pdV<0 (цикл идет
против часовой стрелки), то он называется
обратным (рис. 1, б).
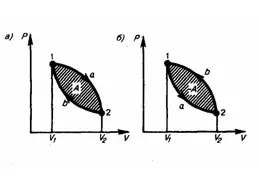 Прямой
цикл применяется в тепловых двигателях
— периодически действующих двигателях,
которые совершают работу за счет
полученной извне теплоты. Обратный цикл
применяется в холодильных машинах —
периодически действующих установках,
в которых за счет работы внешних сил
теплота переходит к телу с более высокой
температурой.
Прямой
цикл применяется в тепловых двигателях
— периодически действующих двигателях,
которые совершают работу за счет
полученной извне теплоты. Обратный цикл
применяется в холодильных машинах —
периодически действующих установках,
в которых за счет работы внешних сил
теплота переходит к телу с более высокой
температурой.
В
результате кругового процесса система
возвращается в исходное состояние и,
значит, полное изменение внутренней
энергии газа есть нуль. Поэтому первое
начало термодинамики для кругового
процесса
![]() т.
е. работа, которая совершается за цикл,
равна количеству теплоты, полученной
извне. Однако в результате кругового
процесса система может теплоту как
получать, так и отдавать, поэтому
т.
е. работа, которая совершается за цикл,
равна количеству теплоты, полученной
извне. Однако в результате кругового
процесса система может теплоту как
получать, так и отдавать, поэтому![]() где
Q1 — количество теплоты, которая получила
система, Q2 — количество теплоты, которое
отдала система. Поэтому термический
коэффициент полезного действия для
кругового процесса
где
Q1 — количество теплоты, которая получила
система, Q2 — количество теплоты, которое
отдала система. Поэтому термический
коэффициент полезного действия для
кругового процесса![]() Термодинамический
процесс называется обратимым, если он
может осуществляться как в прямом, так
и в обратном направлении, причем если
такой процесс осуществляется сначала
в прямом, а затем в обратном направлении
и система возвращается в первоначальное
состояние, то в окружающей среда и в
этой системе не происходит никаких
изменений. Всякий процесс, не удовлетворяющий
этим условиям, является необратимым.
Любой равновесный процесс является
обратимым. Обратимость равновесного
процесса, который происходит в системе,
следует из того, что любое промежуточное
состояние является состоянием
термодинамического равновесия; для
него не имеет значения, идет процесс в
прямом или обратном направлении. Реальные
процессы также сопровождаются диссипацией
энергии (из-за трения, теплопроводности
и т. д.), которая здесь нами не обсуждается.
Обратимые процессы — это идеализация
реальных процессов. Их исследование
важно по двум причинам: 1) многие процессы
в природе и технике практически обратимы;
2) обратимые процессы являются наиболее
экономичными; имеют максимальный
термический коэффициент полезного
действия (КПД), что позволяет указать
пути повышения КПД реальных тепловых
двигателей.
Энтропи́я
(от др.-греч. ἐντροπία - поворот,
превращение) — в естественных науках
мера беспорядка системы, состоящей из
многих элементов. В частности, в
статистической физике — мера вероятности
осуществления какого-либо макроскопического
состояния; в теории информации — мера
неопределённости какого-либо опыта
(испытания), который может иметь разные
исходы, а значит, и количество информации;
в исторической науке, для экспликации
феномена альтернативности истории
(инвариантности и вариативности
исторического процесса).Энтропия в
информатике — степень неполноты,
неопределённости знаний.Понятие энтропии
впервые было введено Клаузиусом в
термодинамике в 1865 году для определения
меры необратимого рассеивания энергии,
меры отклонения реального процесса от
идеального. Определённая как сумма
приведённых теплот, она является функцией
состояния и остаётся постоянной при
обратимых процессах, тогда как в
необратимых — её изменение всегда
положительно.
Термодинамический
процесс называется обратимым, если он
может осуществляться как в прямом, так
и в обратном направлении, причем если
такой процесс осуществляется сначала
в прямом, а затем в обратном направлении
и система возвращается в первоначальное
состояние, то в окружающей среда и в
этой системе не происходит никаких
изменений. Всякий процесс, не удовлетворяющий
этим условиям, является необратимым.
Любой равновесный процесс является
обратимым. Обратимость равновесного
процесса, который происходит в системе,
следует из того, что любое промежуточное
состояние является состоянием
термодинамического равновесия; для
него не имеет значения, идет процесс в
прямом или обратном направлении. Реальные
процессы также сопровождаются диссипацией
энергии (из-за трения, теплопроводности
и т. д.), которая здесь нами не обсуждается.
Обратимые процессы — это идеализация
реальных процессов. Их исследование
важно по двум причинам: 1) многие процессы
в природе и технике практически обратимы;
2) обратимые процессы являются наиболее
экономичными; имеют максимальный
термический коэффициент полезного
действия (КПД), что позволяет указать
пути повышения КПД реальных тепловых
двигателей.
Энтропи́я
(от др.-греч. ἐντροπία - поворот,
превращение) — в естественных науках
мера беспорядка системы, состоящей из
многих элементов. В частности, в
статистической физике — мера вероятности
осуществления какого-либо макроскопического
состояния; в теории информации — мера
неопределённости какого-либо опыта
(испытания), который может иметь разные
исходы, а значит, и количество информации;
в исторической науке, для экспликации
феномена альтернативности истории
(инвариантности и вариативности
исторического процесса).Энтропия в
информатике — степень неполноты,
неопределённости знаний.Понятие энтропии
впервые было введено Клаузиусом в
термодинамике в 1865 году для определения
меры необратимого рассеивания энергии,
меры отклонения реального процесса от
идеального. Определённая как сумма
приведённых теплот, она является функцией
состояния и остаётся постоянной при
обратимых процессах, тогда как в
необратимых — её изменение всегда
положительно.
![]() где
Q
— приращение энтропии;
—
минимальная теплота, подведенная к
системе; T — абсолютная температура
процеса Употребление в различных
дисциплинахТермодинамическая энтропия
— термодинамическая функция,
характеризующая меру неупорядоченности
термодинамической системы, то есть
неоднородность расположения и движения
её частиц.Информационная энтропия —
мера неопределённости источника
сообщений, определяемая вероятностями
появления тех или иных символов при их
передаче.Дифференциальная энтропия —
энтропия для непрерывных распределений
Энтропия динамической системы — в
теории динамических систем мера
хаотичности в поведении траекторий
системы.Энтропия отражения — часть
информации о дискретной системе, которая
не воспроизводится при отражении системы
через совокупность своих частей.Энтропия
в теории управления — мера неопределённости
состояния или поведения системы в данных
условиях.Энтропия — функция состояния
системы, равная в равновесном процессе
количеству теплоты, сообщённой системе
или отведённой от системы, отнесённому
к термодинамической температуре
системы.Энтропия — функция, устанавливающая
связь между макро- и микро- состояниями;
единственная функция в физике, которая
показывает направленность процессов.
Энтропия — функция состояния системы,
которая не зависит от перехода из одного
состояния в другое, а зависит только от
начального и конечного положения
системы.
Второе
начало термодинамики — физический
принцип, накладывающий ограничение на
направление процессов передачи тепла
между телами.Второе начало термодинамики
гласит, что невозможен самопроизвольный
переход тепла от тела, менее нагретого,
к телу, более нагретому.Второеначало
термодинамики запрещает так называемые
вечные двигатели второго рода, показывая
что коэффициентполезного действия не
может равняться единице, поскольку для
кругового процесса температура
холодильника не может равняться
абсолютному нулю.Второе начало
термодинамики является постулатом, не
доказываемым в рамках термодинамики.
Оно было создано на основе обобщения
опытных фактов и получило многочисленные
экспериментальные подтверждения.
Цикл
Карно́ — идеальный термодинамический
цикл. Тепловая машина Карно, работающая
по этому циклу, обладает максимальным
КПД из всех машин, у которых максимальная
и минимальная температуры осуществляемого
цикла совпадают соответственно с
максимальной и минимальной температурами
цикла Карно. Состоит из 2 адиабатических
и 2 изотермических процессов.цикл Карно
назван в честь французского военного
инженера Сади Карно, который впервые
его исследовал в 1824 году.Одним из важных
свойств цикла Карно является его
обратимость: он может быть проведён как
в прямом, так и в обратном направлении,
при этом энтропия адиабатически
изолированной (без теплообмена с
окружающей средой) системы не меняется.
Описание
цикла Карно Пусть тепловая машина
состоит из нагревателя с температурой
где
Q
— приращение энтропии;
—
минимальная теплота, подведенная к
системе; T — абсолютная температура
процеса Употребление в различных
дисциплинахТермодинамическая энтропия
— термодинамическая функция,
характеризующая меру неупорядоченности
термодинамической системы, то есть
неоднородность расположения и движения
её частиц.Информационная энтропия —
мера неопределённости источника
сообщений, определяемая вероятностями
появления тех или иных символов при их
передаче.Дифференциальная энтропия —
энтропия для непрерывных распределений
Энтропия динамической системы — в
теории динамических систем мера
хаотичности в поведении траекторий
системы.Энтропия отражения — часть
информации о дискретной системе, которая
не воспроизводится при отражении системы
через совокупность своих частей.Энтропия
в теории управления — мера неопределённости
состояния или поведения системы в данных
условиях.Энтропия — функция состояния
системы, равная в равновесном процессе
количеству теплоты, сообщённой системе
или отведённой от системы, отнесённому
к термодинамической температуре
системы.Энтропия — функция, устанавливающая
связь между макро- и микро- состояниями;
единственная функция в физике, которая
показывает направленность процессов.
Энтропия — функция состояния системы,
которая не зависит от перехода из одного
состояния в другое, а зависит только от
начального и конечного положения
системы.
Второе
начало термодинамики — физический
принцип, накладывающий ограничение на
направление процессов передачи тепла
между телами.Второе начало термодинамики
гласит, что невозможен самопроизвольный
переход тепла от тела, менее нагретого,
к телу, более нагретому.Второеначало
термодинамики запрещает так называемые
вечные двигатели второго рода, показывая
что коэффициентполезного действия не
может равняться единице, поскольку для
кругового процесса температура
холодильника не может равняться
абсолютному нулю.Второе начало
термодинамики является постулатом, не
доказываемым в рамках термодинамики.
Оно было создано на основе обобщения
опытных фактов и получило многочисленные
экспериментальные подтверждения.
Цикл
Карно́ — идеальный термодинамический
цикл. Тепловая машина Карно, работающая
по этому циклу, обладает максимальным
КПД из всех машин, у которых максимальная
и минимальная температуры осуществляемого
цикла совпадают соответственно с
максимальной и минимальной температурами
цикла Карно. Состоит из 2 адиабатических
и 2 изотермических процессов.цикл Карно
назван в честь французского военного
инженера Сади Карно, который впервые
его исследовал в 1824 году.Одним из важных
свойств цикла Карно является его
обратимость: он может быть проведён как
в прямом, так и в обратном направлении,
при этом энтропия адиабатически
изолированной (без теплообмена с
окружающей средой) системы не меняется.
Описание
цикла Карно Пусть тепловая машина
состоит из нагревателя с температурой![]() , холодильника с температурой и
, холодильника с температурой и
![]() рабочего тела.Цикл Карно состоит из
четырёх стадий:
рабочего тела.Цикл Карно состоит из
четырёх стадий:
Изотермическое расширение (на рисунке — процесс A→Б). В начале процесса рабочее тело имеет температуру , то есть температуру нагревателя. Затем тело приводится в контакт с нагревателем, который изотермически (при постоянной температуре) передаёт ему количество теплоты . При этом объём рабочего тела увеличивается.
Адиабатическое (изоэнтропическое) расширение (на рисунке — процесс Б→В). Рабочее тело отсоединяется от нагревателя и продолжает расширяться без теплообмена с окружающей средой. При этом его температура уменьшается до температуры холодильника.
Изотермическое сжатие (на рисунке — процесс В→Г). Рабочее тело, имеющее к тому времени температуру , приводится в контакт с холодильником и начинает изотермически сжиматься, отдавая холодильнику количество теплоты .
Адиабатическое
(изоэнтропическое) сжатие (на рисунке
— процесс Г→А). Рабочее тело отсоединяется
от холодильника и сжимается без
теплообмена с окружающей средой. При
этом его температура увеличивается до
температуры нагревателя.При изотермических
процессах температура остаётся
постоянной, при адиабатических отсутствует
теплообмен, а значит, сохраняется
энтропия:
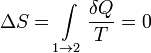 Поэтому
цикл Карно удобно представить в
координатах T и SПервая теорема (более
известна как формула Карно)
Поэтому
цикл Карно удобно представить в
координатах T и SПервая теорема (более
известна как формула Карно)
Пусть
дан произвольный треугольник ABC. Тогда
сумма алгебраических расстояний (англ.)
от центра описанной окружности D до
сторон треугольника ABC будет равна![]() , где r — радиус вписанной окружности,
а R — описанной. Знак расстояния
принимается отрицательным тогда и
только тогда, когда отрезок DX (X = F, G, H)
целиком лежит вне треугольника. В ее
доказательстве используется теорема
Птолемея. (температура и энтропия).
Вторая
теорема (известная также как критерий
Карно) Пусть дан треугольник АВС и точки
А1, В1, С1 на плоскости. Тогда перпендикуляры,
опущенные из А1, В1, С1 на AB, АС, ВС
соответственно, пересекаются в одной
точке тогда и только тогда, когда
, где r — радиус вписанной окружности,
а R — описанной. Знак расстояния
принимается отрицательным тогда и
только тогда, когда отрезок DX (X = F, G, H)
целиком лежит вне треугольника. В ее
доказательстве используется теорема
Птолемея. (температура и энтропия).
Вторая
теорема (известная также как критерий
Карно) Пусть дан треугольник АВС и точки
А1, В1, С1 на плоскости. Тогда перпендикуляры,
опущенные из А1, В1, С1 на AB, АС, ВС
соответственно, пересекаются в одной
точке тогда и только тогда, когда![]() Следствие
Перпендикуляры, опущенные из А1, В1, С1
на AB, АС, ВС соответственно, пересекаются
в одной точке тогда и только тогда, когда
перпендикуляры, опущенные из А, В, С на
В1С1, А1С1, В1С1 соответственно, пересекаются
в одной точке.
Термический
КПд Отношение работы, совершенной в
прямом обратимом термодинамическом
цикле, к теплоте, сообщенной рабочему
телу от внешних источников.
В
общем случае ηt = At/Q1 = (Q1 – Q2)/Q1,
где
At – тепло, преобразованное в цикле в
работу; Q1 – тепло, подведённое в цикле
к рабочему телу; Q2 – тепло, отданное в
цикле рабочим телом.
Термический
КПД термодинамического цикла показывает,
какое количество получаемой теплоты
машина превращает в работу в конкретных
условиях протекания идеального цикла.
Чем больше величина ηt, тем совершеннее
цикл и тепловая машина.В качестве
критерия оценки термодинамических
циклов часто используют цикл Карно,
потому что КПД тепловой машины Карно
максимален в том смысле, что никакая
тепловая машина с теми же температурами
нагревателя и холодильника не может
обладать бόльшим КПД [1]. Формула для
расчёта термического КПД данного цикла
общеизвестнаηt = (T1 – T2)/T1,где T1 – абсолютная
температура нагревателя; T2 – абсолютная
температура холодильника.
где
T1 – абсолютная температура нагревателя;
T2 – абсолютная температура холодильника.Из
анализа цикла Карно можно сделать
следующие выводы:КПД любого
термодинамического цикла тем больше,
чем больше разница температур нагревателя
T1 и холодильника T2;термический КПД
никогда не достигает 100 %, потому что
температура T2 в лучшем случае равна
температуре окружающей среды;Сегодня
наибольшая разница температур достигнута
в двигателях внутреннего сгорания,
благодаря высокой температуре рабочего
тела T1. Температура газов в цилиндре
поршневого ДВС достигает 2000 °C и более,
а в газовой турбине порядка 900 – 1300 °C,
что связано с необходимость обеспечить
жаропрочность лопаток турбины. Для
двигателей с внешним подводом теплоты
такие значения температур рабочего
тела остаются пока недостижимыми из-за
высокого термического сопротивления
на границе нагреватель-рабочее тело.
Температура пара в современных паровой
турбине или поршневом паровом двигателе
находится в диапазоне от 300 до 600 °C.Стоит
заметить, что высокий термический КПД
не служит гарантией высокого эффективного
КПД двигателя.
Следствие
Перпендикуляры, опущенные из А1, В1, С1
на AB, АС, ВС соответственно, пересекаются
в одной точке тогда и только тогда, когда
перпендикуляры, опущенные из А, В, С на
В1С1, А1С1, В1С1 соответственно, пересекаются
в одной точке.
Термический
КПд Отношение работы, совершенной в
прямом обратимом термодинамическом
цикле, к теплоте, сообщенной рабочему
телу от внешних источников.
В
общем случае ηt = At/Q1 = (Q1 – Q2)/Q1,
где
At – тепло, преобразованное в цикле в
работу; Q1 – тепло, подведённое в цикле
к рабочему телу; Q2 – тепло, отданное в
цикле рабочим телом.
Термический
КПД термодинамического цикла показывает,
какое количество получаемой теплоты
машина превращает в работу в конкретных
условиях протекания идеального цикла.
Чем больше величина ηt, тем совершеннее
цикл и тепловая машина.В качестве
критерия оценки термодинамических
циклов часто используют цикл Карно,
потому что КПД тепловой машины Карно
максимален в том смысле, что никакая
тепловая машина с теми же температурами
нагревателя и холодильника не может
обладать бόльшим КПД [1]. Формула для
расчёта термического КПД данного цикла
общеизвестнаηt = (T1 – T2)/T1,где T1 – абсолютная
температура нагревателя; T2 – абсолютная
температура холодильника.
где
T1 – абсолютная температура нагревателя;
T2 – абсолютная температура холодильника.Из
анализа цикла Карно можно сделать
следующие выводы:КПД любого
термодинамического цикла тем больше,
чем больше разница температур нагревателя
T1 и холодильника T2;термический КПД
никогда не достигает 100 %, потому что
температура T2 в лучшем случае равна
температуре окружающей среды;Сегодня
наибольшая разница температур достигнута
в двигателях внутреннего сгорания,
благодаря высокой температуре рабочего
тела T1. Температура газов в цилиндре
поршневого ДВС достигает 2000 °C и более,
а в газовой турбине порядка 900 – 1300 °C,
что связано с необходимость обеспечить
жаропрочность лопаток турбины. Для
двигателей с внешним подводом теплоты
такие значения температур рабочего
тела остаются пока недостижимыми из-за
высокого термического сопротивления
на границе нагреватель-рабочее тело.
Температура пара в современных паровой
турбине или поршневом паровом двигателе
находится в диапазоне от 300 до 600 °C.Стоит
заметить, что высокий термический КПД
не служит гарантией высокого эффективного
КПД двигателя.
