
- •По курсу общей физики молекулярная физика термодинамика
- •Введение
- •1. Статистический и термодинамический методы исследования вещества.
- •Тема 1. Основы молекулярно-кинетической теории газов
- •2. Идеальный газ. Параметры состояния идеального газа.
- •3. Основное уравнение кинетической теории газов.
- •4. Средняя кинетическая энергия поступательного движения молекул. Температура. Закон Дальтона.
- •5. Газовые законы. Уравнение Менделеева-Клапейрона.
- •6. Распределение скоростей молекул по Максвеллу.
- •7. Идеальный газ в силовом поле. Барометрическая формула. Закон распределения Больцмана.
- •8. Распределение энергии по степеням свободы.
- •Решение задач по теме 1. Примеры решения задач.
- •Задачи для самостоятельного решения.
- •Тема 2. Явления переноса в газах
- •9. Понятия о явлениях переноса. Средняя длина свободного пробега, эффективный диаметр молекул.
- •10. Диффузия.
- •11. Вязкость (внутреннее трение). Теплопрводность.
- •Тема 3.Основы термодинамики
- •12. Основные термодинамические понятия. Внутренняя энергия термодинамической системы.
- •13. Первое начало термодинамики. Работа, совершаемая газом при изменениях объема.
- •14. Теплоемкость газов. Уравнение Майера. Теплоемкость идеального двухатомного газа.
- •15. Первое начало термодинамики в изопроцессах.
- •16. Адиабатный процесс.
- •17. Круговой процесс. Тепловая машина.
- •18. Второе начало термодинамики. Обратимые и необратимые процессы.
- •19. Цикл Карно.
- •20. Энтропия. Приведенная теплота.
- •21. Изменение энтропии при некоторых процессах.
- •Решение задач по теме 3.
- •Задачи для самостоятельного решения.
- •Тема 4. Реальные газы и жидкости
- •22. Реальные газы. Уравнение Ван-дер-Ваальса.
- •23. Внутренняя энергия реального газа.
- •24. Свойства жидкого состояния вещества.
- •25. Поверхностный слой. Поверхностная энергия. Поверхностное натяжение.
- •26. Явления на границе жидкости и твердого тела.
- •27. Давление под искривленной поверхностью жидкости. Капиллярность.
- •28. Равновесие фаз. Фазовые переходы. Диаграмма состояния.
- •Решение задач по теме 4.
- •Задачи.
- •Ответы.
- •Оглавление.
Тема 1. Основы молекулярно-кинетической теории газов
2. Идеальный газ. Параметры состояния идеального газа.
Примером простейшей системы, изучаемой в молекулярной физике, является газ. Согласно статистическому подходу газы рассматриваются как системы, состоящие из очень большого числа частиц (до 1026м3), находящихся в постоянном беспорядочном движении.
В молекулярно-кинетической теории пользуются идеализированной моделью идеального газа, согласно которой считают, что:
1) собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда;
2) между молекулами газа отсутствуют силы взаимодействия;
3) столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
Оценим
расстояния между молекулами в газе. При
нормальных условиях (н.у.) число молекул
в единице объема:
![]() .
Тогда средний объем, приходящийся на
одну молекулу:
.
Тогда средний объем, приходящийся на
одну молекулу:
![]() .
Среднее расстояние между молекулами:
.
Среднее расстояние между молекулами:
![]() Средний диаметр молекулы: d3.10-10
м.
Собственные размеры молекулы малы по
сравнению с расстоянием между ними (в
10 раз). Следовательно частицы (молекулы)
настолько малы, что их можно уподобить
материальным точкам.
Средний диаметр молекулы: d3.10-10
м.
Собственные размеры молекулы малы по
сравнению с расстоянием между ними (в
10 раз). Следовательно частицы (молекулы)
настолько малы, что их можно уподобить
материальным точкам.
В газе молекулы большую часть времени находятся так далеко друг от друга, что силы взаимодействия между ними практически равны нулю. Можно считать, что кинетическая энергия молекул газа много больше потенциальной, поэтому последней можно пренебречь.
Скорости частиц как по модулю, так и по направлению могут быть любыми, изменение их происходит непрерывно.
Модель идеального газа можно использовать при изучении реальных газов, так как они в условиях, близких к нормальным (например, кислород водород, азот, углекислый газ, пары воды, гелий), а также при низких давлениях и высоких температурах близки по своим свойствам к идеальному газу. Кроме того, внеся поправки, учитывающие собственный объем молекул газа и действующие молекулярные силы, можно перейти к теории реальных газов.
В молекулярной физике и термодинамике состояние газа характеризуется совокупностью трех макропараметров р, V, Т , которые называются параметрами состояния.
Температура — одно из основных понятий, играющих важную роль не только в термодинамике, но и в физике в целом. Температура — физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы. В соответствии с решением XI Генеральной конференции по мерам и весам (1960) в настоящее время можно применять только две температурные шкалы — термодинамическую и Международную практическую, градуированные соответственно в кельвинах (К) и в градусах Цельсия (°С). В Международной практической шкале температура замерзания и кипения воды при давлении 1,013'10s Па соответственно О и 100°С (репервые точки).
Давление в системе СИ измеряется в Па (паскаль): 1Н/м2=1 Па. Часто пользуются и внесистемными единицами давления: 1 мм рт. ст.=133,3 Па; техническая атмосфера 1 ат=750 мм рт. ст. 105Па; нормальная (физическая) атмосфера: 1атм=760мм рт.ст.1,013. 105Па.
3. Основное уравнение кинетической теории газов.
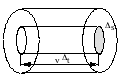
Рассмотрим одноатомный идеальный газ. Предположим, что молекулы газа движутся хаотически, число взаимных столкновений между молекулами газа очень мало по сравнению с числом ударов о стенки сосуда, а соударения молекул со стенками сосуда абсолютно упругие. Выделим на стенке сосуда элементарную площадку s (cм. рис.) и вычислим давление, оказываемое на эту площадку. При каждом соударении, молекула, движущаяся перпендикулярно площадке, передает ей импульс т0 v–(–m0 v) = 2 т0 v, где т0 — масса молекулы, v – ее скорость. За время t площадки s достигнут только те молекулы, которые заключены в объеме цилиндра с основанием s и высотой vt. Число этих молекул равно ns vt, где п — концентрация молекул. Но необходимо учитывать, что реально молекулы движутся к площадке под разными углами и имеют различные скорости.
Для
упрощения расчетов хаотическое движение
молекул заменяют движением вдоль трех
взаимно перпендикулярных направлений,
тик что в любой момент времени вдоль
каждого из них движется 1/3 молекул,
причем половина из них (1/6) движется
вдоль данного направления в одну сторону,
половина — в противоположную. Тогда
число ударов молекул, движущихся в
заданном направлении, о площадку s
будет
![]() .
При столкновении с площадкой эти молекулы
передадут ей импульс:
.
При столкновении с площадкой эти молекулы
передадут ей импульс:
![]()
![]() .
.
Тогда
давление газа на стенку сосуда:![]() (1)
(1)
Если газ и объеме V содержит N молекул, движущихся со скоростями v1, v2., то учитывают среднюю квадратичную скорость:
![]() (2)
(2)
характеризующую
всю совокупность молекул газа. Уравнение
(1) с учетом (2) примет вид
![]() .
(3)
.
(3)
Данное выражение называется основным уравнением молекулярно-кинетической теории идеальных газов. Это уравнение как раз и устанавливает связь между давлением и скоростью, вернее среднеквадратичной скоростью.
Введем
E![]() – среднюю кинетическую энергию
хаотического поступательного движения
одной молекулы, тогда основное уравнение
запишется как:
– среднюю кинетическую энергию
хаотического поступательного движения
одной молекулы, тогда основное уравнение
запишется как:
![]() или
или
![]() E
E
В данном уравнении давление связано со средней энергией поступательного движения молекул. Давление газа численно равно 2/3 средней кинетической энергии поступательного движения молекул, содержащихся в единице объема.
