
- •По курсу общей физики молекулярная физика термодинамика
- •Введение
- •1. Статистический и термодинамический методы исследования вещества.
- •Тема 1. Основы молекулярно-кинетической теории газов
- •2. Идеальный газ. Параметры состояния идеального газа.
- •3. Основное уравнение кинетической теории газов.
- •4. Средняя кинетическая энергия поступательного движения молекул. Температура. Закон Дальтона.
- •5. Газовые законы. Уравнение Менделеева-Клапейрона.
- •6. Распределение скоростей молекул по Максвеллу.
- •7. Идеальный газ в силовом поле. Барометрическая формула. Закон распределения Больцмана.
- •8. Распределение энергии по степеням свободы.
- •Решение задач по теме 1. Примеры решения задач.
- •Задачи для самостоятельного решения.
- •Тема 2. Явления переноса в газах
- •9. Понятия о явлениях переноса. Средняя длина свободного пробега, эффективный диаметр молекул.
- •10. Диффузия.
- •11. Вязкость (внутреннее трение). Теплопрводность.
- •Тема 3.Основы термодинамики
- •12. Основные термодинамические понятия. Внутренняя энергия термодинамической системы.
- •13. Первое начало термодинамики. Работа, совершаемая газом при изменениях объема.
- •14. Теплоемкость газов. Уравнение Майера. Теплоемкость идеального двухатомного газа.
- •15. Первое начало термодинамики в изопроцессах.
- •16. Адиабатный процесс.
- •17. Круговой процесс. Тепловая машина.
- •18. Второе начало термодинамики. Обратимые и необратимые процессы.
- •19. Цикл Карно.
- •20. Энтропия. Приведенная теплота.
- •21. Изменение энтропии при некоторых процессах.
- •Решение задач по теме 3.
- •Задачи для самостоятельного решения.
- •Тема 4. Реальные газы и жидкости
- •22. Реальные газы. Уравнение Ван-дер-Ваальса.
- •23. Внутренняя энергия реального газа.
- •24. Свойства жидкого состояния вещества.
- •25. Поверхностный слой. Поверхностная энергия. Поверхностное натяжение.
- •26. Явления на границе жидкости и твердого тела.
- •27. Давление под искривленной поверхностью жидкости. Капиллярность.
- •28. Равновесие фаз. Фазовые переходы. Диаграмма состояния.
- •Решение задач по теме 4.
- •Задачи.
- •Ответы.
- •Оглавление.
7. Идеальный газ в силовом поле. Барометрическая формула. Закон распределения Больцмана.
При выводе основного уравнения молекулярно-кинетической теории газов предполагалось, что на молекулы газа внешние силы не действуют, поэтому молекулы равномерно распределены по объему. Если гав находится в силовом поле, то существуют силы, которые сообщают хаотически движущимся молекулам направленное движение.
Молекулы газа, находящиеся в поле тяготения, участвуют в тепловом движении и испытывают действие силы тяжести. Тяготение и тепловое движение приводят к состоянию газа, при котором наблюдается убыль концентрации и давления газа с возрастанием высоты над землей.
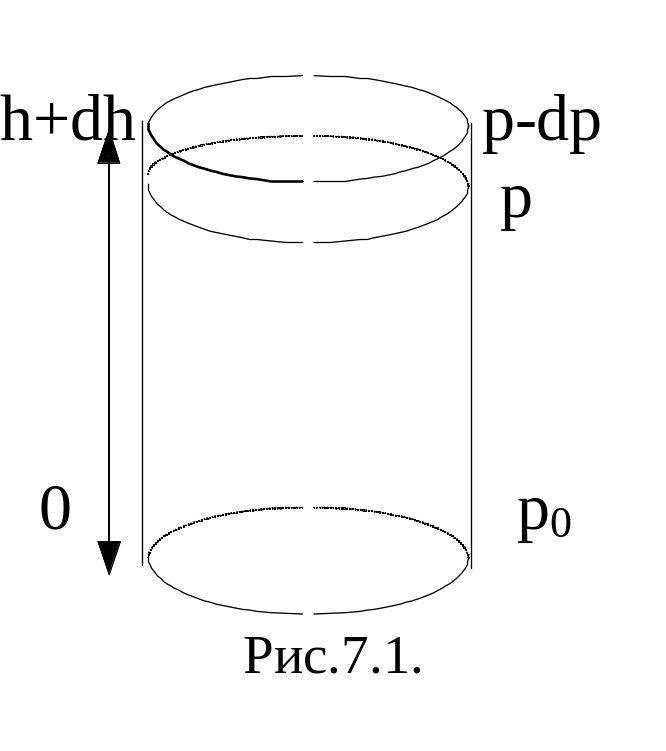
Атмосферное
давление на некоторую площадку S
обусловлено весом столба воздуха над
этой площадкой (т.е. действием силы
тяжести). Пусть на высоте h – давление
р, а при h=0 – p=p0.
Рассмотрим изменение давления элемента
“столба” высотой dh,
в пределах которого концентрацию можно
считать постоянной. Убыль давления в
пределах dh:
![]() .
.
Но
,
или
![]() ,
поэтому:
,
поэтому:
![]() .
.
Произведя
разделение переменных:
![]() ,
получим
,
получим
![]() .
.
Если
учесть, что
![]() ,
тогда
,
тогда
![]() .
.
Зависимость давления атмосферы от высоты над уровнем моря при постоянной температуре называют барометрической формулой.
Пользуясь
барометрической формулой
![]() ,
можно получить закон изменения
концентрации с высотой. Приняв во
внимание
,
можно получить закон изменения
концентрации с высотой. Приняв во
внимание
![]() и
и
![]() ,
где n
и n0
– концентрация молекул на высоте h и
h0=0
и подставляя р и р0
в барометрическую формулу, получим
закон распределения концентраций по
высоте:
,
где n
и n0
– концентрация молекул на высоте h и
h0=0
и подставляя р и р0
в барометрическую формулу, получим
закон распределения концентраций по
высоте:
![]() ,
,
Полученное
распределение Больцмана справедливо
для поля тяготения, для которого
![]() –
потенциальная энергия на высоте h
(на
разной высоте молекула обладает различным
запасом потенциальной энергии). Однако
оно справедливо и для идеального газа,
находящегося в любом другом потенциальном
поле:
–
потенциальная энергия на высоте h
(на
разной высоте молекула обладает различным
запасом потенциальной энергии). Однако
оно справедливо и для идеального газа,
находящегося в любом другом потенциальном
поле:
![]()
распределение Больцмана в поле с потенциальной энергией U .
При Т , nn0, то есть происходит выравнивание концентрации газа по всему объему, занимаемому газом. При Т 0, n 0, то есть все молекулы опустятся на поверхность Земли (если речь идет об атмосфере).
8. Распределение энергии по степеням свободы.
Средняя
энергия (из вывода основного уравнения
кинетической теории газов), приходящаяся
на одну молекулу E
![]() .
Если считать молекулу шариком (как в
одноатомном газе), то средняя энергия
такой частицы определяется средней
кинетической энергией ее поступательного
движения. Энергию эту можно представить
как сумму трех слагаемых – кинетических
энергий движения молекулы по трем
взаимно перпендикулярным направлениям:
.
Если считать молекулу шариком (как в
одноатомном газе), то средняя энергия
такой частицы определяется средней
кинетической энергией ее поступательного
движения. Энергию эту можно представить
как сумму трех слагаемых – кинетических
энергий движения молекулы по трем
взаимно перпендикулярным направлениям:
![]() ,
,
где vx, vy, vz – составляющие скорости молекул по трем осям координат. Из-за хаотичности молекулярного движения можно считать, что средние значения кинетических энергий по трем направлениям равны друг другу:
![]() .
(*)
.
(*)
Так как согласно основному уравнению кинетической теории
![]() ,
,
то каждое из трех слагаемых равенства (*) равно kT/2.
Разделение кинетической энергии частицы на три независимые составляющие связано с тем, что частица рассматривается как свободная материальная точка, обладающая тремя степенями свободы.
Число степеней свободы - наименьшее число линейно независимых координат, которые полностью определяют положение тела в пространстве. Значит, на каждую степень свободы одноатомной молекулы приходится энергия, равная kT/2.
Естественно было предположить, что если бы молекула газа обладала еще какими-нибудь степенями свободы, то и на каждую их них пришлась бы кинетическая энергия kT/2. Действительно, в классической статистической физике такая теорема доказывается (Больцман):
в совокупности большого числа молекул, находящемся в тепловом равновесии при температуре Т средняя кинетическая энергия равномерно распределена между всеми степенями свободы и для каждой степени свободы молекулы она равна kT/2.
Эта теорема называется законом равномерного распределения кинетической энергии по степеням свободы, или, законом равнораспределения.
Двух- и многоатомные газы отличаются от одноатомных числом степеней свободы.
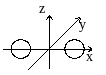
Вообще говоря, такая система имеет шесть степеней свободы: три степени свободы приходится на поступательное движение центра масс, и три – возможные вращательные движения вокруг осей 0х, 0у и 0z. Однако, вращение молекулы вокруг оси 0х не вносит изменения в кинетическую энергию. Поэтому для описания возможных вращений достаточно двух координат. Следовательно, число степеней свободы жесткой двухатомной молекулы равно 5, из них три поступательные и две вращательные степени свободы. Но атомы в молекуле не всегда жестко связаны друг с другом. Об этом мы подробнее поговорим при изучении теплоемкости идеального газа. Трехатомный газ имеет 6 степеней свободы.
Если молекула состоит из n атомов, не жестко связанных, то она имеет 3n степеней свободы (каждый атом имеет три степени свободы). Из этого числа три степени свободы поступательные и три вращательные, за исключением случая, когда атомы расположены на одной прямой, – тогда вращательных степени свободы только две. Остальные 3n-6 степени свободы являются колебательными.
