
- •Выбор области спектра
- •Электрохимические методы Классификация электрохимических методов анализа
- •Электрические параметры химической системы
- •Электрогравиметрия
- •Два варианта электрогравиметрического метода
- •2 Способа внутреннего электролиза:
- •Полярография
- •Полярографический метод основан на явлениях концентрационной поляризации на капельном ртутном электроде, возникающих при прохождении электрического тока через раствор электролита
- •Концентрационная поляризация - связана с уменьшением концентрации восстанавливающихся ионов в прикатодном слое в процессе электролиза
- •Полярографические токи
- •Формула Ильковича
- •Потенциометрический анализ
Электрогравиметрия
Электрогравиметрия основана на применении электрохимических реакций, протекающих в растворах электролитов под действием постоянного электрического тока и приводящих к восстановлению ионов Ме на катоде, т.е. выделению Ме в химически чистом виде.
Если проводить электролиз соли с предварительно взвешенным катодом, то по разности массы электрода до и после электролиза определяют массу выделившегося на электроде Ме. Иногда в процессе электролиза получают оксид Ме (PbO2, MnO2) или химического соединения (AgCl), что является следствием окислительных процессов на аноде.
Чем меньше потенциал пары Men+/Me, тем труднее при прочих равных условиях разряжаются ионы Ме.
Величина потенциала зависит от концентрации: чем больше концентрация, тем легче разряд ионов; чем меньше концентрация, тем труднее разряд ионов. (Поэтому при электролизе раствора, содержащего ионы нескольких Ме, может случиться, что выделение более активного Ме произойдет раньше, чем менее активного, если концентрация ионов первого Ме значительна, а второго – очень мала).
I-, Br-, Cl-, OH-, NO3-, CO32-, SO42-

Возрастание восстановительной способности анионов
Закон Фарадея
Количество выделившегося (или разложившегося) при электролизе вещества прямо пропорционально количеству электричества, прошедшего через раствор.
m=I*t*q,
где I - сила тока;
t – время, с;
q – электрохимический эквивалент q=Э/F=А/(n*F) [г/(А*ч)], соответствует количеству вещества, выделяемого на катоде при прохождении через электролит единицы количества электричества;
F – число Фарадея F=96500 Кл/моль – заряд одного моля; F=26,8А*час
Принцип электроанализа
В анализируемый раствор помещают пару электродов и присоединяют их к внешнему источнику напряжения. При этом происходит поляризация электродов, приводящая к возникновению Э.Д.С. поляризации, действующей противоположно прилагаемой Э.Д.С.
Минимальное значение напряжения, которое будет достаточно для электролитического разложения данного электролита, называется напряжением разложения и равно разности равновесных потенциалов анода и катода.
С учетом перенапряжения для нормального протекания электролиза необходимо приложить напряжение, равное:
Е = (Еа +ηа) – (Ек + ηк),
где ηа, ηк – перенапряжение на аноде и катоде.
Перенапряжение при электролизе зависит от:
Плотности тока: чем больше плотность тока, тем больше перенапряжение.
Состояния поверхности электрода: на гладком электроде перенапряжение больше, чем на шероховатом, так как при одинаковой силе тока плотность тока, приходящаяся на единицу поверхности гладкого электрода, больше.
Температуры: повышение температуры уменьшает перенапряжение
Природы электрода и различных примесей в растворе.
Два варианта электрогравиметрического метода
с наложением тока извне
без наложения тока извне (внутренний электролиз: выделение Ме происходит внутри гальванического элемента без внешнего источника тока).
2 Способа внутреннего электролиза:
с диафрагмой (катодное пространство заполняют исследуемым раствором, а анодное – каким-либо электролитом. Для разделения применяют керамические диафрагмы.) Для анализа концентрированных растворов.
без диафрагмы ( без разделения анодного и катодного пространства ). Пригоден для выделения небольших количеств примесей.
Условия электролиза должны быть выбраны так, чтобы происходило выделение только одного Ме, а не смеси металлов, и чтобы обеспечить 100%-ный выход по току.
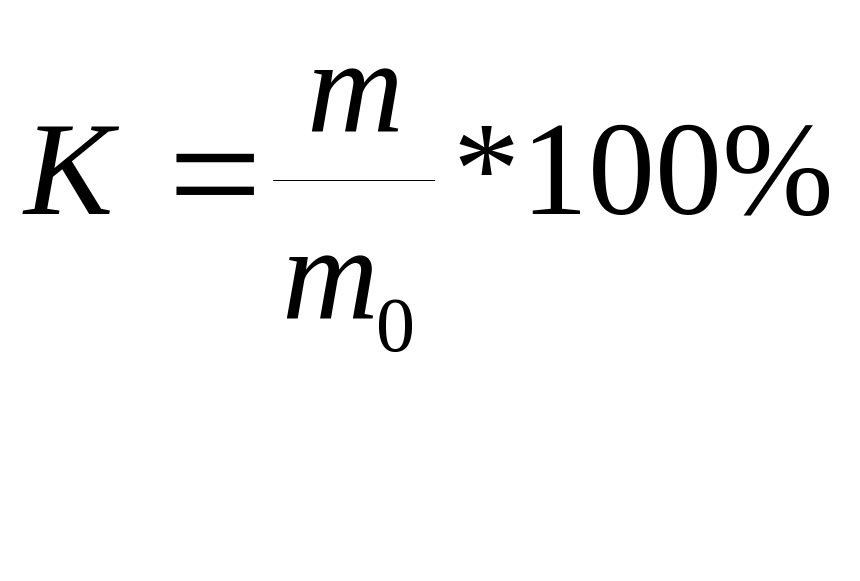
Выход по току – отношение количества вещества, реально полученного при электролизе (m), к тому количеству, которое должно было бы получиться в соответствии с законами Фарадея (m0) , если бы электричество не расходовалось на побочные процессы.
Кулонометрия
Кулонометрия - электрохимический метод основан на измерении количества электричества, необходимого для превращения анализируемого вещества в ходе его электролитического восстановления или окисления, при условии 100%-ного выхода по току.
Измерив количество электричества, израсходованного за время протекания реакции до полного разложения реагирующего вещества, можно определить содержание этого вещества по закону Фарадея.
m=I*t*q,
Электролиз:
1. при контролируемом потенциале – потенциостатическая кулонометрия
2. при контролируемой силе тока – (прямой электролиз- амперостатическая кулонометрия; косвенный электролиз – кулонометрическое титрование).
Потенциостатическая кулонометрия
Значение потенциала рабочего электрода (РЭ – расположен в электродном пространстве, содержащем определяемое вещество), которое надо задать для определения интересующего вещества, можно установить по уравнению Нернста
![]()
Область применения:
Во всех случаях, когда применим электрогравиметрический способ при контролируемом потенциале катода, но не требуется взвешивать продукт реакции.
когда образуется осадок, не пригодный для взвешивания или его нет (например, при определение Fe по реакции Fe2+-e-→Fe3+ или As по реакции
H3AsO3 - 2e-→H3AsO4)
Для определения органических веществ
Удобно применять для определения миллиграммовых количеств (5 – 200мг)
Для непрерывного автоматического анализа газа или жидкости (например, определение О2 в газе от 10-4 – 1%)
На Ag катоде:
О2 + 2Н2О +4 е- → 4 ОН-
На Cd аноде:
Cd0-2 е-→ Cd2+
Ag – Cd дают гальванический элемент, ток которого пропорционален СО2; поэтому можно определить СО2 через ΔU на калиброванном сопротивлении.
Ошибка определения 0,01 – 3% и зависит более от применяемой аппаратуры и квалификации исполнителя, чем от интервала концентраций.
Метод полностью документален, так как требуется запись кривой изменения силы тока во времени.
Амперостатическая кулонометрия
Если через электрохимическую ячейку пропускать ток постоянной силы, то потенциал рабочего электрода начнет смещаться до тех пор, пока не достигнет значения, при котором возможно протекание той или иной электродной реакции. Состав раствора подбирают таким образом, чтобы эта реакция отвечала электролизу определяемого вещества.
Для проведения электролиза в амперостатическом режиме с выходом, близким к 100%, надо вести электролиз при силе тока значительно меньшей Iпред.
Амперостатическая кулонометрия имеет ограниченное применение (для объектов, находящихся на электроде в виде твердой фазы – слои Ме, оксиды и т.д.)
Количество вещества находят по уравнению Фарадея из количества электричества, израсходованного на растворение.
Достоинства
Применим к анализу микро- и субмикроколичеств вещества;
Точность при определенном аппаратурном оформлении может быть доведена до 99,9%;
Метод быстрый (от минут до получаса);
Документален (записывается на диаграммную ленту)
Простота расчета количества электричества q=I*τ
Кулонометрическое титрование
Метод косвенного амперометрического титрования, при котором анализируемое вещество стехиометрически реагирует с продуктами электролиза.
Разница между классическим титриметрическим анализом и кулонометрическим титрованием состоит в том, что титрант в классическом методе вносится извне в виде раствора, а в кулонометрическом – генерируется непосредственно в титруемом растворе.
Например, с ионами Ag+ реагирует Cl-.
Или ионы Fe2+ частично окисляются по реакции Fe2+ -e-→Fe3+, частично по схеме: Се3+-е-→Се4+; Се4+ + Fe2+→Се3+ + Fe3+).
В процессе анализа сила тока постоянна, и расход электричества пропорционален времени анализа. При этом потенциал рабочего электрода возрастает. Точку эквивалентности определяют визуально, потенциометрически, амперометрически и т.д.
Аналогия:
Титр – сила тока
Титрант - ток
Хронометр – бюретка
Объем – время генерации реагента.
Преимущества:
Не надо готовить стандартные растворы (они вступают в реакцию в момент образования);
Можно очень точно дозировать малые количества «реагента»;
Можно легко в одной и той же аппаратуре генерировать титрант для осадительного, О-В, или кислотно – основного титрования;
Можно просто автоматизировать процесс.
Можно определять молярные и микромолярные концентрации
Ошибка определения составляет 0,1%
Скорость определения – несколько минут.
Кривая титрования может быть записана на диаграммной ленте.
Лекция 6
