
- •Выбор области спектра
- •Электрохимические методы Классификация электрохимических методов анализа
- •Электрические параметры химической системы
- •Электрогравиметрия
- •Два варианта электрогравиметрического метода
- •2 Способа внутреннего электролиза:
- •Полярография
- •Полярографический метод основан на явлениях концентрационной поляризации на капельном ртутном электроде, возникающих при прохождении электрического тока через раствор электролита
- •Концентрационная поляризация - связана с уменьшением концентрации восстанавливающихся ионов в прикатодном слое в процессе электролиза
- •Полярографические токи
- •Формула Ильковича
- •Потенциометрический анализ
Формула Ильковича
Id=605 n D1/2 m2/3 τ1/6 C
n -количество электронов, принимающих участие в процессе электровосстановления каждого иона;
D – коэффициент диффузии, см2/с;
m – количество ртути, вытекающей из капилляра в 1с, мг;
τ – время образования одной капли, с;
С - концентрация, моль/дм3.
Отсюда следует, что диффузионный ток зависит от используемого ртутного капилляра (m и τ), температуры (D).
При стандартизации условий полярографирования все величины в правой части равенства, исключая С, постоянны. Поэтому можно пользоваться уравнением
Id= К*С0
Миграционный ток не связан с концентрацией восстанавливающегося иона.
Полярографическая волна
Вольт – амперная кривая, рассчитывается по уравнению
![]()
г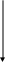
 де
Е – потенциал электрода, В;
де
Е – потенциал электрода, В;
Е 1/2
– потенциал полуволны, В;
1/2
– потенциал полуволны, В;
I – сила тока, мкА.

Качественный полярографический анализ
Основан на измерении величины потенциала полуволны восстанавливающегося иона.
Потенциалом полуволны называется потенциал середины полярографической волны. По своему физическому смыслу потенциал полуволны есть нормальный окислительно – восстановительный потенциал (определяется природой данной электрохимической системы).
Потенциал полуволны зависит от природы восстанавливающегося иона и среды раствора, но НЕ зависит от концентрации ионов.
Определив в процессе полярографии потенциалы полуволн ионов, находящихся в растворе, и сравнив их величины с табличными данными, можно установить, какие именно ионы находятся в растворе.
Количественный полярографический анализ
Концентрацию определяют по высоте полярографической волны (h), выраженной в мм. Высоту волны измеряют по графику.
Методы определения концентрации: сравнение с эталоном, метод стандартных серий, метод добавок. Во всех случаях зависимость h от С определяется графически или рассчитывается.
1. Сравнение с эталоном
![]()
2. Метод добавок
![]()
3. Метод калибровочного графика.
ПРАВИЛА:
Проводить измерения анализируемого и эталонного растворов при одинаковой температуре.
Состав и концентрация «фонов» анализируемого и эталонных растворов должны быть строго одинаковыми.
Для растворения навески желательно применять такие реактивы, чтобы в растворе содержались сульфаты, хлориды и соли хлорной кислоты.
Следует устранять образование коллоидных растворов.
Порядок выполнения: сухой остаток анализируемого образца растворить в небольшом объеме воды, перенести в мерную колбу, добавить «фон» и ПАВ, довести водой до метки; аликвотную часть полученного раствора поместить в электролизер, пропустить инертный газ и снять полярограмму.
Достоинства метода
В процессе капания ртути из капилляра поверхность катода все время чистая, так как постоянно обновляется вследствие удаления продуктов электролиза.
Восстановление ионов водорода на ртутном электроде происходит при более отрицательных потенциалах, чем на платиновом электроде, из-за очень высокого перенапряжения выделения водорода на ртути.
Позволяет определять в растворе ультрамалые количества ионов Ме , до 10-8 – 10-9 моль/дм3.
Быстрота, точность от 1 до 5% (отн) в интервале концентраций 10-2 – 10-5 моль/дм3.
Возможность определения веществ без их предварительного разделения
Можно определять почти все элементы системы Д.И. Менделеева. Используется на предприятиях цветной и черной металлургии, в ядерной технике и полупроводниковой промышленности, в биологии и медицине.
Амперометрическое титрование
В методе амперометрического титрования установление момента эквивалентности (Т.Э.) основано на измерении величины диффузионного тока, изменяющегося в процессе титрования.
Условие: одно из реагирующих веществ восстанавливается или окисляется на индикаторном (ртутном капельном или твердом) (микро)электроде и при выбранном постоянном потенциале для титрования величина предельного тока была бы пропорциональна концентрации, т.е.
I=К*С.
Необходимо предварительное полярографическое исследование реагирующих веществ.
В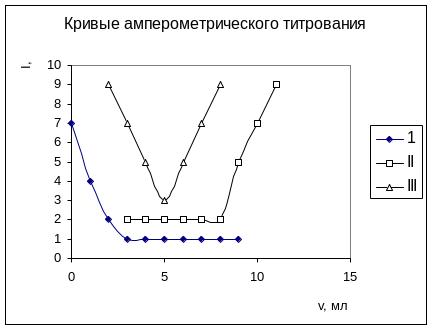 зависимости от электрохимического
поведения этих веществ на индикаторном
электроде и от выбранного для титрования
потенциала электрода могут получаться
различные по форме кривые титрования.
зависимости от электрохимического
поведения этих веществ на индикаторном
электроде и от выбранного для титрования
потенциала электрода могут получаться
различные по форме кривые титрования.
Е
 сли
реакция идет по схеме
сли
реакция идет по схеме
А + В = АВ
при восстановлении определяемого иона (кривую часто называют L-формой);
при восстановлении или окислении добавляемого реагента;
при одновременном восстановлении (окислении) определяемого вещества и реагента.
Преимущества:
Титрование можно проводить в мутных и ли окрашенных растворах;
Можно определять вещества, не дающие полярографическй волны, если полярографическую волну дает реагент;
Предел обнаружения 0,001 моль/дм3;
Нет необходимости подбирать индикатор, меняющий цвет в Т.Э. Роль индикатор выполняет величины диффузионного тока.
Изменение температуры и величины диффузионного тока не влияет на результаты титрования
простота аппаратуры.
В методе амперометрического титрования используются реакции осаждения, комплексообразования и ОВР.
