
- •Часть II. Частная патология
- •Раздел 3. Патология исполнительных систем и органов
- •Глава 22. Общие сведения о патологии
- •22.1. Введение
- •22.2. Классификация нарушений системы крови
- •22.3. Основные типовые формы патологии системы крови
- •Белой крови; 4) системы тромбоцитов, 5) системы гемостаза (свертывающей, противосвертывающей и фибринолитической систем крови). Эти расстройства могут быть как изолированными, так и сочетанными.
- •22.4. Особенности патологии системы крови
- •22.5. Нарушения объема крови и соотношения форменных элементов и плазмы крови
- •Глава 23. Патология системы красной крови
- •23.1. Качественные изменения эритроцитов крови
- •23.2. Количественные нарушения эритроцитов в крови
- •23.2.1. Эритроцитозы. Их виды и характеристика
- •Относительные эритроцитозы бывают гемоконцентрационными и перераспределительными.
- •23.2.2. Анемии. Классификация. Виды. Характеристика
- •Классификация анемий
- •Постгеморрагические анемии
- •Гемолитические анемии
- •Приобретенные га (экзоэритроцитарные)
- •Наследственные га (эндоэритроцитарные)
- •Анемии вследствие нарушения кровообразования ( дизэритропоэтические анемии)
- •Железодефицитные анемии
- •Гипо - и апластические анемии
- •23.3. Основные принципы терапии анемий
- •Глава 24. Патология системы белой крови Введение
- •Классификация патологии системы белой крови
- •Этиология нарушений системы белой крови
- •24.1. Качественные нарушения лейкоцитов крови
- •24.2. Количественные нарушения лейкоцитов в крови
- •24.2.1. Лейкоцитозы и их характеристика
- •Классификация лейкоцитозов
- •24.3. Характеристика основных клинических форм патологии системы белой крови
- •Агранулоцитоз
- •Лейкемоидные реакции
- •24.4. Принципы терапии заболеваний и синдромов системы белой крови
- •Глава 25. Гемобластозы
- •Общие нарушения при гемобластозах
- •25.1. Гематосаркомы и их характеристика
- •Лимфогранулематоз (болезнь Ходжкена)
- •Миеломная болезнь
- •25.2. Лейкозы и их характеристика
- •Патогенез лейкозов
- •25.2.1. Классификация лейкозов
- •Лейкемоидные реакции
- •25.2.2. Острые лейкозы. Характеристика. Принципы лечения
- •Отличие лейкемоидных реакций от лейкозов
- •Общая характеристика некоторых видов острых лейкозов
- •Клиническая картина разных видов острых лейкозов
- •Стадии развития острых лейкозов
- •Морфологическая анаплазия клеток крови при острых лейкозах
- •Принципы лечения острых лейкозов
- •25.2.3. Хронические лейкозы. Характеристика. Принципы лечения
- •Хронический миелолейкоз
- •Лечение хронического миелолейкоза
- •Хронический лимфолейкоз
- •Лечение хронического лимфолейкоза
- •Глава 26. Типовые формы и механизмы нарушений гемостаза
- •26.1. Гемостаза и основные его механизмы
- •26.1.1. Тромбоцитарно-сосудистый гемостаз
- •26.1.2. Коагуляционный гемостаз
- •Повреждение сосудистой стенки
- •26.1.3. Антикоагулянтная система крови
- •26.1.4. Фибринолитическая система крови
- •26.2. Тромбофилия и ее механизмы
- •26.2.1. Изменения тромбогенной и тромборезистентной активности сосудистой стенки
- •26.2.2. Повышение функциональной активности тромбоцитов и тромбоцитозы
- •26.2.3. Гиперкоагуляция и ее механизмы
- •26.2.3.1. Увеличение содержания прокоагулянтов в крови
- •26.2.3.2. Снижение антикоагулянтной активности крови
- •26.2.3.3. Угнетение фибринолиза
- •26.2.4. Гипокоагуляция и ее механизмы
- •26.2.4.1. Тромбоцитопении
- •26.2.4.2. Тромбоцитопатии
- •26.2.4.3. Дефицит плазменных прокоагулянтов
- •26.2.4.4. Повышение антикоагулянтной активности крови
- •26.2.4.5. Гиперфибринолиз
- •26.2.4.6. Основные типы кровоточивости
- •26.3. Синдром диссеминированного внутрисосудистого свертывания крови
- •26.3.1. Механизмы развития двс-синдрома
- •26.3.2. Хронический двс-синдром
- •26.4. Обследование больных с изменениями в системе гемостаза
- •26.5. Основные принципы терапии нарушений гемостаза
- •Лечение различных форм геморрагических синдромов
- •Глава 27. Патология сердечно-сосудистой системы. Недостаточность кровообращения. КОронарная недостаточность
- •27.2. Недостаточность кровообращения
- •3. По выраженности признаков недостаточности кровообращения:
- •27.3. Коронарная недостаточность
- •27.3.1. Виды КороНарной недостаточности
- •27.3.2. Причины Коронарной Недостаточности
- •27.3.3. Механизмы повреждения сердца при коронарной недостаточности
- •Расстройство процессов энергообеспечения кардиомиоцитов
- •Повреждение мембран и ферментов кардиомиоцитов
- •Дисбаланс ионов и жидкости в кардиомиоцитах
- •Расстройство механизмов регуляции работы сердца
- •Динамика изменений активности механизмов регуляции сердца
- •Эффекты постокклюзионной реперфузии миокарда
- •27.3.4.ИзменениЯ основных показателей функции сердца
- •27.3.5.Принципы терапии коронарной недостаточности
- •Глава 28. Сердечная недостаточность
- •28.1. Этиология Сердечной недостаточности
- •Факторы, непосредственно повреждающие сердце бывают:
- •Факторы, обусловливающие функциональную перегрузку сердца
- •28.2. Виды сердечной недостаточности
- •28.3. Общий патогенез развития
- •Механизмы компенсации сниженной сократительной функции сердца
- •Механизмы декомпенсации гипертрофированного сердца
- •Повреждение мембранного аппарата ферментных систем кардиомиоцитов
- •Нарушение содержания и соотношения между отдельными ионами внутри и вне клеток миокарда
- •Нарушения в генетической программе и/или механизмах её реализации
- •Расстройства нейрогуморальной регуляции сердца
- •28.4. Нарушения функций сердца и центральной гемодинамики при сердечной недостаточности
- •28.5. Принципы нормализации функциЙ сердца
- •Принципы, цели и группы фармакологических препаратов, применяемых для нормализации функции сердца при его недостаточности
- •Глава 29. Нарушения ритма сердца (аритмии) Введение
- •29.1. Виды аритмий. Их этиология и патогенез
- •29.1.1. Аритмии, возникающие в результате нарушений автоматизма
- •Виды аритмий, развивающихся в результате нарушений автоматизма
- •Изменения показателей гемодинамики при синусовых аритмиях
- •Изменения коронарного кровотока при синусовых аритмиях
- •Гетеротопные аритмии. Их характеристика
- •Нарушения системной гемодинамики при гетеротопных аритмиях
- •Нарушения коронарного кровотока при гетеротопных аритмиях
- •29.1.2. Аритмии, возникающие в результате нарушений проводимости
- •Характеристика основных расстройств проводимости
- •Расстройства гемодинамики при аритмиях в результате нарушения проведения электрического импульса
- •Расстройства коронарного кровотока при аритмиях в результате нарушения проведения возбуждения
- •29.1.3. Аритмии, возникающие в результате сочетанных нарушений возбудимости и проводимости
- •Повторная циркуляция возбуждения по замкнутому контуру
- •29.2. Принципы терапии нарушений ритма сердца
- •Глава 30. Нарушения системного уровня Артериального давления
- •Виды артериальных гипертензий (аг)
- •1) Нейрогенные:
- •5) Смешанные.
- •31.1.1. Характеристика основных видов артериальных гипертензий
- •Центрогенные аг
- •Причины центрогенных аг
- •Патогенез центрогенных аг
- •1) Аг, обусловленные нарушением высшей нервной деятельности (неврозом).
- •2) Аг, обусловленные органическими повреждениями структур мозга, участвующих в регуляции уровня ад.
- •Цереброишемическая гипертензия
- •Рефлекторные аг
- •«Условнорефлекторные» нейрогенные аг
- •Безусловнорефлекторные аг
- •1) Развивающиеся в результате хронического раздражения экстеро- и интерорецепторов, нервных стволов или центров.
- •2) Формирующиеся вследствие прекращения афферентной импульсации, оказывающей тормозящее («сдерживающее», «депрессорное») влияние на тоническую прессорную активность кардиовазомоторного центра.
- •Эндокринные аг
- •Аг при патологии надпочечников
- •Кортикостериоидные надпочечникоовые аг
- •Минералокортикоидные аг
- •Глюкокортикоидные аг
- •«Катехоламиновые» надпочечниковые аг
- •Аг при гипертиреоидных состояниях
- •Аг при расстройствах эндокринных функций гипоталамо-гипофизарной системы
- •Аг при гиперпродукция кортиколиберина (кл) и актг
- •Аг при других эндокринопатиях
- •Метаболические аг
- •Почечные аг
- •Вазоренальная аг
- •Ренопривная аг
- •Гипоксические аг
- •Гемические аг
- •Гипертоническая болезнь (эссенциальная гипертензия)
- •Общая этиология гб
- •Основные звенья патогенеза гб
- •Смешанные аг
- •Характеристика Местных аг
- •30.1.2. Принципы лечения артериальных гипертензий
- •30.2. Артериальные гипотензии
- •30.2.1. Характеристика основных видов хронических артериальных гипотензий
- •Нейрогенные центрогенные артериальные гипотензии
- •Артериальные гипотензии, обусловленные нарушением высшей нервной деятельности
- •Артериальные гипотензии, обусловленные органическими изменениями в центральных (диэнцефально-гипоталамических) и периферических структурах, участвующих в регуляции ад
- •Рефлекторные артериальные гипотензии
- •Эндокринные артериальные гипотензии
- •Артериальные гипотензии надпочечникового происхождения
- •Артериальные гипотензии при поражении гипофиза
- •Артериальная гипотензия при гипотиреоидных состояниях
- •Артериальные гипотензии, вызванные нарушением метаболизма веществ с гипо- и гипертензивным действием
- •30.2.2. Принципы лечения артериальных гипотензий
- •Глава 31. Патология лимфатической системы
- •31.1. Введение
- •31.2. Транспорт гуморов в организме
- •31.3. Образование тканевой жидкости
- •31.4. Внесосудистое звено гуморального транспота
- •31.5. Таможенная функция интерстиция
- •31.6. Лимфообразование. Механизмы нарушений
- •31.7. Недостаточность транспорта лимфы
- •31.8. Нарушения свертывемости лимфы
- •31.9. Лимфатический отек
- •31.10. Нарушения функций лимфатических узлов
- •31.11. Лимфатическая система при различных видах патологии
- •31.11.1. Влияние перегревания организма
- •31.11.2. Влияние переохлаждения организма
- •31.11.3. Роль лимфатической системы в патогенезе воспаления
- •31.11.4. Роль лимфатической системы в патогенезе атеросклероза
- •31.11.5. Роль лимфатической системы в патогенезе опухолевого процесса
- •31.12. Возможности управления функциями лимфатической системы
- •31.12.1. Эндолимфатическая терапия
- •31.12.2. Лечебные воздействия на интерстициальный гуморальный транспорт и лимфатический дренаж тканей
- •31.12.3. Воздействия на транспорт лимфы
- •31.12.4. Воздействия, санирующие лимфу («лимфосанация»)
- •31.13. Заключение
Анемии вследствие нарушения кровообразования ( дизэритропоэтические анемии)
По патогенезу нарушения эритропоэза выделяют следующие их разновидности: 1) дисрегуляторная , обусловленная количественным и качественным нарушением синтеза эритропоэтина (снижением продукции их стимуляторов и увеличением образования их ингибиторов), синтеза и активности ферментов, участвующих в образовании порфирина, гема и/или глобина;
2) дефицитная, развивающаяся из-за недостатка в организме неорганических и органических веществ, крайне необходимых для синтеза полноценных эритроцитов; 3) гипопластическая или апластическая, возникающая в результате угнетения красного ростка костного мозга вследствие либо его разрушения, либо его сдавления или замещения другой тканью.
ДЕФИЦИТНЫЕ АНЕМИИ
К ним относятся: а) железодефицитные (частота их развития составляет 80-95 %); б) В12-дефицитные; в) фолиево-дефицитные; г) белково-дефицит- ные; д) смешанные.
Железодефицитные анемии
Следует отметить, что в норме из 10-15 мг железа, поступающего в сутки с пищей организмом утилизируется только 1,2-1,5 мг.
Этиология. Железодефицитные анемии возникают в результате:
1) снижения поступления железа с пищей;
уменьшения всасывания железа через слизистую тонких кишок (главным образом в дуоденуме и верхней части тощей кишки) в результате:
а) дефицита или отсутствия соляной и других (аскорбиновой, лимонной и др.) кислот, приводящих в норме к превращению (восстановлению) оксидного железа (Fe3+ ) в закисное железо (Fe2+), которое в виде ферритина (как и гемоглобин, и миглобин) у здорового человека хорошо всасывается через слизистую кишечника,
б) повреждения микро- и макроворсинок слизистой кишки;
3) расстройств транспорта вновь окисленного в плазме крови железа в комплексе с трансферритином (-глобулином), что наблюдается при гипотрансферритикемии, наличии антител к трансферритину;
нарушения (снижения) депонирования железа в печени, костном мозгу и мышцах (в норме составляющего около 20% от циркулирующего в крови количества);
уменьшения утилизации железа тканями, особенно костным мозгом, что отмечается при инфекциях, интоксикациях, гепатитах, циррозе печени и др. (в норме составляющего около 80% циркулирующего в крови количества железа);
резкого повышения потребления железа тканями (при беременности, лактации, быстром росте тела);
потери железа организмом (в котором ведущая роль принадлежит массивным острым или небольшим, но хроническим кровопотерям).
Патогенез данной анемии представлен на схеме 23-2. Экзогенный или эндогенный дефицит железа характеризуется снижением его содержания в сыворотке крови, костном мозге и истощением резервов железа, что проявляется исчезновением гемосидерина (темно-желтого железосодержащего пигмента) в макрофагах печени и селезенки, снижением содержания сидеробластов в костномозговой ткани. В результате уменьшается синтез гемоглобина и пролиферативная активность ядерных эритроидных клеток. Дефицит железа отражается также на активности тканевого дыхания вследствие снижения уровня железосодержащих клеточных ферментов (цитохрома С, цитохромоксидазы, сукцинатдегидрогеназы, пероксидазы).
Клиническая картина. Развивается гипохромная (ЦП 0,86), микроцитарная анемия. Появляется много патологически измененных форм (пойкилоцитов и анизоцитов).
Развивающаяся не только гемическая, но и тканевая гипоксия при железодефицитных анемиях приводит к формированию атрофических и дистрофических процессов в тканях и органах. В наибольшей степени это проявляется в поражении слизистой пищеварительного тракта, тканей миокарда, печени и почек. Признаками дефицита железа в организме являются также специфические сидеропенические симптомы – сухость и вялость кожи, повышенная ломкость ногтей, выпадение волос, разрушение зубов, мышечная слабость, извращение вкуса, ночное недержание мочи.
После снижения запасов железа компенсаторно стимулируется как всасывание, так и синтез трансферрина, а также эритропоэз (увеличение числа более мелких эритроидных клеток в результате активизации продукции эритропоэтина).
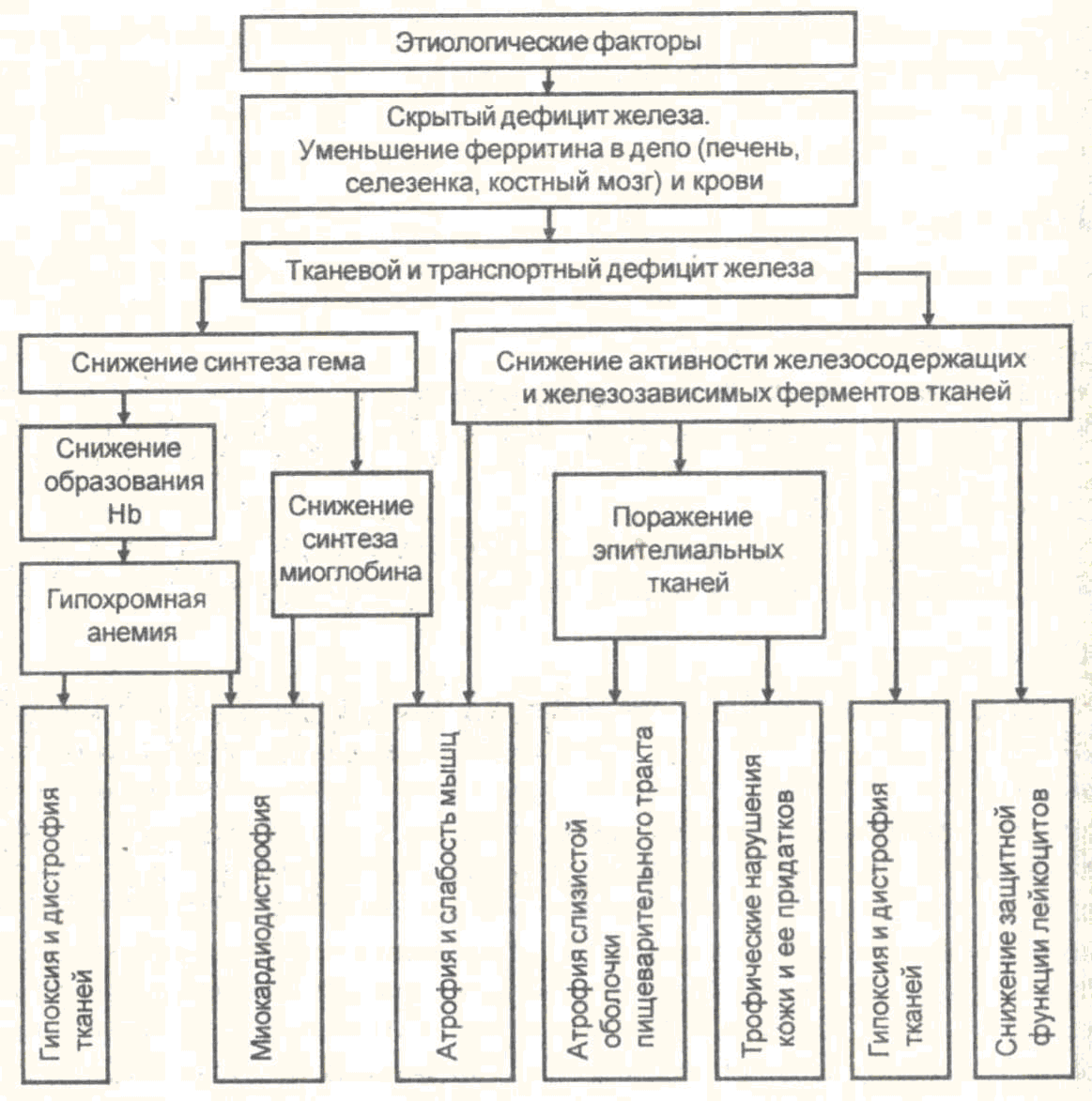
Схема 23-2. Патогенез железодефицитной анемии
(Окороков А.Н., 2001)
В12- и фолиеводефицитная анемия
Дефицит витамина В12 (внутреннего и внешнего фактора Кастла, цианокобаламина) и фолиевой (фолиновой) кислоты приводит к нарушению клеточного деления всех активно пролиферирующих клеток организма. Последнее связано со снижением синтеза пуриновых и пиримидиновых оснований, а следовательно - снижением синтеза нуклеиновых кислот (ДНК, РНК). На уровне системы крови развивается замена нормобластичеческого типа кроветворения мегалобластическим в сочетании с неэффективным миелопоэзом.
Этиология. Развитие абсолютного или относительного недостатка витамина В12 и фолиевой кислоты может определяться следующими факторами:
недостаточное поступление их с пищей (развивается только при продолжительном неполноценном питании, в том числе при вегетарианстве);
нарушение комплексирования витамина В12 с внутренним фактором Кастла (гастромукопротеином) в желудочно-кишечном тракте (особенно при дефиците внутреннего фактора Кастла, наблюдаемого при аутоиммунной агрессии, токсических, химических и термических поражениях, а также при врожденной недостаточности слизистой фундального отдела желудка или резекции желудка);
конкурентный расход витамина В12 (инвазия кишечника паразитами, повышенное потребление кишечными бактериями при их аномально интенсивном размножении);
нарушение чрезклеточного переноса витамина В12 (поражение слизистой тонких кишок, опухолевые процессы, интоксикации, дифиллоботриоз);
нарушение транспорта витамина В12 в крови и депонирования его в печени (при дефиците транспортного белка транскобаламина-2, относящегося к 1 -глобулинам; образование аутоантител, блокирование ферментных реакций, гепатиты, цирроз печени);
6) повышенная потребность в витамине В12 (быстрый рост организма, беременность, гипертиреоз, новообразования).
Патогенез. Дефицит витамина В12 и фолиевой кислоты приводит к снижению активности В12- зависимых энзимов, определяющих превращение фолиевой кислоты в ее коферментную форму тетрагидрофолиевую (фолиновую) кислоту, без которой невозможен синтез тимидина, входящего в состав ДНК. Это в основном и приводит к нарушению клеточного деления активно регенерирующих клеток кроветворной ткани. Развивается мегалобластический тип кроветворения, который характеризуется снижением числа митозов (нормо- бласт дает 3 митоза, мегалобласт – 1 митоз), удлинением времени митотического цикла, более ранним насыщением гемоглобином созревающих клеток эритроидного ряда, внутрикостномозговым разрушением мегалоцитов и укорочением (до 30-40 дней) продолжительности их жизни. Этиология и патогенез В12-дефицитной анемии представлены на схеме 23-3.
Клиническая картина. Формируется гиперхромная (ЦП1), мегалоцитарная анемия Аддисона-Бирмера, для которой характерны патологические включения в макроцитах (тельца Жолли, кольца Кебо, базофильная пунктация). При этом отмечается гиперсегментация ядер нейтрофилов и снижение в крови количества ретикулоцитов, лейкоцитов и тромбоцитов. Картина периферической крови представлена на схеме 23-5.
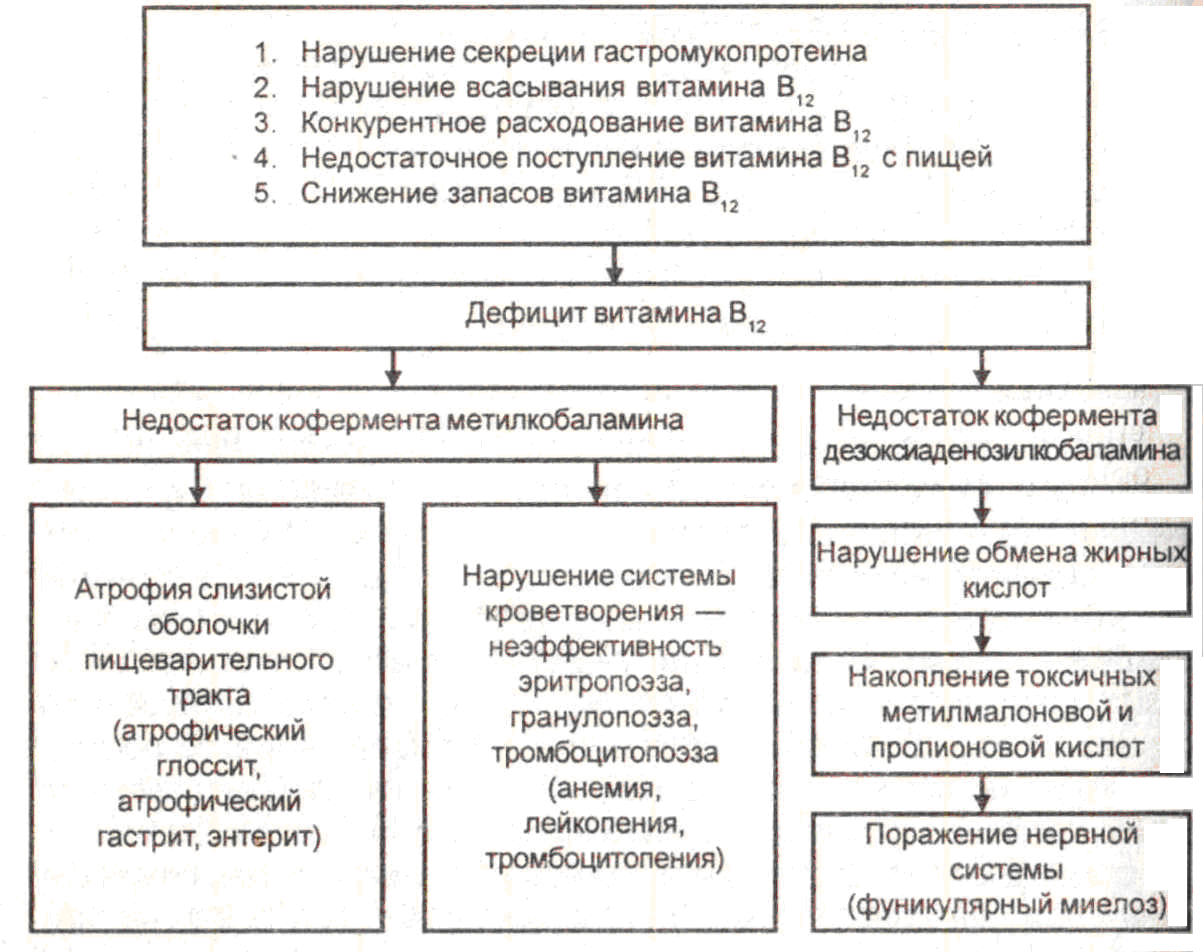
Схема 23-3. Этиология и патогенез В12-дефицитной анемии
(Окороков А.Н., 2001)
Изменения со стороны системы пищеварения проявляются в виде развития воспалительно-атрофических процессов в связи с нарушением регенерации эпителия слизистой пищевого канала (глоссит, стоматит, эзофагит, ахилический гастрит, энтерит).
Патология нервной системы (главным образом в виде дегенерации задних и боковых столбов спинного мозга – фуникулярного миелоза, а также поражений черепно-мозговых и периферических нервов) определяется тем, что при недостатке витамина В12 в тканях накапливаются пропионовая и метилмалоновая кислоты, которые являются токсичными для нервной ткани. При этом развиваются разнообразные неврологические симптомы – парестезии, дефицит моторики, расстройства глубокой чувствительности, болевой синдром и др.
