
- •Основные понятия и законы химии Основные понятии
- •Основные законы
- •Количественные характеристики вещества; законы, описывающие поведение газов; закон эквивалентов; простые и сложные вещества.
- •Закон простых объемных отношений
- •Количество вещества
- •Закон эквивалентов
- •3. Оксиды, строение, способы получения, химические свойства.
- •Химические свойства оксидов
- •Получение оксидов
- •Кислоты, строение, способы получения, химические свойства.
- •Химические свойства кислот
- •Основания, строение, способы получения, химические свойства.
- •Химические свойства оснований
- •Получение оснований
- •Различные виды солей, строение, способы получения, химические свойства.
- •Химические свойства средних солей
- •Способы получения средних солей
- •Получение кислых солей
- •Способы получения основных солей
- •7.Строение атома, состояние электронов в атоме и их квантово-механическое описание. Электронная конфигурация атомов и периодическая система.
- •Периодический закон
- •8.Изменение свойств элементов в периодах и главных подгруппах.
- •9.Общие представления и химической связи. Ковалентная связь и её характеристики. Ионная связь. Водородная связь
- •10.Энергетика химических процессов. Химическое равновесие. Тепловой эффект химической реакции. Внутренняя энергия. Энтальпия.
- •Тепловой эффект
- •Энтальпия
- •Термохимические расчеты.
- •13.Скорость и механизм химического процесса. Понятие о скорости и механизме химической реакции.
- •14.Факторы, влияющие на скорость реакции. Катализ.
- •15.Окислительно-восстановиельные реакции. Основные понятия и типы овр.
- •Характеристика овр
- •Типы овр
- •16.Электрохимические процессы.
- •17.Состав и виды растворов, способы количественного выражения состава растворов. Физические свойства разбавленных растворов. Водородный показатель.
- •Способы выражения состава растворов Способы выражения концентрации растворов
- •Молярная концентрация
- •Моляльная концентрация
- •18.Стандартные электродные потенциалы. Электрохимический ряд напряжения металлов.
- •19. Общая характеристика элементов главных подгрупп и их химические соединения.
- •Химические соединения
- •20. Общая характеристика электроположительных элементов.
- •Получение металлов из руд
- •20. Химические свойства элементов главных подгрупп.
Способы выражения состава растворов Способы выражения концентрации растворов
(стр 118 из Гаршина)
Единица измерения: моль/л
Обозначается
МАССОВАЯ ДОЛЯ растворённого
вещества
Единица измерения: доли, %

Показывает отношение массы
растворённого вещества к массе раствора
mр
=pV
m
= mр
- mв
(%)
= 100%

(%) =
100%
(%) =
100%
где mв- масса растворенного вещества; mр – масса раствора; m - масса воды; p – плотность, V – объем растовра
Молярная концентрация
МОЛЯРНАЯ КОНЦЕНТРАЦИЯ
растворённого вещества
Единица измерения: моль/л
С =
n
=
См
=
Обозначается С


Показывает отношение
количества растворённого вещества к
объему раствора
где n- количество растворенного вещества (моль);
V – объем раствора (л);
m- масса растворенного вещества (кг,г);
М – молярная масса растворенного вещества (кг/моль, г/моль)
1М = одномолярный раствор (в 1 л раствора содержится 1 моль растворенного вещества);
0,5М – полумолярный раствор;
0,1М – децимолярный раствор;
0,01М – сантимолярный раствор;
0,001М – миллимолярный раствор ( в 1 л раствора содержится 0,001 моля растворенного вещества)
Моляльная концентрация
МОЛЯЛЬНАЯ КОНЦЕНТРАЦИЯ
растворённого вещества
Единицы измерения: моль/кг
Обозначается b
Показывает отношение
количества растворённого вещества к
массе растворителя
b
=

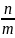 =
=
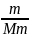
n – число молей растворенного вещества;
m1 – масса растворенного вещества;
m2 – масса растворителя;
M - молярная масса растворенного вещества.
Титр
ТИТР
Единицы измерения: г/мл
Обозначается Т
Показывает отношение массы
растворенного вещества к объему раствора
Т =

m- масса растворенного вещества (г);
V – объем раствора (мл)
(стр. 187 Габриелян, Остроумов)
Молярная доля (х) определяется отношением количества растворенного вещества к общему количеству всех веществ, содержащихся в растворе:
xi=ni /
Объемная доля (фи) используется в основном для газовых смесей:
где Vi – объем, который занял бы данный газ, если бы один находился в системе при данных давлении и температуре.
Молярная концентрация эквивалента растворенного вещества (нормальность) определяется отношением числа молей эквивалентов растворенного вещества к объему раствора:
сн = nэк(в-ва)/V(р-ра)
Единицей измерения обычно является моль ∙ экв/л. Например, запись 0,01 н KNO3 означает раствор калийной селитры с концентрацией: сн = 0,01 моль ∙ экв/л.
Зная, что количества вещества эквивалентов nэк = m(в-ва)/Mэк,
а Mэк = f∙M, где Mэк – молярная масса эквивалента, f - фактор эквивалентности для данного вещества, получаем новую формулу для молярной концентрации эквивалентов:
cн =
Кислотность или щёлочность раствора можно выразить другим, более удобным способом: вместо концентрации ионов водорода указывают её десятичный логарифм, взятый с обратным знаком. Последняя величина называется водородным показателем и обозначается через pH:
pH=-lg[H+]
