
- •1. Ферменти: визначення; властивості ферментів як біологічних каталізаторів.
- •2. Класифікація та номенклатура ферментів, характеристика окремих класів
- •3. Будова та механізми дії ферментів. Активний та алостеричний (регуляторний) центр.
- •7. Механізми дії та кінетика ферментативних реакцій: залежність швидкості
- •10. Типи інгібування ферментів: зворотнє (конкурентне, неконкурентне) та
- •11. Регуляція ферментативних процесів. Шляхи та механізми регуляції:
- •14. Ензимодіагностика патологічних процесів та захворювань.
- •15. Ензимотерапія – застосування ферментів, їх активаторів та інгібіторів в
- •16. Принципи та методи виявлення ферментів у біооб’єктах. Одиниці виміру
- •Біохімія водо – та жиророзчинних вітамінів
- •2. Вітамін в2: структура, коферментна форма, біологічні властивості, механізм дії, джерела, добова потреба, можливі патології.
- •3. Метаболізм вуглеводів та його регуляція.
- •4. Вітамін в3: структура, кофермента форма, біологічні властивості, механізм
- •5. Вітамін в5: структура, коферментна форма, біологічні властивості, механізм дії, джерела, добова потреба, можливі патології.
- •6. Вітамін в6: структура, коферментна форма, біологічні властивості, механізм дії, джерела, добова потреба, можливі патології.
- •7. Вітамін в12: будова, біологічні властивості, механізм дії, джерела, добова
- •8. Вітамін с: будова, біологічні властивості, механізм дії, джерела, добова
- •9. Вітамін н: будова, біологічні властивості, механізм дії, джерела, добова потреба, можливі патології.
- •10. Вітамін р: будова, біологічні властивості, механізм дії, джерела, добова потреба, можливі патології.
- •13. Вітамін д: будова, біологічні властивості, механізм дії, джерела, добова потреба, можливі патології.
- •14. Вітамін к: будова, біологічні властивості, механізм дії, джерела, добова потреба, можливі патології.
- •Біохімія механізму дії гормонів
- •Основні закономірності обміну речовин. Цикл трикарбонових кислот.
- •1. Обмін речовин (метаболізм) – загальні закономірності протікання катоболічних та анаболічних процесів.
- •5. Субстратне фосфорилювання цтк.
- •Молекулярні основи біоенергетики.
- •1. Реакції біологічного окислення; типи реакцій (дегідрогеназні, оксидазні, оксигеназні) та їх біологічне значення. Тканинне дирхання.
- •2. Флавінзалежні дегідрогенази
- •3. Послідовність компонентів дихального ланцюга мітохондрій. Молекулярні
- •4. Окисне фосфорилювання: пункти спряження транспорту електронів та фосфорилювання, коефіцієнт окисного фосфорилювання.
- •Пункти спряження транспорту електронів та окисного фосфорилювання
- •Ділянки дихального ланцюга мітохондрій, де вивільнення хімічної енергії достатнє для синтезу молекули атф
- •7. Мікросомальне окислення: цитохром р-450; молекулярна організація ланцюга переносу електронів.
- •Обмін вуглеводів
- •3. Аеробне окислення глюкози. Етапи репетворення глюкози до co2 , h2o.
- •4. Окислювальне декарбоксилювання пірувату. Ферменти, коферменти та послідовність реакцій в мультиферментному комплексі.
- •5. Гліколітична оксидоредукція : субстратне фосфорилювання та човникові
- •6. Порівняльна характеристика біоенергетики аеробного та анаеробного окислення глюкози, ефект Пастера.
- •7. Фосфоролітичний шлях розщеплення глікогену в печінці та мязах.
- •8. Біосинтез глікогену: ферментативні реакції, фізіологічне значення.
- •9. Механізми реципрокної регуляції глікогенолізу та глікогенезу за рахунок
- •10. Роль адреналіну, глюкагону та інсуліну в гормональній регуляції обміну
- •11. Генетичні порушення метаболізму глікогену (глікогенози, аглікогенози).
- •12. Глюконеогенез: субстрати , ферменти та фізіологічне значення процесу.
- •13. Глюкозо-лактатний (цикл Корі) та глюкозо-аланіновий цикли.
- •Метаболізм амінокислот. Ензимопатії амінокислотного обміну
- •Амінотрансферазні реакції
- •Окислення біогенних амінів
- •5. Шляхи утворення та знешкодження аміаку в організмі.
- •Генетичні дефекти ферментів синтезу сечовини
- •12. Обмін циклічної амінокислоти триптофану та його спадкові ензимопатії.
Генетичні дефекти ферментів синтезу сечовини
Існують спадкові ензимопатії, спричинені повним або частковим дефектом утворення в печінці окремих ферментів циклу сечовиноутворення. Найважчими клінічними проявами характеризуються порушення синтезу карбамоїлфосфатсинтетази та орнітинкарбамоїлтрансферази. Діти з такими генетичними дефектами страждають вираженою енцефалопатією, прояви якої дещо послаблюються в умовах повного виключення споживання харчових білків.
7. Загальні шляхи метаболізму вуглецевих скелетів амінокислот в організмі людини. Глюкогенні та кетогенні амінокислоти.
Двадцять L-амінокислот, що розрізняються за своєю хімічною структурою, біологічною роллю та особливостями метаболізму, входять до складу білків організму і присутні в клітинах та екстрацелюлярних просторах у вільному стані. Безазотисті скелети вільних амінокислот, які утворюються в результаті трансаміпувашія та дезамінування, - це метаболіти гліколізу, цитратного циклу, Р-окислення жирних кислот або речовини, що можуть перетворюватися в інтермедіати цих головних катаболічних шляхів організму.
Глюкогенні амінокислоти
L-Амінокислоти, що метаболізуються в циклі трикарбонових кислот, можуть включати свої вуглецеві скелети в молекули глюкози. Ці амінокислоти, використання яких у синтезі глюкози реалізується після їх входження в ЦТК через ацетил- КоА, а-кетоглутарат, сукциніл-КоА та фумарат, отримали назву глюкогенних амінокислот.
Кетогенні амінокислоти
Дві L-амінокислоти включаються в катаболізм тільки через ацетоацстил-КоА, якийу клітинах печінки може перетворюватися на кетонові тіла ацетоацетат та β-гідроксибутират. Це - кетогенні амінокислоти. Деякі амінокислоти віддають свої вуглецеві фрагменти на утворення як глюкози, так і кетонових тіл.
Кетогенез із амінокислот має особливо негативне значення при деяких порушеннях ферментних процесів, зокрема при некомпенсованому цукровому діабеті, у зв’язку з чим таким хворим рекомендується обмежувати надходження кетогенних амінокислот у складі продуктів харчування.
8. Біосинтез та біологічна роль креатину і креатин фосфату.
Креатин
- азотиста сполука, яка у вигляді
креатинфосфату має важливе значення в
енергозабезпеченні функції м’язів.
Біосинтез креатину відбувається за участю амінокислот гліцину, аргініну та метіоніну. Процес синтезу складається з двох стадій:
1-ша стадія - відбувається в нирках і полягає в утворенні глікоціаміну (гуанідинацетату) із аргініну та гліцину (фермент гліцинамідинотрансфераза).
2-а
стадія - відбувається в печінці, куди
тікоціамін надходить з 
током крові, і полягає в метилюванні глікоціаміну до креатину за
участю 8-аденозилметіоніну (фермент гуанідинацетатметилтрансфераза):
Фосфорилування
креатину при дії креатинфосфокінази
генерує креатинфосфат - джерело термінової
регенерації АТФ при м’язовому скороченні.
Незворотна
нефермснтативна
дегідратація і дефосфорилування
креатинфосфату
призводить до
утворення
ангідриду креатину - креатиніну.
У формі креатиніну з організму людини
виділяється із сечею значна частина
азоту амінокислот; у здорової людини
виділення креатиніну пропорційне масі
м’язових тканин і значно збільшується
за умов травматичних пошкоджень м’язів.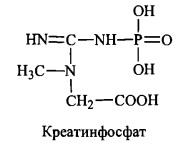
9. Глутатіон: будова, біосинтез та біологічні функції глутутіону.
Глутатіон - трипептид γ-глутамініл-цистеїннл-гліцин, що має у своєму складі вільну
сульфгідрильну групу:

Глутатіон міститься в клітинах тваринного організму у високій концентрації (близько
5 мМ). Глутатіон оборотно перетворюється з відновленої (Г-SН) до окисленої
(Г-S-S-Г) форми, відіграючи роль буфера SН-груп.
Біохімічна
функція глутатіону в організмі пов’язана
з відновленням і детоксикацією органічних
пероксидів - похідних пероксиду водню
НО-ОН, умолекулі якого один (гідропероксиди)
або обидва (алкілпероксиди) атоми водню
заміщені на алкільні радикали:
R-O-O-HR-O-O-R
При взаємодії глутатіону з гідропероксидом утворюються нешкідливі органічні спирти, що підлягають подальшому окисленню:
Реакція каталізується ферментом глутатіонпероксидазою, що містить в активному центрі атом селену (Sе).
Зворотне відновлення Г-SS-Г до Г-SH каталізується НАДФН-залежною глутатіонредуктазою.
10. Спеціалізовані шляхи метаболізму циклічних амінокислот - фенілаланіну та
тирозину.
Особливістю метаболізму в тваринних організмах циклічних амінокислот фенілаланіну та тирозину є утворення з них численних фізіологічно активних сполук гормональної та медіаторної дії, а саме: катехоламінів (адреналіну, норадреналіну), тиреоїдних гормонів, меланінів (рис. 18.7).
Шляхи метаболізму фенілаланіну:
1.Катаболічний шлях обміну полягає у втраті фенілаланіном аміногрупи (в реакції трансамінування) з утворенням фенілпірувату та кінцевого метаболіту фенілацетату, що екскретується з організму.
2. Шлях синтезу фізіологічно активних сполук починається з перетворення фенілаланіну на тирозин при дії ферменту фенілаланіпгідроксилази з подальшим перетворенням тирозину (див. нижче).
Шляхи метаболізму тирозину:
1. Катаболічний шлях обміну полягає у трансамінуванні тирозину і перетворенні його на р-оксифенілпіруват, який окислюється до гомогентизинової кислоти у складній реакції, коферменту роль у якій виконує аскорбінова кислота (вітамін С); подальші перетворення полягають в окисленні гомогентизату до фумарилацетоацетату (фермент оксидаза гомогентизинової кислоти) та розщепленні фумарилацетоацетату до фумарату та ацетоацетату.
2. Шлях синтезу катехоламінів та меланінів (пігментів шкіри). Шлях починається з окислення тирозину за участю специфічної гідроксилази до 3,4-діоксифенілаланіну (ДОФА), на рівні якого відбувається дивергенція двох обмінних шляхів: утворення катехоламінів (через декарбоксилування до дофаміну) та меланінів (через окислення
тирозиназою до дофахінону).
3. Шлях синтезу тиреоїдних гормонів-реалізується в клітинах щитовидної залози і полягає в утворенні йодованих тиронінів.
11. Спадкові ензимопатії обміну циклічних амінокислот: фенілкетонурія, альбінізм.
Фенілкетонурія - ензимопатія, спричинена генетичним дефектом синтезу фенілаланінгідроксилази. Внаслідок блокування утворення тирозину з фенілаланіну останній у збільшеній кількості надходить на шлях утворення фенілпірувату та фенілацетату, які в надмірних концентраціях накопичуються в організмі хворих. Концентрація фенілаланіну в крові хворих зростає в десятки разів, досягаючи 100-800 мг/л (норма -10-40 мг/л). Патологія проявляє себе ранніми порушеннями психічного розвитку дитини - фенілпіровиноградна олігофренія (oligophrenia phenylpyruvica).
Альбінізм - ензимопатія, біохімічною основою якої є спадкова недостатність ферменту тирозинази, що каталізує реакції, необхідні для утворення чорних пігментів меланінів. Відсутність меланінів у меланоцитах шкіри проявляється недостатньою (або відсутньою) пігментацією шкіри та волосся, підвищеною чутливістю шкіри до
сонячного світла, порушенням зору.
