
спектр и фотометр
.pdf
ние кольца дигидропиридина. Кроме того, в данных условиях ацетоацетат может перейти к форме имина (5), который с продуктом реакции альдолем
(3) и дает тот же дигидропиридин (см. схемы 9).
Таблица 3.
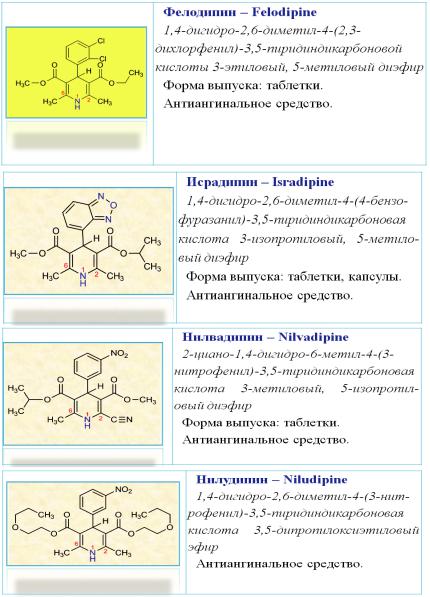
Лекарственные вещества группы производных 1,4-дигидропиридина
151

152
153

Различные лекарственные формы субстанции нифедипина (6) широко используется для лечения стенокардии и гипертонии (см. табл. 3).
Схема 9. Синтез нифедипина (6)
1,4-дигидропиридиновые антагонисты ионов кальция составляют большую группу препаратов, основным свойством которых является способность обратимо ингибировать ток кальция через медленные кальциевые каналы, В большинстве развитых стран они занимают одно из первых мест по частоте назначения среди препаратов, использующихся для лечения сердечно-сосудистых заболеваний. К наиболее активным эфирам 1,4-дигидропиридинов относится КW-З049 (бенидипин).
В связи с высокой активностью бенидипина в настоящее время были синтезированы и изучены нециклические аналоги, содержащие 3-диал- киламинo-2,2-диметилпропильный фрагмент в эфирной части производного 1,4-дигидропиридина.
154

Разработанный ранее способ получения гидрохлорида |
этилового |
и 3-(N,N-диметил-амино)-2,2-диметилпропилового диэфира |
2,5-диме- |
тил-4-(З-нитрофенил)-1,4-дигидропиридин-3,5-дикарбоновой кислоты был распространен для синтеза других, ранее не описанных аналогов бенидипина.
Нифедипин (1968-1969 гг., Bayer)
Подлинность. Основание: С 17Н18N2О6; М. м. 346,34. Желтые кри-
сталлы с т. пл. 172-174оС, разлагается на свету. Легко растворим в ацетоне, хлороформе, трудно растворим в этаноле, практически не растворим в воде.
Рис. 146. ИК-спектр нифедипина. Диск калия бромида. Стандартный образец Японской фармакопеи
Характерные полосы поглощения:
3300-2900 см-1 (NHгруппы),
1700,1680 см-1 (2С=О группы в положениях 3 и 5), 1600-1400 см-1(Ар – цикл).
Протоны двух метильных групп при двойной связи (2,25 м.д., 6Н), Сложноэфирная группа (3,6 м.д., 6Н), Протон в положении 4 (5,8 м.д., 1Н),
NH – группы в дигидропиридиновом цикле (6,2 м.д., 1Н) Ароматические протоны (7,2–7,8 м.д. 4Н).
155

Рис. 147. ЯМР- 1Н – спектр нифедипина в CDCl3
Рис. 148. Масс-спектр нифедипина
Амлодипин (1983 г., Pfizer)
Подлинность. Основание: С20Н25ClN2О5; М.м. 408,88.
(±)-Малеат: С24Н29ClN2О9; М.м. 524,88. Представляет собой белые кристаллы из этилацетата с т. пл. 178-179оС, мало растворим в воде, умеренно растворим в этаноле.
Рис. 149. ИК-спектр амлодипина бесилата. Диск калия бромида. Стандартный образец USP
156
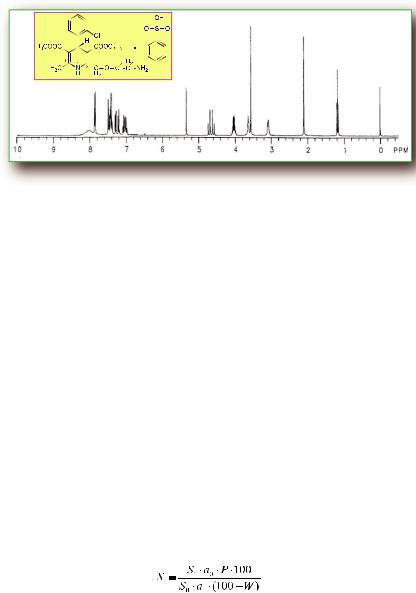
Рис. 150. ЯМР- 1Н – спектр амлодипина (в виде бесилата) в CDCl3
Характерные сигналы протонов:
Протоны метильной группы при двойной связи (с, 2,1 м.д., по 3Н), Протоны при сложноэфирной группе (с, 3,6 м.д., по 3Н), Протон в положении 4 (с, 5,35 м.д., 1Н), Протон этоксильной группы (т., 1,20 м.д., 3Н и к., 4,65 м.д., 2Н).
Сигналы трех изолированных метиленовых протонов в группировке
-СН2-О-СН2-СН2-NH2 – 3,1; 3,65 и 4,1 м.д. (6Н).
Сигналы четырех протонов фенильного радикала и пяти протонов бензолсульфокислоты обнаруживаются в интервале 6,90-7,90 м.д. (9Н).
Протоны NHгруппы в дигидропиридиновом цикле и алифатической NH2 – группы проявляются при 8,0 м.д. (3Н) в виде уширенного сигнала.
Количественное определение нифедипина и амлодипина опреде-
ляют методом ВЭЖХ в сравнении с разведением растворов препаратов и растворов СО нифедипина и амлодипина бесилат в следующих условиях:
Колонка: 0.15 м х 3.9 мм; Неподвижная фаза: октадецилсиликагель для хроматографии (5 мкм);
Подвижная фаза: смесь ацетонитрил–метанол–фосфатный буферный раствор триэтиламина рН 3,0 (15:35:50); скорость потока 1 мл/мин; УФ-детекция при 235 и 237 нм, соответственно.
Содержание препаратов рассчитываю по формуле:
где:
S1 – площадь пика нифедипина или амлодипина на хроматограмме испытуемого раствора;
157
S0 – площадь пика нифедипина или амлодипина на хроматограмме стандартного раствора;
а1 – навеска субстанций нифедипина или амлодипина, в г; а0 – навеска стандартного образца нифедипина или амлодипина беси-
лата, в г;
W – суммарное содержание воды и остаточных органических растворителей в субстанций нифедипина или амлодипина, в процентах;
Р – содержание основного вещества в стандартных образцах нифедипина или амлодипина бесилата, в процентах.
Нимодипин, нитрендипин и никардипин
Эти препараты также являются производными 1,4-дигидропиридина. Нимодипин и нитрендипин впервые синтезированы в 1972 году в лаборатории фирмы Bayer в виде основания: нимодипин имеет со -
став С21Н26N2О7; М.м. 418,45 и кристаллизуется из смеси петролейный эфир – этилацетат, образуя кристаллы с т. пл. 125 оС. Его (+)-форма имеет [α]D + 7,9о (в диоксане), а (-)-форма – [ α]D – 7,93о (в диоксане); представляет собой желтый порошок практически не растворимый в воде, легко растворим в этилацетате, умеренно растворим в этаноле.
Для нитрендипина определен состав С18Н20N2О6; М.м. 360,37 и т. пл.158оС (из этанола). Он представляет собой желтые кристаллы, практически нерастворим в воде, легко растворим в этилацетате, умеренно растворим в этаноле и метаноле.
Никардипин впервые синтезирован в 1974 году в лаборатории Японской фирмы Yamanouchi в виде:
Основание: С26Н29N3О6; М.м. 479,54. Гидрохлорид: С26Н36Cl3О6; М.м. 516.
Получен в двух кристаллических формах: α-форма с т. пл. 179-181оС, а β-форма с т. пл. 168-170оС. Представляет собой желтый кристаллический порошок, легко растворимый в метаноле и уксусной кислоте, умеренно растворим в этаноле и легко растворим в воде, ацетонитриле и уксусном ангидриде.
Строения рассматриваемых субстанций также установлены с использованием современных физико-химических методов (ИК- и ЯМР- 1Н, 13С –спектроскопии).
В ИК-спектре нимодипина обнаруживаются полосы поглощения при
3300 (NHгруппа), 2900-2700 (-О-СН2-СН2-О-, Н3С-СН-СН3), 1700-1680 (2С=О), 1650 – 1400 (Аром. цикл и =С-СН3) и 1330 см-1 (-ОСН3), обу-
словленные наличием в молекуле данной субстанции NHгруппы в дигидропиридиновом цикле, алкильных групп, карбонильных групп сложных
158
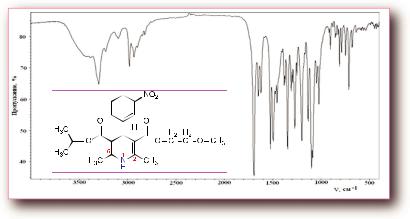
эфиров и алифатической метоксильной группы. Эти данные полностью согласуются с результатами анализа спектров ЯМР- 1Н и 13С.
В ЯМР – 1Н-спектре нимодипина наблюдаются сигналы протонов следующих функциональных группировок: Н3С–СН–СН3 (д., 1,0 и 1,2 м.д.,
J=1,5 Гц, 6Н ), 2 =С – СН3 (с, 2,30 м.д., 6Н), -ОСН3 (с, 3,20 м.д., 3Н). Сигна-
лы протонов двух метиленовых групп обнаруживаются в виде мультиплета при 3,40 и 4,05 м.д. (4Н), сигналы метиновых протонов в изопропильной группе и в положении 4 пиридинового цикла проявляются в виде мультиплета при 4,80 м.д. (1Н) и синглета при 4,95 м.д. (1Н), соответственно. Сигналы четырех протонов ароматического цикла и NHгруппы проявля-
ются при 7,5 и 7,65 м.д. (д., J=8,0 Гц, 2Н), 8,0 м.д. (с, 2Н) и 9,0 м.д. (с, 1Н).
Результаты анализа сигналов в ЯМР- 13С – спектре нимодипина полностью согласуются с вышеизложенными данными и однозначно подтверждают структуру анализируемой субстанции. Следовательно, эти данные могут быть использованы для идентификации нимодипина.
Рис. 151. ИК-спектр нимодипина. Диск калия бромида
Подлинность нимодипина и нитрендипина также определяют (по МФ) методами ИК-спектроскопии и ВЭЖХ, которые должны полностью соответствовать спектрам и хромато-грамм стандартных образцов исследуемых препаратов.
Хроматографирование рассматриваемых препаратов проводят в следующих условиях:
Нимодипин:
Колонка 4,6 мм х 12,5 см, заполненная сорбентом – октадецилсиланом; Подвижная фаза – вода–метанол–тетрагидрофуран (3:1:1);
159

Скорость подачи подвижной фазы – 2 мл/мин; УФ-детекция при 235 нм.
Рис. 152. 1Н ЯМР – спектр нимодипина в DMSO
Рис. 153. ЯМР- 13С – спектр нимодипина в DMSO
Нитрендипин:
Колонка из нержавеющей стали (0.125 м х 4 мм), октадецилсиликагель для хроматографии;
Подвижная фаза – ацетонитрил–тетрагидрофуран–вода (14:22:64); Скорость подачи подвижной фазы – 1 мл/мин; УФ-детекция при 235 нм.
Структурный анализ никардипина выполнен в соответствии с данными 1Н ЯМР- и масс-спектров.
160
