
спектр и фотометр
.pdf
Для испытания подлинности таблеток «ко-тримоксазола» могут быть использованы УФ-спектры поглощения. Хлороформное извлечение имеет максимум поглощения в области 246 нм и плечо 262-276 нм.
Подлинность подтверждают также методом ТСХ на пластинках Кизельгель при хроматографирование подвижной фазе состава хлоро- форм-ментол-раствор аммиака концентрированный (80:20:3). После проявления реактивом Драгендорфа должны обнаруживаться два основных пятна на уровне стандартных образцов веществ-свидетелей триметоприма и сульфаметоксазола.
Этим же методом обнаруживают в таблетках наличие посторонних примесей (не более 1%), сульфаниламида (стрептоцида) и кислоты сульфаниловой (не более 0,5% и 0,3% соответственно).
Количественное определение (по ФС) выполняют раздельно химическим методом на каждый из компонентов. Сульфаметоксазол определяют нитритометрическим методом. Точку эквивалентности определяют методом неводного титрования в смеси ледяной уксусной кислоты и уксусного ангидрида (30:10). Титруют 0,1М раствором хлорной кислоты (индикатор кристаллический фиолетовый).
Хранят «Ко-тримоксазол», как и другие сульфаниламиды в одном лекарственном препарате обеспечивает его высокую бактериостатическую активность, в том числе в отношении бактерий, устойчивых к другим сульфаниламидам.
Назначают «Ко-тримоксазол» при инфекциях дыхательных, мочевыводящих путей, ЖКТ, кожи и др.
Выпускают в таблетках по 0,12 и 0,48 г в виде суспензии (сиропа). Аналогичным по фармакологическому действию является отечествен-
ный препарат сульфатон. Выпускают его в виде таблеток, содержащих
0,25 г сульфамонометоксина и 0,1 триметоприма.
Замещенные сульфонилмочевины
Для идентификации алкилуреидов сульфокислот (гликлазида, глипизида, глибенкламида и др.) используют ИК-спектроскопию, подтвержденную данными ПМР-спектров. ИК-спектры лекарственных веществ, растёртых в вазелиновом масле, регистрируют в области 4000-650 см-1. Они должны соответствовать спектрам стандартных образцов.
Подлинность производных сульфонилмочевины также можно установить методом спектрофотометрии в УФ-области по расположению максимумов поглощения и по удельному показателю поглощения. Раствор карбутамида в этаноле имеет максимум при 269 нм, в 0,1 М растворе хлороводородной кислоты – при 266 и 272 нм, а в 0,1 М растворе гидроксида натрия – при 255 нм.
101

УФ-спектрраствора гликлазида имеет максимум поглощения при 228 нм, раствора глибенкламида в метаноле – три максимума (227, 273 и 293 нм), наибольшее значение удельного показателя поглощения (597) при длине волны 227 нм. Для подтверждения подлинности глипизида и гликвидона устанавливают идентичность УФ-спектров поглощения спектрам стандартных образцов этих лекарственных веществ.
Подлинность глипизида устанавливают также методом ВЭЖХ по времени удерживания испытуемого вещества, которое должно быть сопоставимым со временем удерживания стандарта.
102
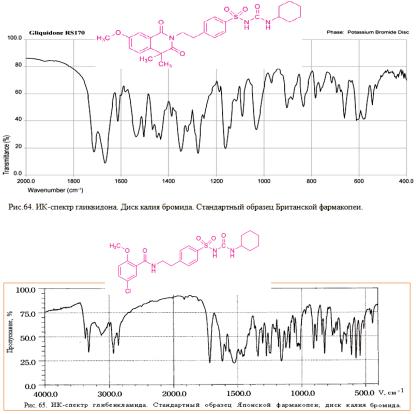
Для подтверждения подлинности гликвидона используют также метод ТСХ. Основное пятно на хроматограмме должно соответствовать по расположению и интенсивности флуорес-ценции основному пятну стандартного образца.
Методом ВЭЖХ в гликлазиде устанавливают допустимое содержание примесей (не более 0,2%) других производных сульфонилмочевины. Примесь остаточных растворителей (этилацетата) определяют методом
ГЖХ.
Количественное определение глибенкламида в таблетках выполняют методом спектрофотометрии. Для этого около 0,13 г (точная навеска) порошка растертых таблеток помещают в мерную колбу вместимостью 50 мл, прибавляют 20 мл спирта 95 %, перемешивают в течение 10 мин при нагревании на водяной бане до 50оС, охлаждают, доводят объем раствора тем же спиртом до метки, перемешивают и фильтруют через бумаж-
103

ный фильтр, отбрасывая первые 20 мл фильтрата. Измеряют оптическую плотность фильтрата на спектрофотометре в максимуме поглощения при длине волны 300 нм в кювете с толщиной слоя 10 мм.
Параллельно измеряют оптическую плотность раствора РСО гли-
бенкламида. В качестве раствора сравнения используют спирт 95 %. Содержание глибенкламида в одной таблетке в граммах (Х) вычисля-
ют по формуле:
где: А1 – оптическая плотность испытуемого раствора; Ао – оптическая плотность раствора РСО глибенкламида; а1 – навеска препарата, в г;
ао – навеска РСО глибенкламида (в пересчете на сухое вещество), в г; mср – средняя масса таблетки, в г.
Примечание. Приготовление раствора РСО глибенкламида. Около 0,05 г (точная навеска) глибенкламида помещают в мерную колбу вместимостью 50 мл, прибавляют 25 мл спирта 95%, перемешивают до растворения при нагревании на водяной бане до 50оС, охлаждают и доводят объем раствора тем же спиртом до метки (раствор А). 5 мл раствора (А) переносят в мерную колбу вместимостью 50 мл, доводят объем раствора спиртом 95 % до метки и перемешивают (раствор Б). 1 мл раствора Б содержит около 0,0001 г глибенкламида. Срок годности раствора Б – 1 сутки.
Содержание С23Н28СlN3О5S (глибенкламид) должно быть от 0,0045 до 0,0055 г, считая на среднюю массу одной таблетки.
Количественное определение глипизида осуществляют методом ВЭЖХ по стандартному образцу в следующих условиях:
колонка: 15 см х 3,9 мм; неподвижная фаза – октадецилсиликагель, 5 мкм;
подвижная фаза – буферный раствор (водные растворы мононатрийфосфата и натрия гидроксида до рН 6,0 ± 0.05) в смеси с метанолом
(55:45),
детектируют на спектрофотометре при длине волны 225 нм. Содержание глипизида в одной таблетке в граммах (Х) вычисляют по
формуле:
где: S и So – площади пиков на хроматограммах раствора испытуемого препарата и раствора СО глипизида, соответственно;
aо – навеска СО глипизида, г;
104

mср – средняя масса одной таблетки, г;
a – навеска порошка растертых таблеток, г.
Гликвидон и другие производные сульфонилмочевины в лекарственных формах количественно определяют методом УФ-спектрофотометрии в указанных выше максимумах поглощения.
Применение. Производные сульфонилмочевины стимулируют образование инсулина β-клетками поджелудочной железы, понижая при этом содержание сахара в крови. Назначают при различных формах сахарного диабета в виде таблеток; карбутамид по 0,5 г, глибенкламид по 0,005 г, гликлазид по 0,08 г, глипизид по 0,005 и 0,01 г, гликвидон по 0,03 г.
ПРОИЗВОДНЫЕ ГУАНИДИНА
В 70-х гг. было установлено, что наряду с производными сульфонилмочевины противодиабетическим действием обладают также не содержащие сульфоксильного радикала вещества, в т. ч. производные бигуанида:
Производным бигуанида является метформин.
Синтезируют метформин из диметиламина гидрохлорида и дициандиамида (см. схемы 4):
Схема 4. Синтез метформина
Метформин легко растворим в воде (допускается опалесценция), мало и медленно растворим в этаноле, практически нерастворим в эфире.
Подлинность. ИК-спектр метформина, снятый после прессования в виде таблеток с бромидом калия, в области 2000-400 см-1 по положению и относительным интенсивностям полос должен полностью совпадать с приложенным к ФС рисунком спектра.
Для испытания подлинности и количественного определения метформина используют УФ-спектрофотометрию. Водный раствор должен иметь максимум поглощения в области 233 нм. В этом максимуме опре-
105
деляют и его количественное содержание. Расчет ведут по удельному показателю поглощения (782).
Подлинность метформина в таблетках подтверждают методом ТСХ на пластинке, покрытой силикагелем в системе н-бутанол-ледяная уксусная кислота-вода (4:1:5). Сравнивают Rf испытуемого метформина и стандартного образца. Этим же методом на пластинке, покрытой целлюлозой в системе растворителей ацетон-бензол-вода (12:6:1), устанавливают допустимое содержание примеси исходного продукта синтеза – дициандиамида (не более 0,04%).
Применение. В отличие от производных сульфонилмочевины, метформин не усиливает секрецию инсулина, а угнетает глюконеогенез в печени, периферическую утилизацию глюкозы, тормозит всасывание сахара в кишечнике. Метформин снижает содержание сахара, триглицеридов и холестерина только у больных сахарным диабетом. Назначают в таблетках по 0,25 г.
ПРОИЗВОДНЫЕ 8-ОКСИХИНОЛИНА
К производным 8-оксихинолина относится довольно многочисленная группа лекарственных веществ, представителями которой являются хинозол, энтеросептол, нитроксолин, хлорхинальдол и др.
Из них в качестве антисептических средств часто применяют хино-
зол, нитроксолин, хлорхинальдол.
Для подтверждения подлинности хинозола, нитроксолина, хлорхинальдола ФС рекомендует использовать прилагаемые рисунки ИК-спек- тров, с которыми должны в области 4000-400 см-1 полностью совпадать по положению и относительным интенсивностям полос ИК-спектры испытуемых веществ (см. рис. 66). Эти данные следует подтвердить результатами анализа ПМР-спектра (см. рис. 67) исследуемого лекарственного вещества.
106
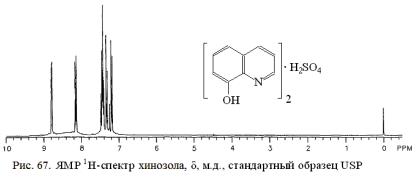
Для испытания подлинности также используют УФ-спектры. Раствор хинозола в 0,1 М хлороводородной кислоте в области 220-270 нм
должен иметь максимум поглощения при 252 нм, а в области 270-400 нм – максимумы при 308, 320 и 360 им.
УФ-спектр 0,0005%-ного раствора нитроксолина в смеси этанол-бу- ферный раствор с рН 9,18 (98:2) в области 220-500 нм имеет максимумы поглощения при 249, 341, 452,5 нм и два плеча – от 228 до 238 нм и от
258 до 268 нм.
Растворы хлорхинальдола в хлороводородной кислоте (различной концентрации) имеют максимумы поглощения в области 290-450 нм при 330, 357 нм и плечо при 318 нм, а в области 220-290 нм – один максимум при 263 нм.
При испытании на чистоту методом ТСХ на пластинках Силуфол УФ254 устанавливают наличие в нитроксолине примеси промежуточного продукта синтеза – 5-нитрозо-8-оксихи-нолина. Пластинку предварительно пропитывают насыщенным раствором трилона Б и размечают по методу «клиновидных полос».
Количественное определение производных 8-оксихинолина выполняют, в основном, методами титрования.
Применение. Производные 8-оксихинолина относятся к числу анти-
бактериальных лекарственных средств. Хинозол обладает антисепти-
ческими и сперматоцидными свойствами. В разведении 1:1000-1:2000 его используют для дезинфекции рук, промываний, спринцеваний. Он входит в состав мазей, присыпок. Нитроксолин применяют как проти- во-микробное средство для профилактики и лечения инфекций мочеполовых путей внутрь в виде таблеток по 0,05 г. Хлорхинальдол обладает антибактериальной, противогрибковой и анти-протозойной активностью. Применяют его внутрь в виде таблеток по 0,1 г при кишечных инфекционных заболеваниях.
107

ПРОИЗВОДНЫЕ 4-ХИНОЛОНА
Создание в 80-х гг. XX в. фторхинолонов – высокоэффективных синтетических антибактериальных средств, равных по своей активности современным антибиотикам – явилось крупным научным достижением. Равным ему можно считать создание сульфаниламидов. Фторхинолоны обладают особым механизмом действия, они ингибируют содержащийся в бактериальных клетках фермент (ДНК-гидразу) и эффективны в тех случаях, когда возбудители устойчивы к другим антибактериальным лекарственным веществам.
Производные хинолона-4 делят на четыре поколения. К 1 поколению относят нефторированные хинолоны: налидиксовую, оксолиновую и пипемидиновую кислоты. Они потеряли свое значение после создания имеющих значительные преимущества перед ними фторхинолонов (II поколе-
ние): ципрофлоксацина, норфлоксацина, офлоксацина, пефлоксацина,
ломефлоксацина, у которых спектр активности значительно шире.
К хинолонам III поколения относится левофлоксацин – левовращающий изомер офлоксацина, так называемый «респираторный» хинолон, имеющий более высокую активность в отношении пневмококков, чем у II поколения.
Хинолоном IV поколения является моксифлоксацин (респираторный и антианаэробный хинолон). Он превосходит хинолоны II поколения по активности в отношении пневмококков и хорошо действует на неспорообразующие анаэробы.
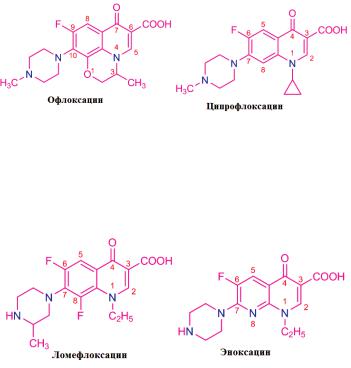
Из большого числа полученных в последние годы фторхинолонов наиболее широко применяют ломефлоксацина гидрохлорид, ципрофлоксацина гидрохлорид и офлоксацин.
На эффективность фармакологического действия фторхинолонов оказывают влияние особенности их химической структуры. Наличие в молекуле фторхинолона (ломефлоксацин) двух атомов фтора (в положениях 6 и 8) способствует более активному и длительному действию. Так, ломефлоксацин медленнее выводится из организма и поэтому достаточен одноразовый прием его в сутки. Циклопентильный радикал в положении 1 хинолинового ядра у ципрофлоксацина привел к повышению в 3-8 раз
108

его активности. Поэтому он быстро нашел наиболее широкое применение в медицинской практике многих стран.
Офлоксацин по сравнению с другими фторхинолонами имеет дополнительно «встроенное» метилзамещенное оксазиновое ядро. Это изменение в химической структуре расширило спектр его антибактериального действия, в т. ч. преимущественное действие на грамотрицательные бактерии.
В настоящее время широкое применение в медицине получили препараты 2-го поколения – такие, как офлоксацин, норфлоксацин, ципрофлоксацин (ципробай) и др., называемые фторхинолонами с общей структурной формулой:
В настоящее время установлена взаимосвязь структуры хинолонов с фармакологическим действием, обусловленная следующим:
-наличие фармакофорной группы, отвечающей за ингибирование вирусной ДНК-гиразы;
-введение атома F расширяет антибактериальный спектр;
-пиперазиновый или N-метилпиперазиновый циклы повышают антибактериальную активность в отношении грамположительных микроорганизмов и облигатных анаэробов, придают соединению липофильные свойства;
-оксазиновое кольцо повышает устойчивость к метаболизму, уменьшает токсичность, придает соединению гидрофильные свойства;
-сочетание оксазина с N-метилпиперазином обеспечивает амфотерность, улучшает всасывание и распределение в тканях и различных очагах инфекции.
109
Ципрофлоксацин (выпускается в виде гидрохлорида или лактата) – белый кристаллический порошок без запаха, растворим в воде, мало растворим в спирте, нерастворим в хлороформе.
Кроме офлоксацина и ципрофлоксацина, к хинолонам 3-го поколения относятся еще около 10 ЛС. Среди них ломефлоксацин (содержит 2 атома фтора) и эноксацин (производный нафтиридина):
Подлинность лекарственных веществ группы 4-хинолона подтверждают с помощью физико-химических методов (ИК- и УФ-спектроско-
пия, ВЭЖХ).
Подлинность ципрофлоксацина гидрохлорида подтверждают методом ТСХ на пластинках Сорбфил по идентичности значений Rf основного пятна у испытуемого и стандартного веществ. Используют подвижную фазу, состоящую из метиленхлорида-метанола-раствора аммиака-ацето- нитрила (4:4:2:1). Пластинку просматривают при коротких и длинных волнах УФ-света.
Ципрофлоксацина гидрохлорид количественно определяют методом ВЭЖХ, используя подвижную фазу, включающую 0,025 М раствор фосфорной кислоты-ацетонитрил (87:13). Детектируют при длине волны 278 нм, используют стандартный образец ципрофлоксацина. Этот же метод рекомендован для определения содержания примесей. В таблетках содержание и однородность дозирования ципрофлоксацина гидрохлорида определяют спектрофотометрическим методом при длине волны 279 нм после извлечения водой (с обработкой ультразвуком).
110
