
Хохлов
.pdf
Глава 3. Фармацевтическая разработка лекарственных препаратов
Схема решений №4
ИЗУЧЕНИЕ НЕОБХОДИМОСТИ УСТАНОВЛЕНИЕ КРИТЕРИЕВ ПРИЕМЛЕМОСТИ ДЛЯ ФАРМАЦЕВТИЧЕСКИХ СУБСТАНЦИЙ И ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ В ОТНОШЕНИИ ПОЛИМОРФИЗМА
Лекарственный препарат – твердая лекарственная форма или жидкость, содержащая нерастворенную активную фармацевтическую субстанцию
Примечание: Проводить указанные ниже процессы только в случае технической возможности определения содержания полиморфных форм в лекарственном препарате.
141
Промышленная фармация. Путь создания продукта
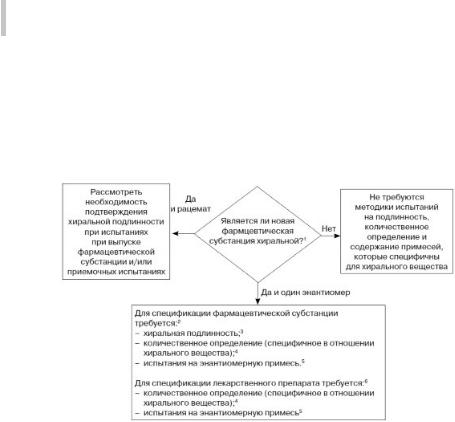
Схема решений №5
УСТАНОВЛЕНИЕ МЕТОДИК ИСПЫТАНИЙ НА ПОДЛИННОСТЬ, КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ И ПРИМЕСИ ЭНАНТИОМЕРОВ ДЛЯ НОВЫХ ХИРАЛЬНЫХ ФАРМАЦЕВТИЧЕСКИХ СУБСТАНЦИЙ И ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ, СОДЕРЖАЩИХ ХИРАЛЬНЫЕ ФАРМАЦЕВТИЧЕСКИЕ СУБСТАНЦИИ
1.Хиральные субстанции природного происхождения не рассматриваются в данном примере.
2.Как и в случае других примесей, источником которых является сырье, используемое при синтезе лекарственных веществ, можно установить альтернативный контроль качества хиральныхвеществ, задав пределы для соответствующего исходного сырья или промежуточного продукта, если это обосновано результатами исследований, проведенными в ходе разработки. В основномэто будут такие случаи, когда имеются множественные хиральные центры (например, три или более), или,когдажелательнымявляетсяконтрольнастадии,предшествующейполучению готовой фармацевтической субстанции.
3.Методика количественного определения, специфичная для хирального соединения,илиметодикаиспытаниянаэнантиомернуюпримесьмогутбытьприемлемы вместо методики определения подлинности хирального соединения.
4.Методика количественного определения, которая не специфична для хирального соединения, в сочетании с методикой контроля противоположного энантиомера, может быть приемлема вместо методики количественного определения, специфичной для хирального соединения.
5.Уровень содержания противоположного энантиомера в фармацевтической субстанции можноопределить на основании данных, полученных с помощью методики количественного определения, специфичной для хирального соединения, или посредством применения отдельной методики.
6.Стереоспецифичные испытания лекарственного препарата можно не проводить, если доказана незначительная рацемизация в процессе производства лекар-
ственного препарата и во время хранения готовой лекарственной формы.
142
Глава 3. Фармацевтическая разработка лекарственных препаратов
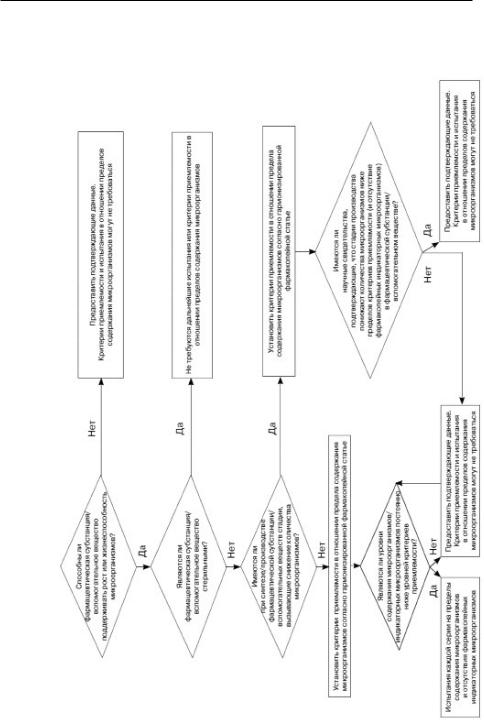
Схема решений №6 |
МИКРОБИОЛОГИЧЕСКОЙ ЧИСТОТЫ ФАРМАЦЕВТИЧЕСКИХ СУБСТАНЦИЙ |
И ВСПОМОГАТЕЛЬНЫХ ВЕЩЕСТВ |
|
ПОКАЗАТЕЛИ |
|
143

Промышленная фармация. Путь создания продукта
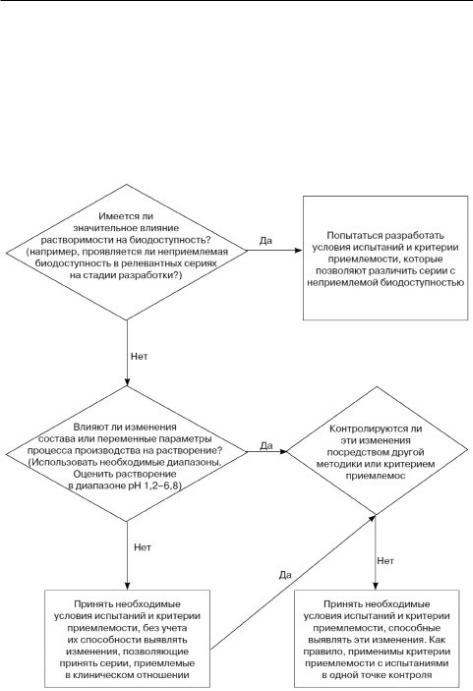
Схема решений №7
УСТАНОВЛЕНИЕ КРИТЕРИЕВ ПРИЕМЛЕМОСТИ В ОТНОШЕНИИ РАСТВОРЕНИЯ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
144
Глава 3. Фармацевтическая разработка лекарственных препаратов
Схема решений №7 (продолжение)
УСТАНОВЛЕНИЕ КРИТЕРИЕВ ПРИЕМЛЕМОСТИ В ОТНОШЕНИИ РАСТВОРЕНИЯ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
2. Какие особые условия проведения испытания и критерии приемлемости являются подходящими? [немедленное высвобождение]
145
Промышленная фармация. Путь создания продукта
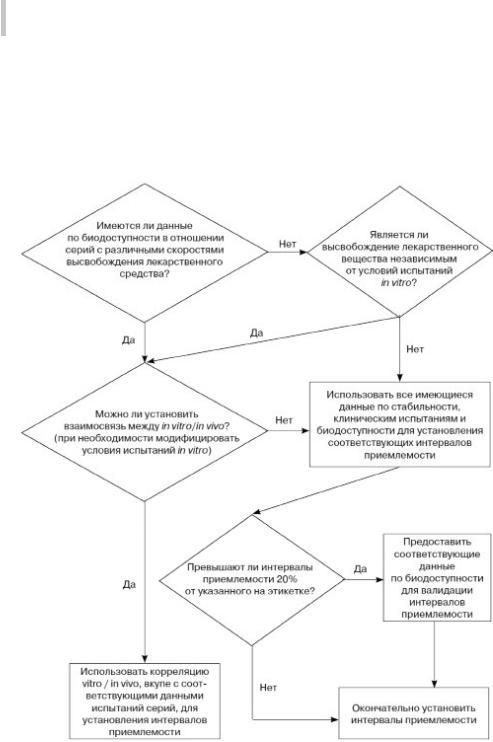
Схема решений №7 (окончание)
УСТАНОВЛЕНИЕ КРИТЕРИЕВ ПРИЕМЛЕМОСТИ В ОТНОШЕНИИ РАСТВОРЕНИЯ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
3. Какие интервалы приемлемости являются подходящими? (пролонгированное высвобождение)
146

Глава 3. Фармацевтическая разработка лекарственных препаратов
Схема решений №8
ПОКАЗАТЕЛИ МИКРОБИОЛОГИЧЕСКОЙ ЧИСТОТЫ НЕСТЕРИЛЬНЫХ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
147

Промышленная фармация. Путь создания продукта
3.6.3. Валидация аналитических методик
Все аналитические методики, используемые при контроле качества лекарственных средств, должны быть валидированы. Целью данной процедуры является экспериментальное подтверждение того, что применение разработанной методики позволит достичь поставленной цели. В зависимости от задач использования существуют методики для доказательства подлинности, определения посторонних примесей и количественного определения действующего вещества и других нормируемых компонентов ЛП. Перечень обязательных валидационных характеристик для каждого типа методик отличается. Так, согласно Государственной Фармакопее и Решению Коллегии ЕЭК от 17.07.2018 №113 «Об утверждении Руководства по валидации аналитических методик», для определения подлинности достаточно доказать специфичность методики. При измерении предельного содержания примесей проводят испытания специфичности и предела обнаружения. Для методик количественного определения АФС и ВВ изучают подлинность, линейность, правильность, прецизионность, аналитический диапазон, а для количественного определения примесей – дополнительно устанавливают предел количественного определения. Проверка устойчивости (робастности) методики не является обязательной характеристикой и её подтверждают при необходимости [46].
Перечень испытаний и порядок их проведения для данных типов методик изложенные в Государственной Фармакопее, совпадают с руководством ICH Q2 (R1) «Валидация аналитических методик: Предмет и методология» [46, 342]. Требования Фармакопеи США также гормонизированы с руководством ICH Q2 (R1), однако для методик техлологических испытаний лекарственных форм (например, теста растворения или распадаемости) обязательные валидационные характеристики и критерии их приемлемости содержатся в общих фармакопейных статьях для данного метода испытаний. В табл. 4 приведено описание валидационных характеристик согласно нормативному документу ICH.
148

149
Табл. 4. Валидационнные характеристики аналитических методик согласно руководству ICH Q2 (R1) «Валидация аналитических методик»
Испытание |
Тип методики |
Цель |
Порядок проведения |
|
|
|
|
Специфичность – способность |
Идентификация |
Гарантия подлинности анализи- |
Способность отличить аналит от |
методики достоверно определять |
|
руемого вещества |
близких по структуре соединений, |
анализируемое вещество в присут- |
|
|
присутствие которых в образце |
ствии других компонентов пробы |
|
|
вероятно, и других примесей: необ- |
(примеси, продукты разложения, |
|
|
ходимо получить положительные |
матрицы и др.) |
|
|
результаты в образцах, содержащих |
|
|
|
аналит, параллельно с отрица- |
|
|
|
тельными результатами образцов, |
|
|
|
которые не содержащих аналит |
|
|
|
|
|
Содержание примесей |
Достоверное определение при- |
Введение в вещество (АФС или ЛП) |
|
|
месей (родственные примеси, |
определенное количество примесей |
|
|
тяжелые металлы, содержание |
и/или вспомогательных веществ с |
|
|
остаточных растворителей, др.) |
последующей их идентификацией. |
|
|
в присутствии анализируемого |
Для хроматографических методик |
|
|
вещества |
целесообразно подтвердить отсут- |
|
|
|
ствие в хроматографическом пике |
|
Количественное определе- |
Обеспечение специфичности |
|
|
аналита или примеси коэлюирую- |
||
|
ние |
для получения точного результа- |
|
|
щихся веществ с помощью диодно- |
||
|
|
та количественного определения |
матричного или масс-спектрометри- |
|
|
или активности аналита в пробе |
|
|
|
ческого детектора |
|
|
|
|
|
Линейность – подтверждение на- |
Количественное определе- |
Проверка наличия линейной или |
Калибровочный график строят, как |
личия зависимости аналитического |
ние; содержание примесей |
какой-либо другой вида зависи- |
минимум, на 5 уровнях концентра- |
сигнала от концентрации аналита |
(для допустимых примесей |
мости аналитического сигнала |
ций. При этом определяют вид за- |
|
|
от концентрации аналита в |
висимости, проводят регрессион- |
|
|
рамках аналитического диапазо- |
ный анализ и определяют коэффи- |
|
|
на методики |
циент корреляции |
|
|
|
|
Прецизионность – степень близости |
Количественное определе- |
Сходимость – подтверждение |
• Проводят минимум 9 определе- |
(степень разброса) между сериями |
ние; содержание примесей |
прецизионности при одинако- |
ний, охватывающих весь аналити- |
измерений множестве проб одного и |
(для допустимых примесей) |
вых условиях выполнения в те- |
ческий диапазон (например, 3 кон- |
того же гомоген- |
|
чение короткого интервала вре- |
центрации по 3 повтора каждой). |
|
|
мени (например, рабочей смены) |
|
|
|
|
|
препаратов лекарственных разработка Фармацевтическая .3 Глава

150
Табл. 4. Валидационнные характеристики аналитических методик согласно руководству ICH Q2 (R1) «Валидация аналитических методик»
(продолжение)
ного образца в указанных усло- |
|
Внутрилабораторная преци- |
• Проводят минимум 6 определений |
виях. Существуют 3 вида: сходи- |
|
зионность – подтверждение |
при 100% анализируемой концен- |
мость, внутрилабораторная прецизи- |
|
прецизионности внутри лабора- |
трации. |
онность, воспроизводимость |
|
тории: выполнении испытаний |
При этом рассчитывают стандарт- |
|
|
в различные дни, различными |
ное отклонение, относительное |
|
|
специалистами-аналитиками, на |
стандартное отклонение (коэффи- |
|
|
различном оборудовании |
циент вариации) и доверительный |
|
|
|
интервал |
|
|
Воспроизводимость-подтверж- |
|
|
|
дение прецизионности между |
|
|
|
результатами различных лабо- |
|
|
|
раторий |
|
|
|
|
|
Правильность – степень близости |
Содержание примесей |
Подтверждение точности |
• Определение в образцах АФС или |
между полученным и реальным |
|
количественного определения |
ЛП с введенным известным количе- |
(теоретическим) результатом количе- |
|
аналита или примеси по всему |
ством примесей; |
ственного определения |
|
аналитическому диапазону |
• Сравнение результатов с ранее ва- |
|
|
|
лидированной методикой; возмож- |
|
|
|
но применение фактора отклика |
|
|
|
АФС |
|
|
|
|
|
Количественное определе- |
|
АФС: |
|
ние |
|
• Испытания на АФС эталонной |
|
|
|
чистоты; |
|
|
|
• Сравнение результатов с ранее |
|
|
|
валидированной методикой; |
|
|
|
• Признаётся после подтверждения |
|
|
|
прецизионности, линейности и |
|
|
|
специфичности |
|
|
|
ЛП: |
|
|
|
• Добавление аналита к смеси вспо- |
|
|
|
могательных веществ, примесей |
|
|
|
или плацебо; |
|
|
|
• Добавление известных количеств |
|
|
|
аналита к ЛП (определение приро- |
|
|
|
ста концентрации); |
|
|
|
|
продукта создания Путь .фармация Промышленная
