
- •Оксипроизводные углеводородов
- •3.1 Алканолы
- •4. Реакции элементорганических соединений
- •4.2 Окисление металлорганических соединений:
- •4.3 Гидроборирование – окисление алкенов:
- •1.1.5 Алкилирование (реакция Вильямсона):
- •1.1.6 Ацилирование:
- •1.1.7 Введение кратных связей:
- •2.1.1 Взаимодействие спиртов с галогенводородными кислотами:
- •2.1.4 Замещение гидроксила на галоген действием галогенидов фосфора и серы:
- •5.1 Окисление первичных спиртов:
- •5.2 Окисление вторичных спиртов:
- •6.3 Ретропинаколиновая перегруппировка:
- •3.2 Многоатомные спирты
- •4. Восстановление углеводов:
- •1. Образование солей (гликолятов, глицератов)
- •3.3 Фенолы и ароматические спирты
- •3.3.1 Одноатомные фенолы
- •3. Щелочное плавление ароматических сульфокислот:
- •6. Гидролиз арендиазониевых солей:
- •7. Окислительное декарбоксилирование карбоновых кислот:
- •1. Реакции фенольного гидроксила
- •1.1 Кислотные свойства
- •1.1.2 Взаимодействие с карбонатом натрия:
- •1.2 Образование простых эфиров:
- •1.3.3 Перегруппировка Фриса:
- •1.3.4 Перегруппировка Кляйзена:
- •1.4 Взаимодействие с хлорным железом:
- •2.3 Сульфирование:
- •2.4 Гидрирование:
- •3.3.2 Многоатомные фенолы
- •3.4 Простые эфиры
- •5. Реакции виниловых, циклических и бензиловых эфиров
- •3.5 Тиолы
- •3. Реакции нуклеофильного замещения
- •3.1 Алкилирование гидросульфата:
- •3.2 Алкилирование сероводорода:
- •3.3 Получение тиоэфиров:
- •1.2.Взаимодействие со щелочами:
- •1.3 Взаимодействие с оксидами:
- •2.3 Взаимодействие тиолов с нитрилами, альдегидами и кетонами
3.5 Тиолы
Тиолы (меркаптаны,тиоспирты), содержат вмолекулемеркаптогруппу –SH (сульфогидрильную группу), непосредственно связанную с органическим радикалом. Тиолы можно рассматривать как производные сероводорода, в котором один атом водорода замещен углеводородным остатком, которые являются аналогами алканолов, алкенолов и фенолов.
Номенклатура тиолов подобна номенклатуре гидроксилпроизводных, только вместо суффикса -ол применяется -тиол или вместо префикса гидрокси- (окси-) применяется меркапто-. Иногда эти соединения называют меркаптанами, тиоспиртами, тиофенолами. Номенклатура ИЮПАК использование этих названий не рекомендует. Названия тиолов производят прибавлением к названию соответствующего углеводородасуффикса-тиол, (таблица 16).
Таблица 16 – Название тиолов
|
Формула |
Cистематическая |
Радикально-функциональная |
|
СН3SН |
метантиол |
метилмеркаптан |
|
СН3СН2SН |
этантиол |
этилмеркаптан |
|
СН3СН2СН2SН |
пропантиол-1 |
пропилмеркаптан |
|
С6Н5SН |
тиофенол |
меркаптобензол |
Способы получения
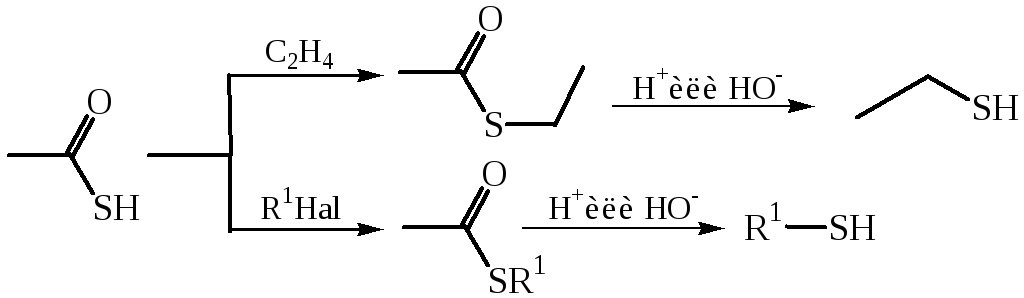
1. Из тиолкарбоновых кислот. Тиолы могут быть получены реакцией тиолкарбоновых кислот с алкенамиили алкилгалогенидами с последующимгидролизомобразующихсятиоэфиров:
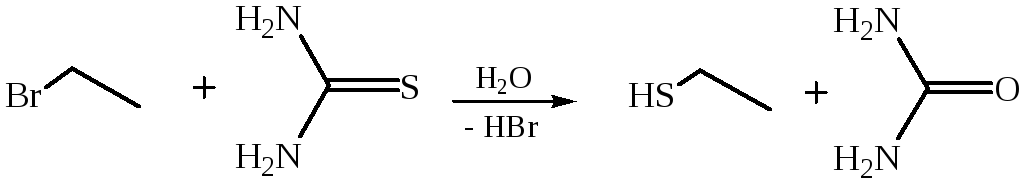
2. Конденсация алкилгалогенидов с тиомочевиной и последующим щелочным гидролизомизотиурониевойсолилибоконденсацияалкилгалогенидов сNa2S2O3 и кислотным гидролизомS-алкилтиосульфатов:
3. Реакции нуклеофильного замещения
3.1 Алкилирование гидросульфата:
![]()
3.2 Алкилирование сероводорода:
![]()
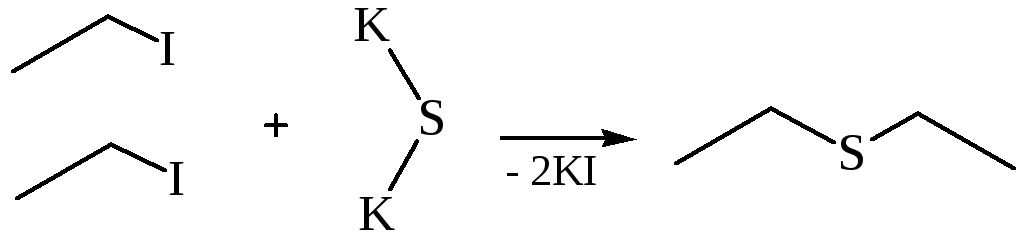
3.3 Получение тиоэфиров:
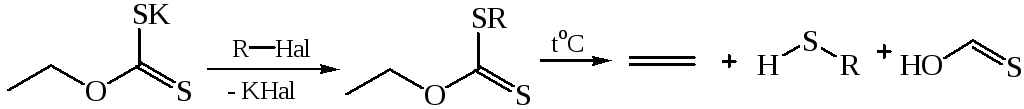
4. Взаимодействие алкилгалогенидов с ксантогенатамищелочных металлов (Л.А. Чугаев):
5. Промышленные методы. В промышленности низшие тиолы получают взаимодействием спиртовсH2S в присутствии катализаторовпри 300–350 °С. Третичные алкантиолыC8 – C16 – взаимодействием непредельных углеводородовсH2S в присутствии А12О3 при 100–135 °С и давлении3,5–7 МПа.
Физические свойства и строение. Тиолы представляют собой бесцветные соединения с чрезвычайно неприятным запахом, которым обнаруживается уже в ничтожных концентрациях. Алкантиолы содержатся в кишечных газах человека и животных, в зловонных выделениях некоторых животных.
АтомS в меркаптогруппе имеет гибридизацию, промежуточную междуsp2 и sp3. Например, для молекулы СН3SН:
длины связей С–S 0,1817 нм, S–H 0,1329 нм;
валентный угол CSH = 96,5°;
энергия связи S–H 360 кДж/моль.
Потенциал ионизациидляCH3SH – 9,44 эВ с удлинением углеродной цепи понижается. Электронная система атома серы значительно подвижнее, чем кислоррода, что отражается и на энергии ионизации. Тиолы являются более сильными электронодонорами. В молекулах тиолов угол CSH равен 100–104°, что меньше, чем угол СОН в алканолах. Для тиолов характерна линейная зависимость термодинамических величин от молекулярной массы (таблица 17).
Таблица 17 – Энергия диссоциациисвязиС–SH в тиолах
|
Соединение |
Eдис., кДж/моль |
|
CH3SH |
293,3 |
|
C2H5SH |
289,1 |
|
C3H7SH |
284,9 |
|
C4H9SH |
272,35 |
Группа SH обладает слабым – I и +M эффектами, кислотные свойства ее выше, а основные ниже, чем группыОН. Связь S–Н менее полярна, чем связь О–Н, поэтому у тиолов слабее межмолекулярные водородные связи и ниже температуры кипения, чем у соответствующих кислородных аналогов (таблица 18).
Таблица 18 – Физические свойства некоторых тиолов
|
Соединение |
Мr |
Тпл., °С |
Ткип., °С |
d420 |
nD20 |
|
Метантиол |
48.11 |
–123,02 |
6,02 |
0,8665 |
– |
|
Этантиол |
62,13 |
–144,40 |
35,00 |
0,8391 |
1,4310 |
|
Пропантиол |
76.16 |
–113,30 |
67,60 |
0,8411 |
1,4380 |
|
2-Пропантиол |
76,16 |
–130,54 |
52,56 |
0,8143 |
1.4255 |
|
Бутантиол |
90,19 |
–116,00 |
98,58 |
0,8416 |
1,4429 |
|
2-Метилпропантиол |
90,19 |
–140,20 |
85,15 |
0,8295 |
1,4366 |
|
Пентантиол |
104,22 |
–75,70 |
126,64 |
0,8421 |
1,4469 |
|
Циклогексантиол |
116,17 |
– |
158,0 |
0,9782 |
1,4921 |
|
Октантиол |
146,29 |
–49,20 |
77–78 |
0,8433 |
1,4540 |
|
2-Метил-2-пропантиол |
90,19 |
1,11 |
64,22 |
0.8002 |
1,4332 |
В разбавленных растворах тиолы существуют в виде мономеров, а в более концентрированных – в виде димеров преимущественно линейного строения благодаря образованию водородных связейS–H...S. В жидком и твердом состоянии тиолы могут образовывать полимеры.
Химические свойства
1. Кислотные свойства. Тиолы более сильные кислоты, чем соответствующие спирты (рК этантиола –10,5, а этанола –18). Легкая поляризуемость атома серы, вследствие большего атомного радиуса и меньшей электроотрицательностью по сравнению с атомом кислорода, способствует делокализации отрицательного заряда, образующегося алкилсульфид-иона RS– и, следовательно, повышает его стабильность.
![]()
1.1 Образование солей. Тиолы образуют растворимые в воде соли тиоляты – с щелочными металлами и нерастворимые – с тяжелыми металлами (ртутью, свинцом, цинком). Это свойство тиолов нашло свое отражение в названии меркаптаны (от лат. mercurius captans – связывающий ртуть).
![]()
Способность тиолов связывать ионы тяжелых металлов позволяет использовать их как противоядия при отравлениях соединениями мышьяка, ртути, хрома, висмута.
