
- •Оксипроизводные углеводородов
- •3.1 Алканолы
- •4. Реакции элементорганических соединений
- •4.2 Окисление металлорганических соединений:
- •4.3 Гидроборирование – окисление алкенов:
- •1.1.5 Алкилирование (реакция Вильямсона):
- •1.1.6 Ацилирование:
- •1.1.7 Введение кратных связей:
- •2.1.1 Взаимодействие спиртов с галогенводородными кислотами:
- •2.1.4 Замещение гидроксила на галоген действием галогенидов фосфора и серы:
- •5.1 Окисление первичных спиртов:
- •5.2 Окисление вторичных спиртов:
- •6.3 Ретропинаколиновая перегруппировка:
- •3.2 Многоатомные спирты
- •4. Восстановление углеводов:
- •1. Образование солей (гликолятов, глицератов)
- •3.3 Фенолы и ароматические спирты
- •3.3.1 Одноатомные фенолы
- •3. Щелочное плавление ароматических сульфокислот:
- •6. Гидролиз арендиазониевых солей:
- •7. Окислительное декарбоксилирование карбоновых кислот:
- •1. Реакции фенольного гидроксила
- •1.1 Кислотные свойства
- •1.1.2 Взаимодействие с карбонатом натрия:
- •1.2 Образование простых эфиров:
- •1.3.3 Перегруппировка Фриса:
- •1.3.4 Перегруппировка Кляйзена:
- •1.4 Взаимодействие с хлорным железом:
- •2.3 Сульфирование:
- •2.4 Гидрирование:
- •3.3.2 Многоатомные фенолы
- •3.4 Простые эфиры
- •5. Реакции виниловых, циклических и бензиловых эфиров
- •3.5 Тиолы
- •3. Реакции нуклеофильного замещения
- •3.1 Алкилирование гидросульфата:
- •3.2 Алкилирование сероводорода:
- •3.3 Получение тиоэфиров:
- •1.2.Взаимодействие со щелочами:
- •1.3 Взаимодействие с оксидами:
- •2.3 Взаимодействие тиолов с нитрилами, альдегидами и кетонами
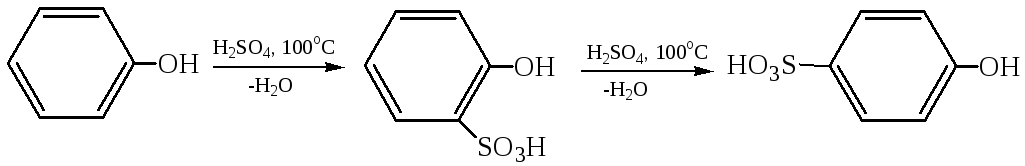
2.3 Сульфирование:
2.4 Гидрирование:
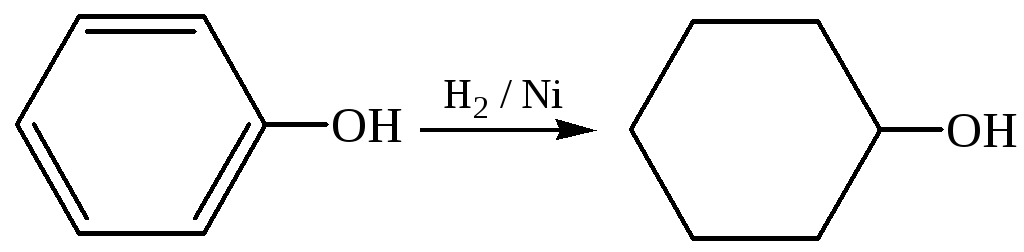
2.5 Окисление. Повышенная электронная плотность в ядре фенола делает его чувствительным к воздействию окислителей.
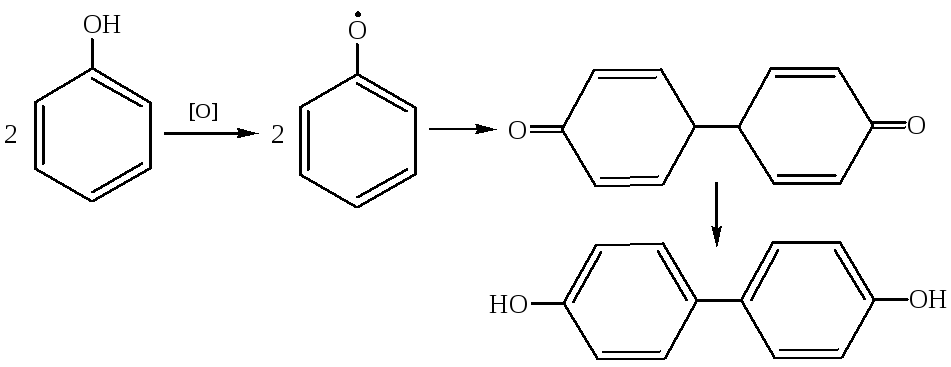
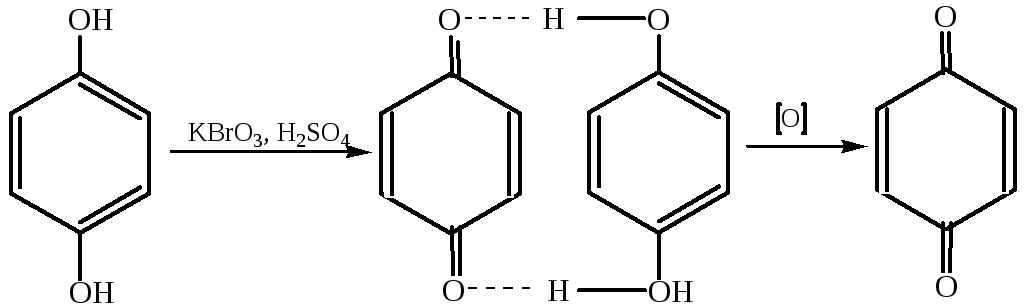
2.5.1 Сильные окислители, такие, как персульфат в щелочном растворе, броматы, окисляют фенол до паpа-бензохинона, протекающее, очевидно, через промежуточное образование гидрохинона:
2.5.2 Жесткие окислители, например, хромовая смесь, разрушают бензольное кольцо и образуется гамма продуктов, из которой трудно выделить индивидуальные соединения.
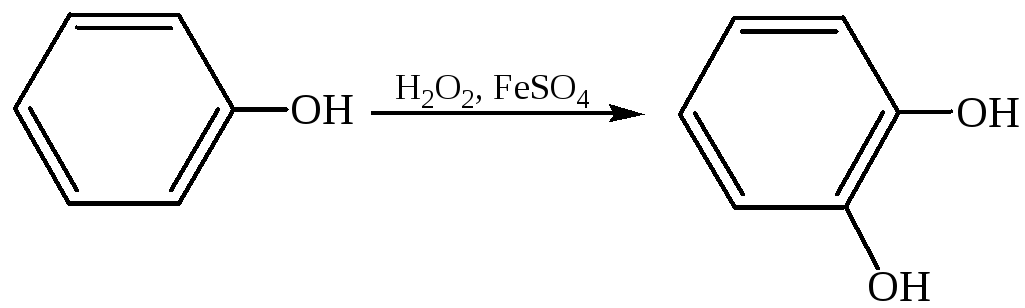
2.5.3 Мягкие окислители, такие как пероксид водорода, надкислоты и т. п., позволяют получить определенные продукты окисления:
2.5.3.1
2.5.3.2
Благодаря склонности к окислению фенолы окрашиваются при хранении с доступом воздуха. Например, фенол вначале приобретает розовую, а затем при длительном соприкосновении с воздухом – темную окраску.
С накоплением гидроксиксильных групп склонность фенолов к окислению сильно возрастает. Так гидрохинон окисляется даже раствором хлорного железа, образуя черно-зеленые кристаллы хингидрона. На легкой окисляемости основано использование гидрохинона в качестве проявителей в фотографии, ингибиторов полимеризации. Трехатомный фенол – пирагаллол (1, 2, 3- тригидроксибензол) настолько легко окисляется, что его применяют для поглощения кислорода из газовых смесей.
3. Вследствие высокой реакционной способности бензольного кольца фенолы могут вступать в ряд реакций SE, не характерных для бензола:
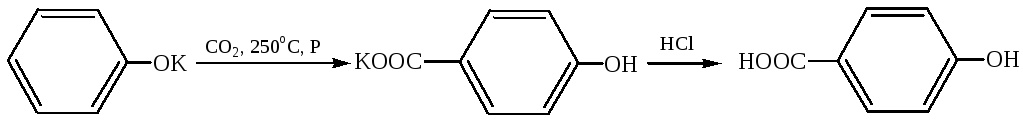
3.1 Синтез фенолкарбоновых кислот (реакция Кольбе – Шмитта, 1860–1864 г.):
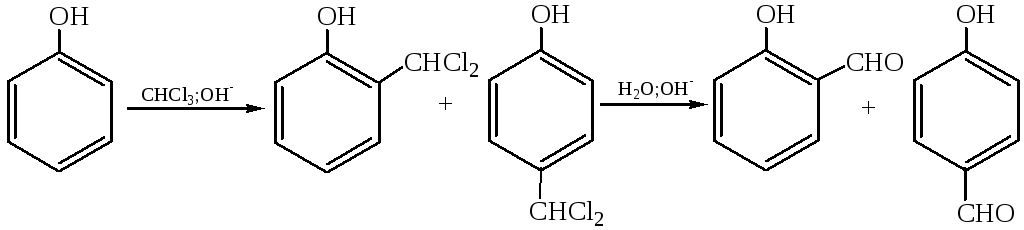
3.2 Получение альдегидов бензольного ряда (реакция Раймера – Тиммана, 1876 г.). При обработке фенола хлороформом в щелочной среде в бензольное кольцо вводится альдегидная группа, т. е. осуществляется прямое формилирование. Реакция включает стадию электрофильного замещения водородных атомов в фенолят-ионе на дихлоркарбен, образующийся при воздействии на хлороформ щелочи, с получением бензилиденхлорида, гидролизующегося в соответствующий альдегид:
3.3 Нитрозирование фенолов происходит при их обработке азотистой кислотой при низкой температуре:
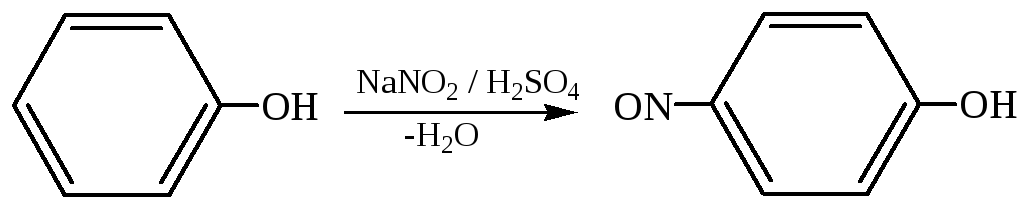
3.5 Азосочетание фенолов с солями диазония протекает в условиях основного катализа (в слабощелочной среде):
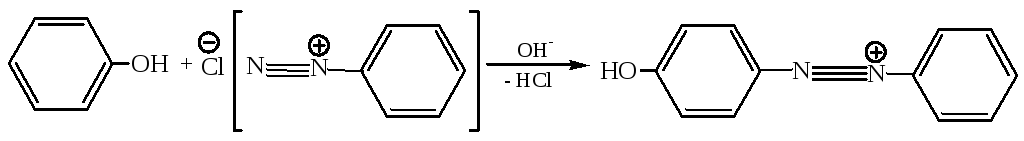
п-гидроксиазобензол
3.4 Конденсация с альдегидами и кетонами. Наиболее известна и изучена реакция конденсации с формальдегидом, которая приводит к получению полимерных материалов – фенолформальдегидных смол (1909 г.). Т. к. ядро фенола чувствительно к электрофильным реагентам, воздействие формальдегида в кислой или щелочной среде приводит к полиалкилированию:
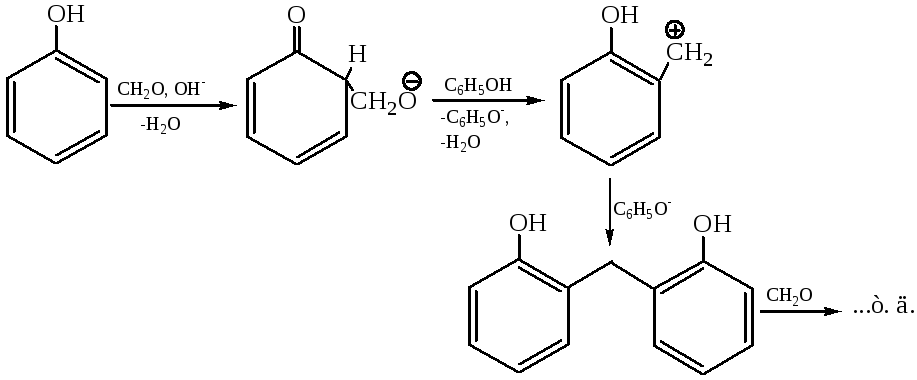
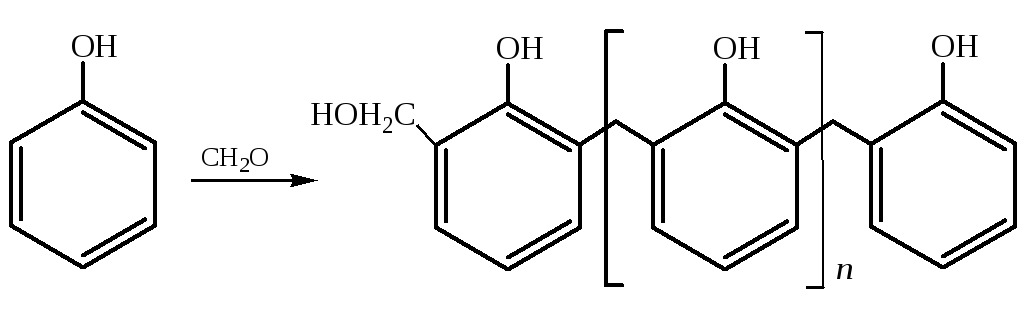
3.3.1 Получающийся линейный полимер (новолак) используется как заменитель естественных смол при получении лаков и прессованных порошков как регулярного, так и нерегулярного строения:
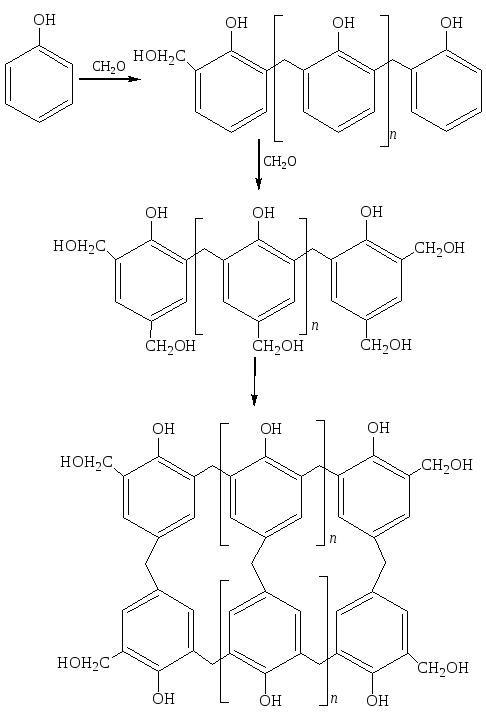
3.3.2 Нагревание выше 150–200 оС приводит к образованию – резита или бакелита – реактивному полимеру (плавится при нагревании, но после затвердевания расплавить нельзя):
3.3.2 Многоатомные фенолы
Многоатомные фенолы синтезируют способами, аналогичными получению одноатомных фенолов: гидролизом дигалогенбензолов, сплавлением солей полисульфокислот со щелочами, окислением ароматических аминов или фенолов.
Химические свойства. Многоатомные фенолы напоминают по химическим свойствам фенол. Кислотные свойства повышены по сравнению с фенолом.
1. Взаимодействие с хлорным железом. Как и фенол, многоатомные фенолы дают характерное окрашивание с хлоридом железа (Ш): двухатомные – зеленое (пирокатехин), трехатомные – красное (пирогаллол):
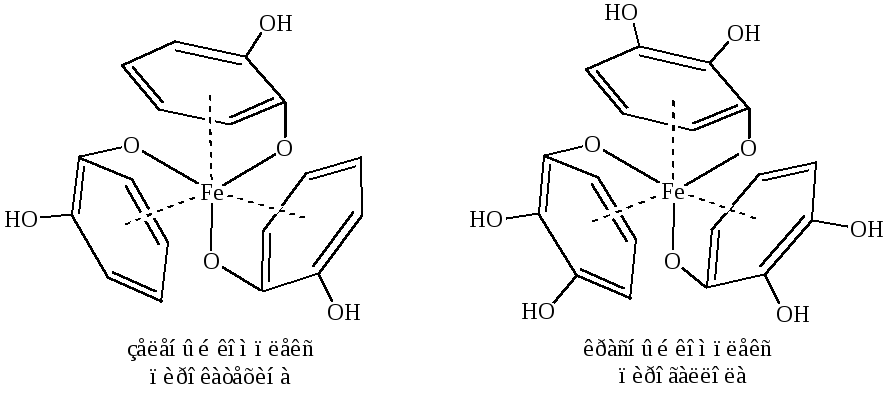
2. Реакции электрофильного замещения протекают легко, подобно фенолу (часть 2, глава 3.3.1).
3. Реакции окисления. Отличительной чертой многоатомных фенолов является чрезвычайная легкость их окисления. Двухатомные фенолы с орто- и пара-положением гидроксильных групп окисляются с образованием хинонов:
3.1
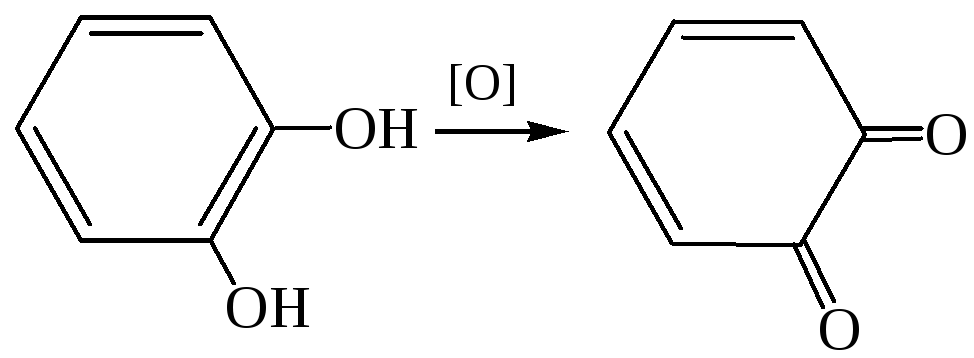
3.2

Резорцин не может образовать хинон, так как он более устойчив к действию окислителей.
4. Реакции кетонных форм. Присутствие двух и более гидроксильных групп увеличивает возможность возникновения таутомерной кетонной формы. Кето-енольная таутомерия особенно сильно проявляется в случае резорцина и флороглюцина.
4.1 Присоединение водорода. Резорцин в виде непредельного циклического кетона легко присоединяет водород с образованием дигидрорезорцина:
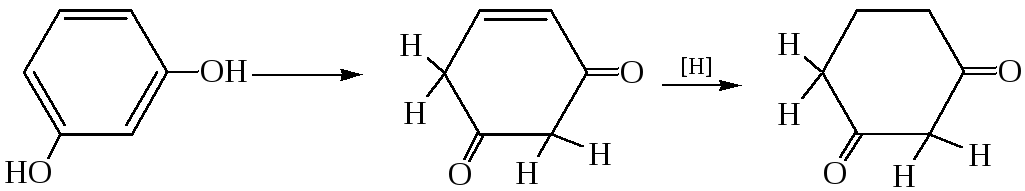
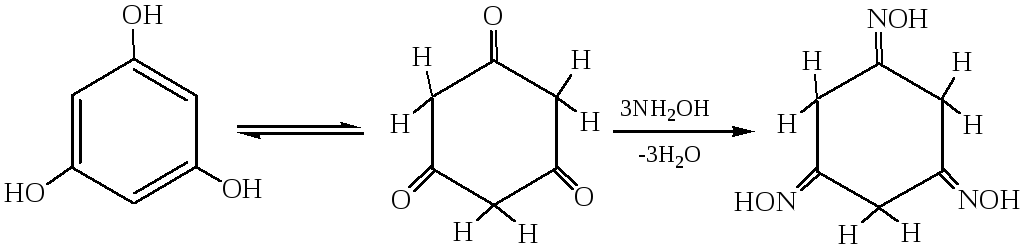
4.2. Взаимодействие с гидроксиламином. Кетонная форма флороглюцина способна взаимодействовать с гидроксиламином с образованием оксима. Благодаря высокой подвижности водородных атомов метиленовых групп возможно также их алкилирование при действии алкилирующих агентов:
Основные представители оксипроизводных углеводородов. Природные спирты и фенолы. В отличие от галогенуглеводородов спирты, фенолы и их производные широко представлены в растительном и животном мире.
Метанол в наибольших количествах находят в сточных водах целлюлозно-бумажной промышленности и предприятий по производству фенолформальдегидных смол, лаков и красок. При употреблении большого количества безалкогольных напитков, в которых вместо сахарозы используется подсластитель аспартам (сластилин), вследствие биотрансформации последнего в организме может образоваться до 250 мг метанола в день.
При попадании в водоемы метанол окисляется, значительно снижая содержание растворенного в воде кислорода. Концентрация метанола выше 4 мг/мл оказывают влияние на экологическое состояние водоема, а свыше 250 мг/л в значительной степени снижают активность микроорганизмов биологически активного или при очистке сточных вод.
Метанол является сильным ядом, действующим на зрительные нервы и сосуды сетчатки глаза. При попадании в организм человека метанол окисляется с образованием формальдегида и муравьиной кислоты, вследствие чего развивается ацидоз, кровь недостаточно насыщается кислородом, нарушаются многие окислительно-восстановительные процессы. При острых отравлениях метанол выводится из организма в течение 5–8 дней, причем основная его часть выводится через легкие в неизменном виде.
Этиловый спирт в малой концентрации присутствует воздухе, почвенных водах как продукт спиртового брожения, постоянно идущего в природе. Этанол применяют в органических синтезах, при производстве синтетических каучуков, как растворитель в пищевой и лакокрасочной промышленности. Этанол добавляют в бензин и дизельное топливо для увеличения энергетических характеристик и снижения содержания вредных веществ в выхлопных газах.
При длительном приеме этанола внутрь проявляется токсическое действие на ЦНС, печень, желудочно-кишечный тракт, железы внутренней секреции. У мужчин в результате снижения уровня тестерона в крови снижается половая функция. У женщин наблюдаются нарушения менструального цикла, патологическое течение беременности. Этанол обладает эмбриотоксическим действием: дети алкоголиков страдают умственной неполноценностью, врожденными пороками сердца и т. д. Алкоголь усугубляет действие многих неблагоприятных экологических факторов.
Этанол в небольших количествах синтезируется в организме, его содержание в крови человека составляет 0,08–4 %. Метаболизм этанола происходит главным образом в печени, при этом происходит его окисление ферментом алкогольдегидрогиназой до ацетальдегида, с действием последнего связывают повреждения биологических мембран, печени и другие нарушения в организме.
Высшие твердые спирты встречаются или в свободном виде (цетиловый спирт С16Н33ОН в спермацете кашалота – морского кита), или в виде сложных эфиров пальмитиновой, стеариновой, других высших кислот (спермацет, пчелиный, растительный, животный воски).
Ненасыщенные спирты моно- и сесквитерпенового рядов являются составной частью многих душистых эфирных масел.
Гераниол – главная составная часть розового, гераниевого, вербенового, лимонного масел, обладает запахом розы. Содержится и во многих других эфирных маслах – пеларгоновом, цитронелловом, масле иланг-иланга и др.
Нерол – геометрический изомер гераниола, содержится в померанцевом (апельсиновом), бергамотном и многих других маслах, имеет запах розы.
Линалоол содержится в линалоевом, бергамотном, кориандровом, лавандовом, апельсиновом, розовом и других маслах, имеет запах ландыша.
Цитронеллол (родинол) содержится в розовом, пеларгоновом, цитронеллоловом, лимонном, гераниевом маслах, обладает запахом розы.
Фарнезол входит в состав ромашкового, ландышевого, липового, иланг-илангового и других масел, обладает запахом липы, ландыша.
Этиленгликоль – сиропообразная бесцветная жидкость без запаха. Этиленгликоль используют при производстве синтетических волокон, полиэфиров, пластификаторов, взрывчатых веществ, он входит в состав антифризов, его применяют в парфюмерной, текстильной и табачной промышленности.
Поступление этиленгликоля в организм человека с вдыхаемым воздухом, в силу низкой летучести, маловероятно. Основной путь попадания в организм через желудочно-кишечный тракт. Этиленгликоль действует на ЦНС и почки, вызывает гемолиз эритроцитов, изменяет интенсивность окислительно-востановительных процессов. Имеются данные о канцерогенном и мутагенном действии этиленгликоля. Биотрансформация идет двумя путями:
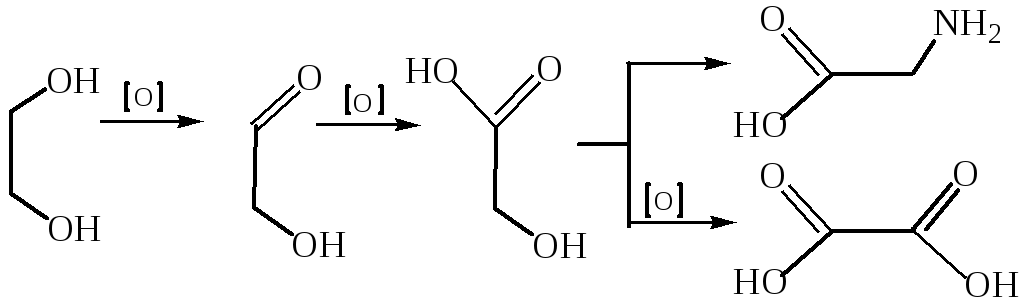
Токсичны метаболиты этиленгликоля – гликолевый альдегид и щавелевая кислота. С образованием щавелевой кислоты связывают образование и накопление в почках кристаллов оксалата кальция. Эта соль может откладываться и в клетках нервной системы, что нарушает микроциркуляцию крови, и в сосудах головного мозга. В мозге наблюдается изменение концентрации аминокислот, нарушается проведение нервого импульса. Накопление гликолевого альдегида может приводить к ингибированию окислительного фосфорилирования и синтеза белков, нарушениям в цикле Кребса и метаболизме глюкозы, что приводит к снижению уровня образования АТФ и накоплению молочной и пировиноградной кислот.
Глицерин в виде сложных эфиров высших карбоновых кислот входит в состав растительных и животных жиров и масел.
Ненасыщенным природным спиртом является также фитол – составная часть хлорофилла (зеленого пигмента растений):

Примерами природных циклических спиртов служат ментол и холестерин – важнейший представитель стеринов. Ментол – главная составная часть мятного масла, имеет запах мяты.
Фенолы имеют важное значение для получения органических соединений, использующихся в различных областях техники и хозяйства. Фенол используют для синтеза алкилфенолов, ε-капролактама, адипиновой кислоты, анилина, бисфенола А, пестицидов, пластификаторов, синтезе многих лекарственных средств, красителей, индикаторов. На основе фенолформальдегидной смолы готовят лаки и пленкообразователи, связующие и клеи, наполнители, пропиточные материалы и пенопласты, стабилизаторы полимерных материалов и синтетические дубильные вещества. Одно из направлений применения фенола – получение взрывчатых материалов. Аммонийная соль пикриновой кислоты не уступает по взрывной силе тротилу. Фенол и его производные обладают бактерицидными свойствами.
Одноатомные фенолы встречаются в природе как свободном виде, так и в виде производных. Сам фенол в качестве продукта нормального обмена веществ содержится в моче человека и животных как продукт разложения тирозина.
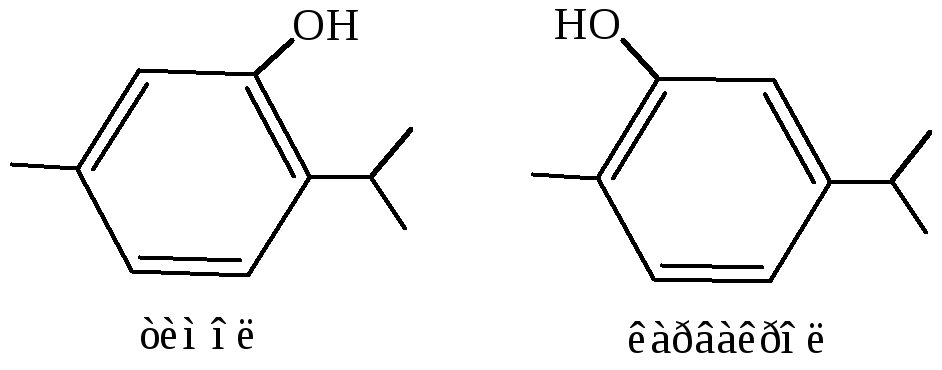
Из природных фенолов известны, например, тимол, входящий в состав масла душистого чабреца, тимьяна, карвакрол – составная часть тминного масла:
Простые эфиры фенолов, такие как экстрагол, анетон, также входят в состав эфирных масел. Первый содержится в анисовом, байевом, укропном, эстрагоновом маслах, напоминает по запаху анис; второй – в анисовом, укропном маслах, имеет сладковатый запах.
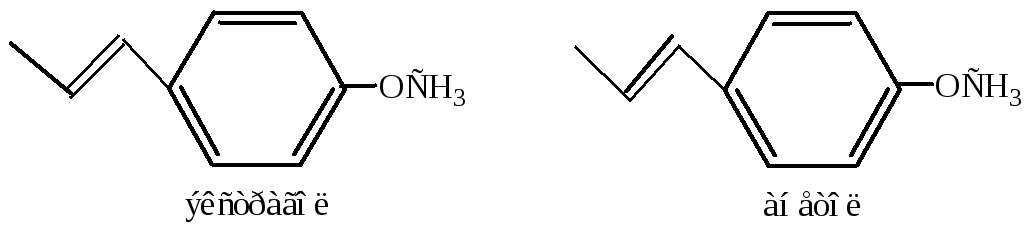
Значительно более распространены в природе двух- и многоатомные фенолы, которые встречаются в виде различных производных, так как в свободном виде они быстро окисляются. Среди природных производных пирокатехина можно отметить: гваякол – содержится в буковой смоле, обладает сильным характерным запахом; эвгенол – душистое вещество гвоздики; изоэвгенол – содержится в масле мускатного ореха, иланг-иланговом масле; конифериловый спирт в виде глюкозида кониферина (R, β-глюкопираноза) входит в состав лигнина.
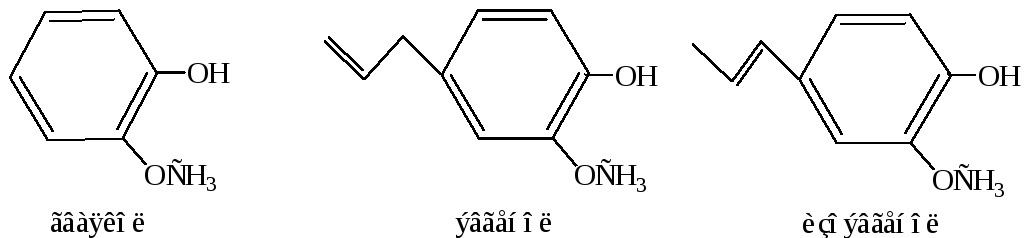
В растениях широко распространены гликозиды фенолов. Глюкозид арбутин (агликоном является гидрохинон) найден во многих растениях, например, толокнянке, грушевом дереве, вереске; салицин (агликоном – салициловый спирт) – в листьях и коре ивы; сирингин (агликоном – сирингенин) – в коре сирени, жасмина.
Пирогаллол в природе встречается обычно в виде гликозидов либо самой галловой кислоты или ее производных танинах – дубильных веществах чая, кофе, в чернильных (дубильных) орешках (патологические наросты) дуба и других деревьев, листьях, плодах растений (дуб, ива, береза, ель, каштан, акации, тропические деревья и кустарники).
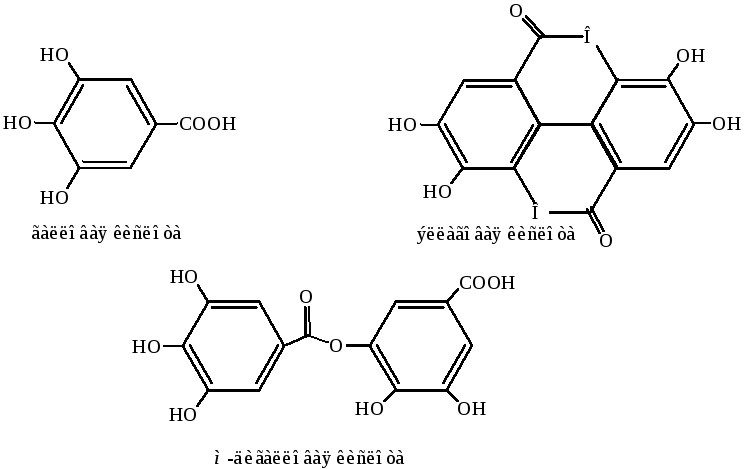
Гликозиды танинов являются простыми эфирами или сложными эфирами – продуктами этерификации гликозидного гидроксила углевода соответствующей кислотой.
