- •Оксипроизводные углеводородов
- •3.1 Алканолы
- •4. Реакции элементорганических соединений
- •4.2 Окисление металлорганических соединений:
- •4.3 Гидроборирование – окисление алкенов:
- •1.1.5 Алкилирование (реакция Вильямсона):
- •1.1.6 Ацилирование:
- •1.1.7 Введение кратных связей:
- •2.1.1 Взаимодействие спиртов с галогенводородными кислотами:
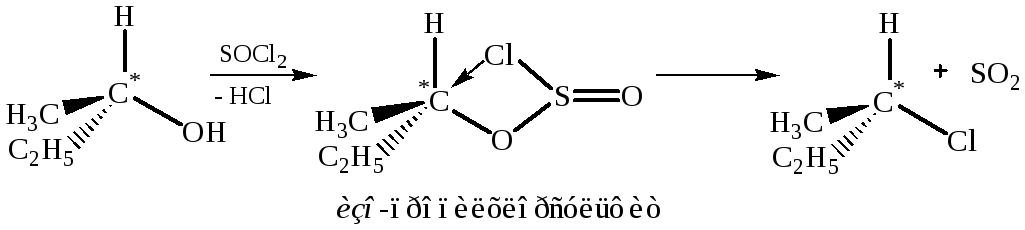
- •2.1.4 Замещение гидроксила на галоген действием галогенидов фосфора и серы:
- •5.1 Окисление первичных спиртов:
- •5.2 Окисление вторичных спиртов:
- •6.3 Ретропинаколиновая перегруппировка:
- •3.2 Многоатомные спирты
- •4. Восстановление углеводов:
- •1. Образование солей (гликолятов, глицератов)
- •3.3 Фенолы и ароматические спирты
- •3.3.1 Одноатомные фенолы
- •3. Щелочное плавление ароматических сульфокислот:
- •6. Гидролиз арендиазониевых солей:
- •7. Окислительное декарбоксилирование карбоновых кислот:
- •1. Реакции фенольного гидроксила
- •1.1 Кислотные свойства
- •1.1.2 Взаимодействие с карбонатом натрия:
- •1.2 Образование простых эфиров:
- •1.3.3 Перегруппировка Фриса:
- •1.3.4 Перегруппировка Кляйзена:
- •1.4 Взаимодействие с хлорным железом:
- •2.3 Сульфирование:
- •2.4 Гидрирование:
- •3.3.2 Многоатомные фенолы
- •3.4 Простые эфиры
- •5. Реакции виниловых, циклических и бензиловых эфиров
- •3.5 Тиолы
- •3. Реакции нуклеофильного замещения
- •3.1 Алкилирование гидросульфата:
- •3.2 Алкилирование сероводорода:
- •3.3 Получение тиоэфиров:
- •1.2.Взаимодействие со щелочами:
- •1.3 Взаимодействие с оксидами:
- •2.3 Взаимодействие тиолов с нитрилами, альдегидами и кетонами
2.1.4 Замещение гидроксила на галоген действием галогенидов фосфора и серы:
2.1.5 Замещение ОН-группы на остаток спирта. При нагревании избытка спирта с концентрированной серной кислотой до 130–150 °С образуются эфир и вода (межмолекулярная дегидратация):
![]()
Реакция SN, в которой нуклеофилу второй молекуле спирта нуклеофильные свойства обеспечивает НЭП кислородного атома:
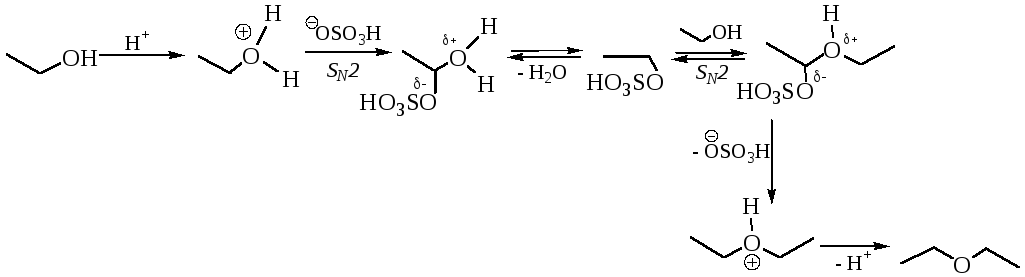
В кислой среде активизируется молекула субстрата (спирт протонируется), а затем осуществляется SN реакция. В случае первичных спиртов после протонирования возможно быстрое образование промежуточного продукта – алкилсерной кислоты, в которой в качестве выгодной уходящей группы выступает анион –OSO3H.
При сравнительно невысоких температурах скорость межмолекулярной дегидратации, как реакции SN, превышает скорость внутримолекулярной дегидратации. Алкены образуются лишь в качестве побочных продуктов. С ростом температуры вклад реакции элиминирования возрастает, а при температуре более 150–170 °С она становится преобладающей.
У вторичных и тертичных спиртов возможен SN1 процесс:
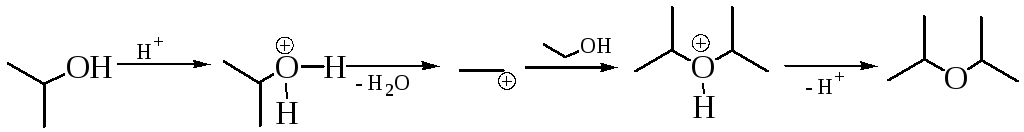
Однако следует отметить, что у третичных спиртов выход простых эфиров низок, т. к. сказываются пространственные затруднения и велик вклад побочной реакции элиминирования.
2.1.5 Карбонилирование алканолов. При взаимодействии с оксидом углерода в присутствии кобальтовых катализаторов под давлением происходит внедрение молекулы СО по связи R–OH с образованием карбоновой кислоты:
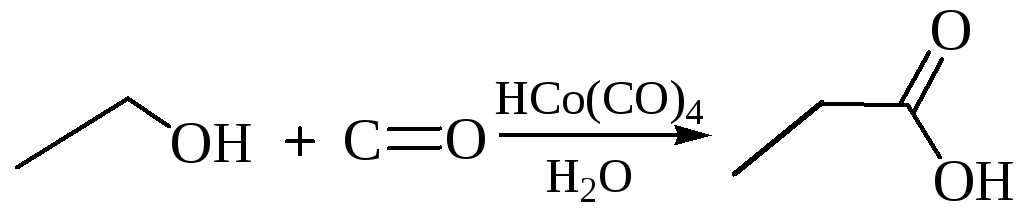
3. Внутримолекулярная дегидратация спиртов (элиминированиие) конкурирует с нуклеофильным замещением, но требует более жестких условий. При нагревании смеси спиртов с кислотами (H2SО4, H3PО4) до температуры 150–170 °С выделяются алкены:
![]()
Образование алкена преимущественно происходит в соответствии с правилом Зайцева. Легкость дегидратации возрастает в следующем ряду:
первичные > вторичные > третичные
Часто внутримолекулярная дегидратация сопровождается перегруппировками – происходит перемещение двойной связи или изменение углеводородного скелета. Например:

Приведенный выше порядок реакционной способности спиртов, протекание перегруппировок могут быть объяснены, если предположить простой Е1 механизм кислотно-катализируемой дегидратации:
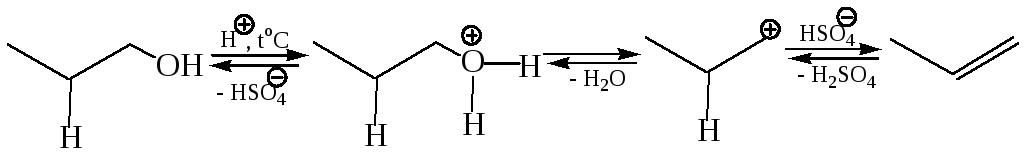
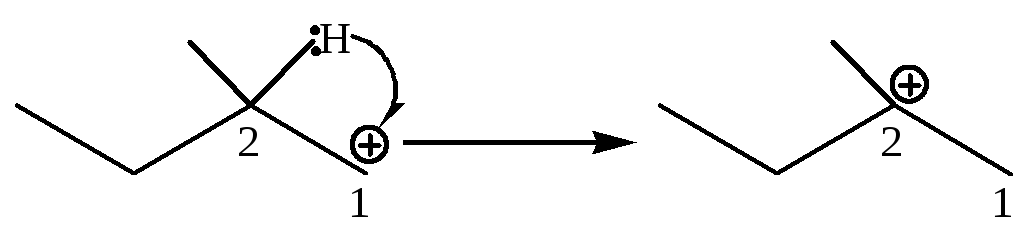
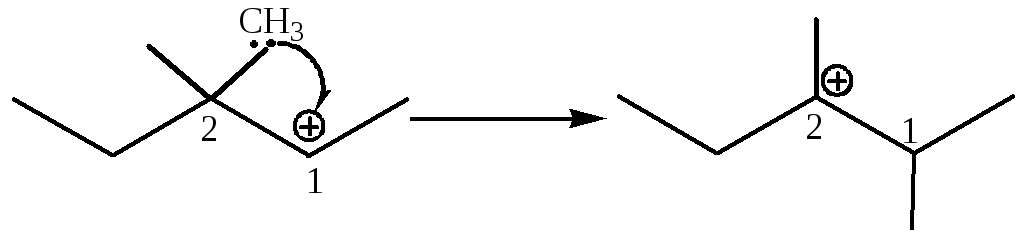
В этом случае легко объяснимы протекающие перегруппировки – реакция происходит путем изомеризации карбокатиона, образующегося на лимитирующей стадии, в более устойчивый за счет миграции либо гидрид-иона, либо алкильной группы с парой электронов:
|
|
1,2-гидридный сдвиг |
|
первичный третичный |
|
|
|
|
|
|
1,2-алкильный сдвиг |
|
вторичный третичный |
|
4. Реакция ацилирования спиртов. В результате ацилирования гидроксилпроизводных образуются сложные эфиры карбоновых кислот (часть 2, главы 3.1, 6.3.4):
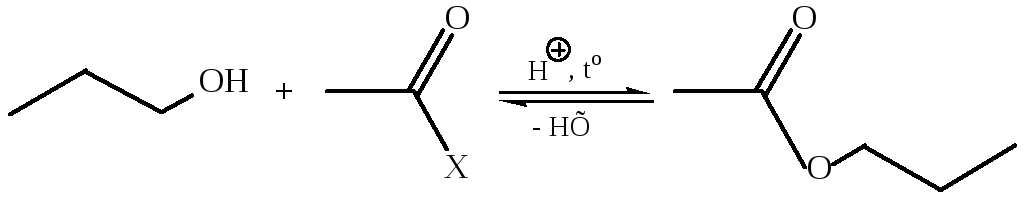
Спирты, как более сильные нуклеофилы, могут ацилироваться довольно слабыми ацилирующими средствами – карбоновыми кислотами, в этом случае реакцию называют реакцией этерификации.
5. Химическое и каталитическое окисление. Окисление осуществляется кислородом в присутствии катализаторов (Cu, CuO) или различными неорганическими окислителями (KMnO4, Na2Cr2O7 + H2SO4, CrO3).