- •Оксипроизводные углеводородов
- •3.1 Алканолы
- •4. Реакции элементорганических соединений
- •4.2 Окисление металлорганических соединений:
- •4.3 Гидроборирование – окисление алкенов:
- •1.1.5 Алкилирование (реакция Вильямсона):
- •1.1.6 Ацилирование:
- •1.1.7 Введение кратных связей:
- •2.1.1 Взаимодействие спиртов с галогенводородными кислотами:
- •2.1.4 Замещение гидроксила на галоген действием галогенидов фосфора и серы:
- •5.1 Окисление первичных спиртов:
- •5.2 Окисление вторичных спиртов:
- •6.3 Ретропинаколиновая перегруппировка:
- •3.2 Многоатомные спирты
- •4. Восстановление углеводов:
- •1. Образование солей (гликолятов, глицератов)
- •3.3 Фенолы и ароматические спирты
- •3.3.1 Одноатомные фенолы
- •3. Щелочное плавление ароматических сульфокислот:
- •6. Гидролиз арендиазониевых солей:
- •7. Окислительное декарбоксилирование карбоновых кислот:
- •1. Реакции фенольного гидроксила
- •1.1 Кислотные свойства
- •1.1.2 Взаимодействие с карбонатом натрия:
- •1.2 Образование простых эфиров:
- •1.3.3 Перегруппировка Фриса:
- •1.3.4 Перегруппировка Кляйзена:
- •1.4 Взаимодействие с хлорным железом:
- •2.3 Сульфирование:
- •2.4 Гидрирование:
- •3.3.2 Многоатомные фенолы
- •3.4 Простые эфиры
- •5. Реакции виниловых, циклических и бензиловых эфиров
- •3.5 Тиолы
- •3. Реакции нуклеофильного замещения
- •3.1 Алкилирование гидросульфата:
- •3.2 Алкилирование сероводорода:
- •3.3 Получение тиоэфиров:
- •1.2.Взаимодействие со щелочами:
- •1.3 Взаимодействие с оксидами:
- •2.3 Взаимодействие тиолов с нитрилами, альдегидами и кетонами
4. Восстановление углеводов:

Химические свойства. У многоатомных спиртов сохраняются все свойства спиртового гидроксила. Отличия состоят в том, что в реакции участвует одна или более ОН-групп, в результате могут получаться полные или неполные производные. Ряд реакций обусловлен взаимным влиянием гидроксильных групп (например, кислотные свойства).
Кислотные свойства. У многоатомных спиртов кислотные свойства выражены сильнее по сравнению с одноатомными. Отрицательный индукционный эффект вновь появившихся гидроксильных групп вызывает увеличение полярности связи О–Н, что и приводит к увеличению кислотных свойств аналогично влиянию хлора у 2-хлорэтанола:
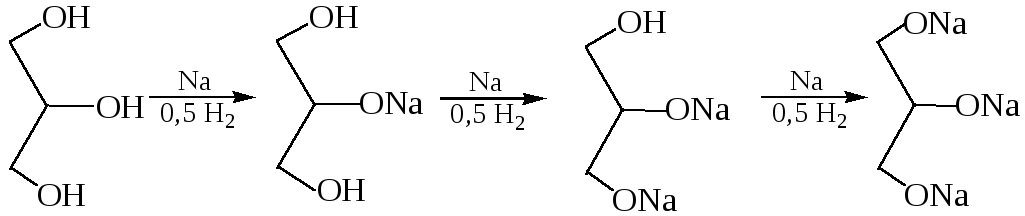
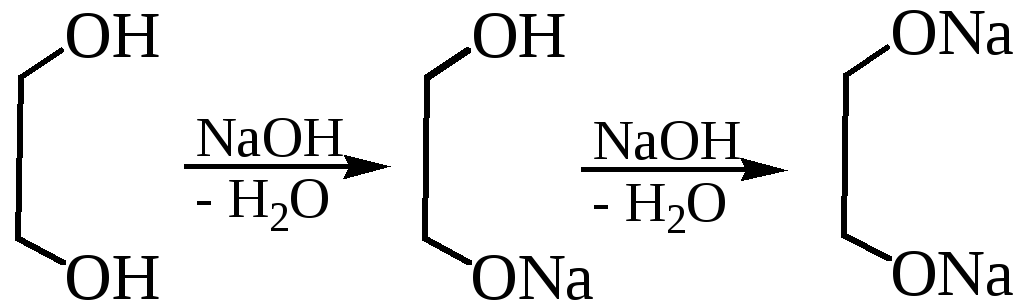
1. Образование солей (гликолятов, глицератов)
1.1 С активными металлами:
![]()
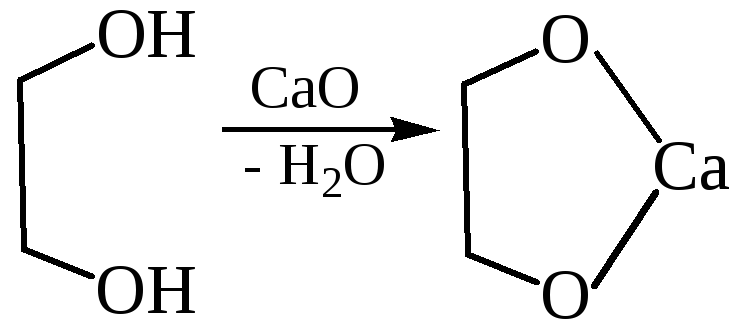
1.2 С оксидами:
С гидроксидами:
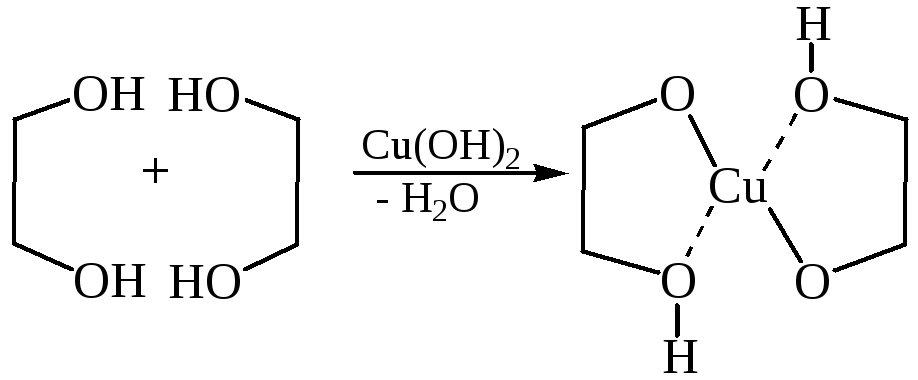
1.4 С ионами некоторых тяжелых металлов:
2. Реакции замещения гидроксильной группы
2.1 Замещение гидроксильной группы на галоген:
2.1.1
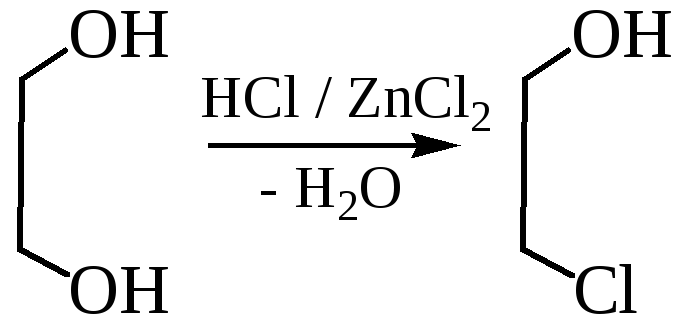
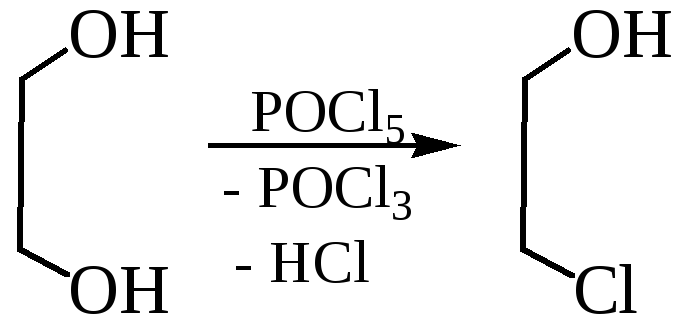
2.1.2
2.2 Образование простых эфиров, (реакция протекает в присутствии сильных кислот).
2.2.1 Линейных эфиров:
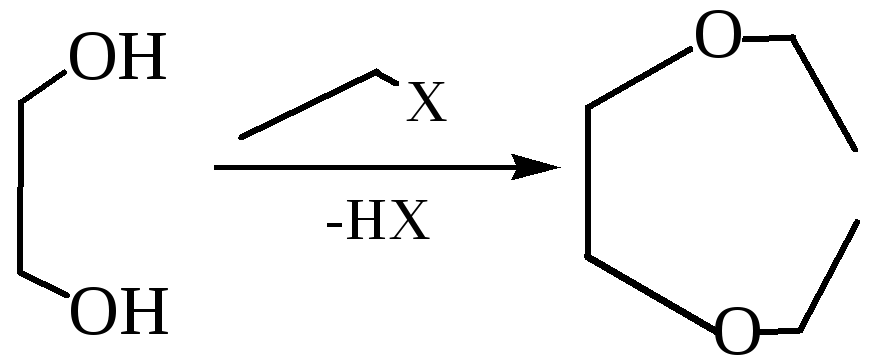
2.2.2 Циклических эфиров:
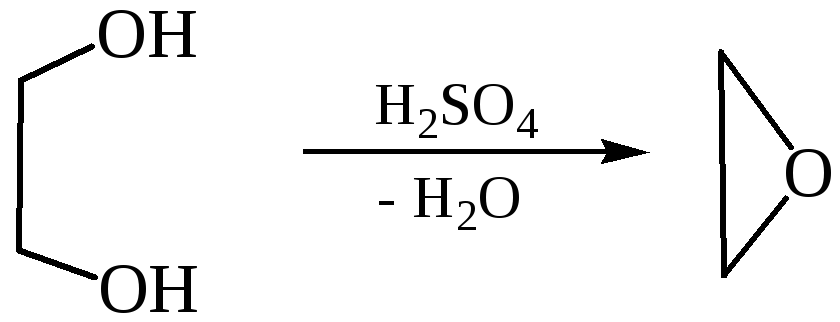
2.3 Образование сложных эфиров
2.3.1 С минеральными кислотами:

2.3.2 С карбоновыми кислотами и их производными:

3. Реакция дегидратации многоатомных спиртов (расщепление связи С–О). В присутствии водоотнимающих агентов и сильных кислот многоатомные спирты подвергаются дегидратации. Однако в зависимости от типа дегидратирующего агента, условий реакции, строения многоатомного спирта возможно протекание различных реакций, в результате чего может образоваться сложная смесь продуктов.
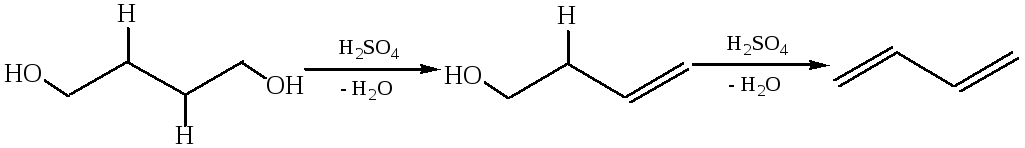
3.1 Внутримолекулярная дегидратация 1,2-, 1,3-, 1,4-диолов, возможно образование ненасыщенных спиртов, а затем сопряженных 1,3-диенов:
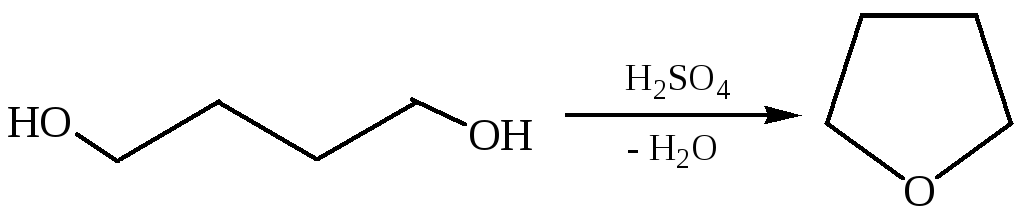
3.2 Внутримолекулярная циклизация 1,4- и 1,5-диолов с образованием циклических простых эфиров:
3.3 Внутримолекулярная дегидратация. Продуктом реакции в этом случае уксусный альдегид, так как виниловый спирт, образующийся на промежуточной стадии, неустойчив и претерпевает изомеризацию в уксусный альдегид:
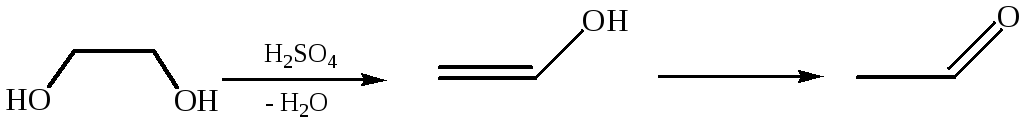
3.3.1 Дегидратация дитретичных 1,2-диолов (пинаконов). В зависимости от условий образуются различные продукты.
3.3.1.1 Нагревание с Al2O3 в качестве основного продукта образуется сопряженный диен:
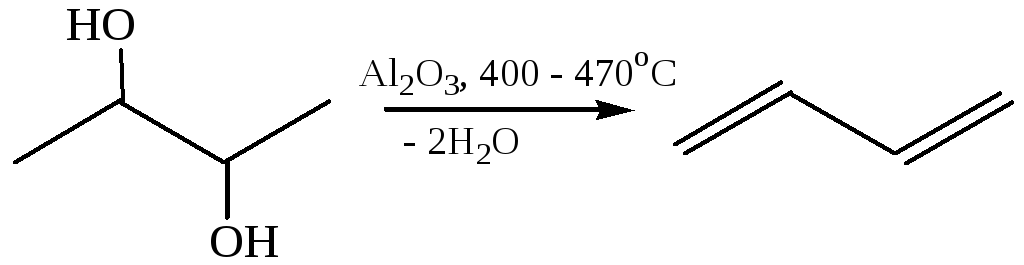
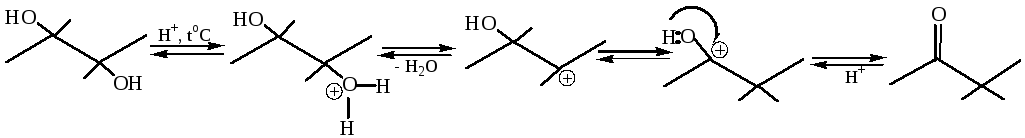
3.3.1.2 Кислотно-каталитическая дегидратация. Реакция сопровождается перегруппировкой углеродного скелета (пинаколиновая перегруппировка). Механизм реакции включает две стадии: 1) отщепление воды; 2) перегруппировка карбкатиона, за счет 1,2-алкильного сдвига:
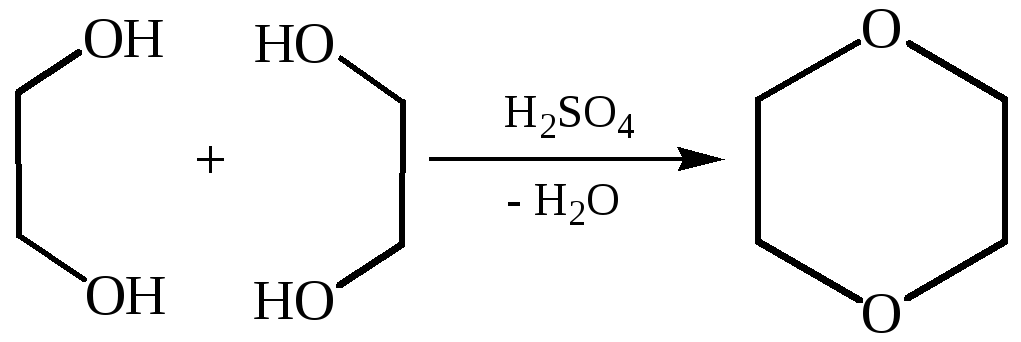
3.4 Межмолекулярная дегидратация с образованием простых эфиров:
3.5 Дегидратация глицерина, при нагревании с гидросульфатом калия, отщепляя две молекулы воды, глицерин превращается в непредельный альдегид – акролеин:
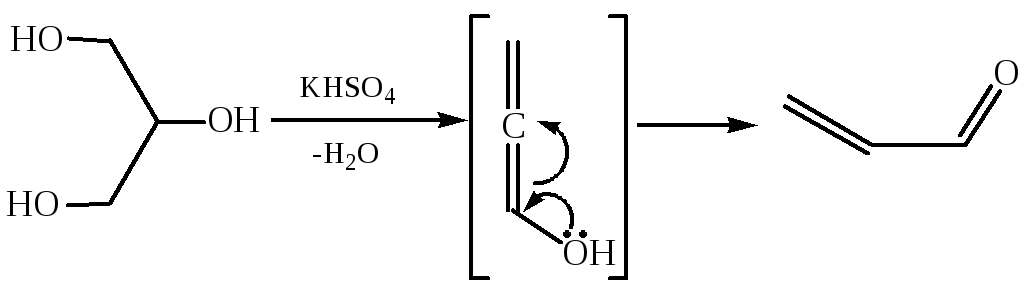
Акролеин обладает резким, неприятным запахом, раздражает слизистые оболочки носа и глаз.
4. Окисление многоатомных спиртов. Продукты окисления многоатомных спиртов многообразны, поскольку являются результатом последовательного окисления каждой гидроксильной группы до карбонильной и карбоксильной. В случае этиленгликоля, в зависимости от условий окисления и характера окислителя, могут получиться следующие продукты:
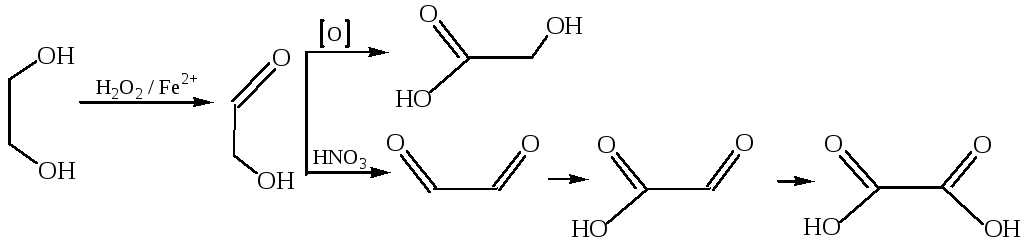
Все эти продукты являются метаболитами обменных процессов в живых организмах.
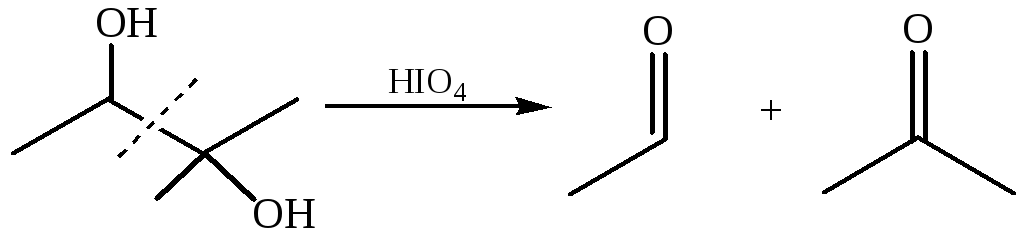
4.1 Реакция Малапрада (1928 г.). С накоплением в молекуле спирта гидроксильных групп легкость окисления возрастает. Α-гликоли могут подвергаться окислению под действием слабых окислителей – йодной кислоты или тетраацетата свинца. В результате окисления происходит разрыв С–С связи и образуются карбонильные и карбоксильные соединения: